Liz Romero
Oswaldo Tipiani
Steev Loyola
Jesús Tamariz
Artículo original
Actividad antimicrobiana in vitro del extracto de hojas de Bixa orellana L. contra bacterias anaerobias asociadas a la vaginosis bacteriana y Lactobacillus spp.
In vitro antimicrobial activity of Bixa orellana L. leaves extract against anaerobic bacteria associated to bacterial vaginosis and Lactobacillus spp..
Jenny Marcas ![]() 1, Biólogo
1, Biólogo
Liz Romero ![]() 1, Biólogo
1, Biólogo
Oswaldo Tipiani ![]() 2, Médico ginecólogo obstetra
2, Médico ginecólogo obstetra
Steev Loyola ![]() 1,3,
Tecnólogo médico, Magíster en Epidemiología
1,3,
Tecnólogo médico, Magíster en Epidemiología
Jesús Tamariz ![]() 1,3, Biólogo, Doctor en Ciencias Biológicas
1,3, Biólogo, Doctor en Ciencias Biológicas
1 Laboratorio de Resistencia Antimicrobiana e Inmunopatología, Universidad Peruana Cayetano Heredia, Lima, Perú
2 Hospital Municipal de Surco, Lima, Perú
3 Facultad de Medicina, Universidad Peruana Cayetano Heredia, Lima, Perú
RESUMEN
Objetivos. Describir la actividad antimicrobiana in vitro del extracto metanólico de las hojas de Bixa orellana L. contra las bacterias anaerobias asociadas a la vaginosis bacteriana y Lactobacillus spp. Materiales y métodos. Se incluyeron en el estudio ocho cepas de referencia ATCC; Gardnerella vaginalis, Prevotella bivia, Peptococcus niger, Peptostreptococcus anaerobius, Mobiluncus curtisii, Atopobium vaginae, Veillonella parvula y Lactobacillus crispatus, y 22 aislamientos clínicos; once aislados de Gardnerella vaginalis y once aislados de Lactobacillus. La susceptibilidad antimicrobiana se determinó mediante el método de difusión en agar. La concentración mínima inhibitoria (CMI) y la concentración bactericida mínima (CBM) fueron determinadas utilizando el método de dilución en agar y un método de dilución modificado, respectivamente. Resultados. Todas las cepas de referencia ATCC tuvieron un alto nivel de susceptibilidad al extracto, con excepción de P. vibia, V. parvula y L. crispatus. Interesantemente, los aislamientos clínicos de G. vaginalis y la cepa ATCC de G. vaginalis fueron los más susceptibles al extracto dados los bajos valores de CMI (1,0 – 2,0 mg/mL) y CBM (1,0 – 4,0 mg/mL), mientras que, los aislamientos clínicos de Lactobacillus spp. y la cepa ATCC de L. crispatus fueron los menos susceptibles debido a los altos valores de CMI (32,0 mg/mL) y CBM (≥ 32,0 mg/mL). Conclusiones. Los experimentos in vitro sugieren que el extracto posee propiedades antibacterianas selectivas dada su alta actividad contra bacterias anaerobias asociadas a vaginosis bacteriana y baja actividad contra especies de Lactobacillus.
Palabras clave: Bixa orellana; vaginosis bacteriana; Técnicas in vitro; Gardnerella vaginalis; Lactobacillus (Fuente: DeCS)
ABSTRACT
Objective. To describe the in vitro antimicrobial activity of the methanolic extract of Bixa orellana L. leaves against anaerobic bacteria associated to bacterial vaginosis and Lactobacillus spp. Materials and methods. Eight ATCC reference strains; Gardnerella vaginalis, Prevotella bivia, Peptococcus niger, Peptostreptococcus anaerobius, Mobiluncus curtisii, Atopobium vaginae, Veillonella parvula, and Lactobacillus crispatus, and twenty-two clinical isolates; eleven Gardnerella vaginalis and eleven Lactobacillus strains, were included in the study. The antimicrobial susceptibility was determined by the agar diffusion method. The minimum inhibitory concentration (MIC) and minimum bactericidal concentration (MBC) were determined by using agar dilution and a modified dilution plating method, respectively. Results. All ATCC reference strains showed high levels of susceptibility to the extract, except P. vibia, V. parvula and L. crispatus. Interestingly, all G. vaginalis clinical isolates and the G. vaginalis ATTC strain were the most susceptible to the extract, given their low MIC (1.0 – 2.0 mg/mL) and MBC (1.0 – 4.0 mg/mL) values, whereas, the Lactobacillus spp. clinical isolates and the L. crispatus ATCC strain were the least susceptible bacteria given their high MIC (32.0 mg/mL) and MBC (≥ 32.0 mg/mL) values. Conclusions. In vitro experiments suggest that the extract possesses selective antimicrobial properties given its high activity against bacterial vaginosis-associated anaerobic bacteria and low activity against Lactobacillus species.
Keywords: Bixa orellana; Vaginosis, bacterial; Plant Extracts; in vitro Techniques; Gardnerella vaginalis; Lactobacillus (Source: MeSH).
INTRODUCCIÓN
Las infecciones vaginales ocasionan más de 10 millones de visitas a los servicios de salud al año, principalmente debido a vaginosis bacteriana, candidiasis y tricomoniasis (1,2). La vaginosis bacteriana (VB) es la infección vaginal más frecuente entre las mujeres en edad reproductiva, y se caracteriza por la reducción o sustitución de lactobacilos y el aumento de bacterias anaerobias oportunistas (3-5). Los miembros del género Lactobacillus, como L. crispatus, L. jensenii y L. iners, son marcadores distintivos de un microbioma vaginal sano, mientras que Gardnerella vaginalis, Prevotella, Atopobium, Mobiluncus y Peptostreptococcus son bacterias anaerobias frecuentes asociadas a la VB (3,6).
El metronidazol oral o la clindamicina vaginal se utilizan habitualmente como opciones de tratamiento de primera línea para la VB; sin embargo, diversas bacterias patógenas, como las especies Mobiluncus y Atopobium, suelen ser resistentes a esos antimicrobianos (3,7-10). El uso intermitente y a largo plazo de metronidazol o clindamicina, y las infecciones por bacterias resistentes, suelen dar lugar a altas tasas de recurrencia de la VB en los primeros 12 meses de tratamiento (10-12). Además, también se ha notificado el aumento de la resistencia a los antimicrobianos en bacterias anaerobias después del tratamiento (2,7,8,13).
A pesar del aumento de la resistencia a los antimicrobianos y de las elevadas tasas de recaída, el desarrollo de nuevos fármacos ha sido escaso, por lo que sigue siendo necesario recurrir a los tratamientos disponibles (11,14). Los compuestos derivados de plantas representan una fuente de potenciales opciones terapéuticas para una variedad de infecciones bacterianas debido a su menor costo, toxicidad reducida, y a su menor riesgo de efectos secundarios (15,16). Bixa orellana L. es conocida en la medicina tradicional por sus propiedades farmacológicas, su actividad antimicrobiana y su reducida toxicidad (17-19). Por lo tanto, B. orellana se constituye como una fuente de fitoquímicos con prometedor potencial terapéutico que podría sustituir a los fármacos sintéticos utilizados para tratar la VB dada su eficacia antimicrobiana (19). El objetivo del estudio fue evaluar la actividad antimicrobiana in vitro de B. orellana contra bacterias anaerobias asociadas a la VB y cepas de Lactobacillus spp.
|
MENSAJES CLAVE |
|
Motivación para realizar el estudio: la vaginosis bacteriana es una infección bacteriana que afecta de forma frecuente a las mujeres en edad reproductiva. El tratamiento se basa en antimicrobianos sintéticos. Bixa orellana L. posee propiedades antimicrobianas y podría representar una potencial alternativa terapéutica no sintética. Principales hallazgos: los resultados in vitro sugieren que el extracto metanólico de las hojas de Bixa orellana L. posee potenciales propiedades antimicrobianas contra las bacterias asociadas a vaginosis bacteriana. Implicancias: identificar nuevas fuentes con potencial terapéutico, y promover la investigación, descubrimiento y caracterización de antimicrobianos no sintéticos. |
MATERIALES Y MÉTODOS
Diseño del estudio y material vegetal
Estudio experimental que evaluó preliminarmente la actividad antimicrobiana in vitro del extracto metanólico de B. orellana. Las hojas de B. orellana fueron recolectadas en la provincia de Chanchamayo (11,1215° S, 75,3587° O) de la región Junín, Perú, entre diciembre de 2018 y enero de 2019. Durante el periodo de colecta, la temperatura media diaria en Junín fue de 10,0°C (rango: 4,0°C - 15,0°C), y la precipitación media diaria fue de 23,7 mm, con hasta 100,0% de humedad relativa. La recolección fue realizada por personal de campo entrenado entre las 10:00 y las 14:00 horas. La identificación de B. orellana se basó en sus características botánicas (17) y en un análisis fitoquímico simplificado realizado por expertos botánicos del Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos y de la Universidad Peruana Cayetano Heredia (UPCH), respectivamente. Se depositó un espécimen en la UPCH (CDCJ2018).
Preparación del extracto
Se limpiaron las hojas de B. orellana, se secaron en un horno durante cuatro días a 40°C y se molieron. Se añadió un litro de metanol (Alemania, Darmstadt, Merck; número de catálogo: 106009) a 200 g del producto molido, y la mezcla se maceró durante siete días a temperatura ambiente en un recipiente de vidrio ámbar. Diariamente, el recipiente se agitó manualmente una vez durante cinco minutos. A continuación, la mezcla se filtró con papel Whatman N°2 y se secó en un horno a 40°C hasta que el metanol se evaporó, obteniéndose un extracto pastoso. Por último, el extracto se diluyó en dimetilsulfóxido (DMSO) al 40% (Alemania, Darmstadt, Merck; número de catálogo: D9170) para obtener una concentración final de 0,5 mg/µL. El extracto utilizado en los experimentos era líquido y tenía un color verde oscuro-marrón.
Recolección, cultivo e identificación de microorganismos
La actividad antimicrobiana del extracto se evaluó frente a dos grupos de bacterias: cepas de referencia de la American Type Culture Collection (ATCC) y aislamientos provenientes de muestras clínicas.
El primer grupo estuvo conformado por ocho cepas ATCC. Prevotella bivia (ATCC 29303), Peptococcus niger (ATCC 27731), Peptostreptococcus anaerobius (ATCC 27337), Mobiluncus curtisii (ATCC 43063), Atopobium vaginae (ATCC BAA-55) y Veillonella parvula (ATCC 10790) se recuperaron anaeróbicamente utilizando frascos GasPak (EE.UU., Maryland, Becton Dickinson; número de catálogo: 260626), mientras que Lactobacillus crispatus (ATCC 33197) y Gardnerella vaginalis (ATCC 14018) se recuperaron en un medio microaerófilo (EE.UU., Massachusetts, Thermo Fisher; número de catálogo: AN0025A). Los cultivos bacterianos se realizaron en agar sangre Columbia (Alemania, Darmstadt, Merck; número de catálogo: 27688), agar sangre humana tween (HBT) y agar Man-Rogosa-Sharpe (MRS) (Alemania, Darmstadt, Merck; número de catálogo: 1106600500) a 37°C como se describe en otros estudios (20-22). Se incluyó L. crispatus (ATCC 33197) como referencia del complejo Lactobacillus presente en la vagina humana sana, con el propósito de evaluar la actividad del extracto frente a un marcador bacteriano distintivo de un microbioma vaginal sano; mientras que las demás cepas ATCC se utilizaron como referencias de patógenos anaerobios asociados a la VB (3,6).
El segundo grupo estuvo conformado por veintidós aislamientos clínicos; once de G. vaginalis y once de Lactobacillus spp. Estas bacterias se aislaron entre septiembre y diciembre de 2019 de muestras obtenidas de mujeres adultas informadas por escrito en el marco de un proyecto de investigación aprobado por la el Comité Institucional de Ética (código: 104179) de la UPCH y el Hospital Municipal de Surco en Lima, Perú. Las muestras de secreción vaginal fueron recolectadas y transportadas a 4°C desde el Hospital a la UPCH, y procesadas dentro de las dos horas siguientes a la recolección. El diagnóstico de VB se realizó utilizando los criterios de Amsel (23), y las muestras positivas a Lactobacillus se cultivaron en agar MRS para el crecimiento selectivo de lactobacilos (21). Las muestras positivas a VB también se cultivaron en agar HBT para el aislamiento de G. vaginalis (22). A continuación, las placas se incubaron en frascos anaeróbicos GasPak utilizando generadores anaeróbicos o microaerófilos (EE.UU., Massachusetts, Thermo Fisher; número de catálogo: AN0025A) durante 72 horas. G. vaginalis y Lactobacillus spp. se identificaron utilizando las tarjetas de identificación Neisseria Haemophilus (EE.UU., Carolina del Norte, Biomérieux; número de catálogo: 21346), y Anaerobes y Corynebacteria (EE.UU., Carolina del Norte, Biomérieux; número de catálogo: 21347) en el sistema Vitek2, respectivamente.
Pruebas de susceptibilidad antimicrobiana
Método de difusión en disco de agar
Las bacterias se suspendieron en solución salina al 0,85% (8,5 g/L NaCl) y la turbidez se ajustó al estándar McFarland N° 0,5. Utilizando un hisopo estéril, se extendió el inóculo de Lactobacillus en agar MRS, y el de otras especies bacterianas en agar sangre Columbia. Posteriormente, con el dorso de una punta de pipeta estéril de 1 mL, se hicieron cuatro pocillos en el agar. Además, se colocaron sobre el agar cuatro discos estériles de papel de 6 mm (UK, Hampshire, Oxoid; número de catálogo: CT0998B) (Figura 1). Se utilizaron dos pocillos y dos discos de papel para evaluar el efecto inhibidor del crecimiento bacteriano del DMSO al 40%, y los otros pocillos y discos se utilizaron para evaluar la actividad antimicrobiana del extracto.
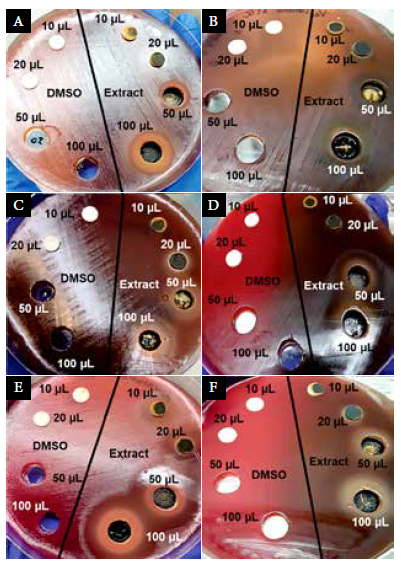
Figura 1. Pruebas de susceptibilidad antimicrobiana utilizando DMSO al 40% y extracto de B. orellana contra bacterias anaerobias; a) Prevotella bivia ATCC 29303, b) Veillonella parvula ATCC 10790, c) Atopobium vaginae ATCC BAA-55, d) Mobiluncus curtisii ATCC 43063, e) Peptoestreptococcus anaerobius ATCC 27337, y f) Peptococcus niger ATCC 27731. Los discos de papel estériles y pocillos en el lado izquierdo de cada placa se usaron para evaluar la actividad del DMSO al 40%, y aquellos en el lado derecho se usaron para evaluar el extracto.
La actividad del DMSO al 40% (Figura 1, en el lado izquierdo de las placas) se evaluó a diferentes volúmenes utilizando dilución 1:1 con solución salina; los discos se embebieron con 10 y 20 µl, y los pocillos se llenaron con 50 y 100 µl. Del mismo modo, se evaluó la actividad antimicrobiana del extracto utilizando los mismos volúmenes y procedimientos (Figura 1, a la derecha de las placas). Las placas se incubaron a 37°C, y al cabo de tres días se registraron las zonas de inhibición y se interpretaron según la escala de Duraffourd (24).
Concentración mínima inhibitoria (CMI)
El extracto en concentraciones de 1, 2, 4, 8, 16 y 32 mg/mL se añadió al agar Columbia suplementado con 5% de sangre de oveja, como se describió previamente (25). En cada placa se inocularon diez microlitros de una suspensión bacteriana con turbidez equivalente al estándar McFarland N.° 0,5. Las placas se incubaron en un ambiente anaeróbico o microaerófilo a 37°C, dependiendo de los requerimientos de crecimiento de cada especie bacteriana. La CMI se definió como la concentración más baja del extracto en la que no se observó crecimiento bacteriano (25). Se realizaron tres réplicas técnicas para cada evaluación. Como controles positivos se inocularon las cepas bacterianas en agar Columbia suplementado con 5% de sangre de oveja.
Concentración bactericida mínima (CBM)
Se utilizó como referencia un método descrito previamente con algunas modificaciones debido a que, dado el color oscuro del extracto, no fue posible determinar la CBM mediante un método convencional (26). A partir de las placas usadas para determinar la CMI, las regiones inoculadas sin crecimiento bacteriano evidente fueron raspadas con un asa de siembra estéril y luego se sembró en una placa con agar sin presencia de inhibidores. En función de los requerimientos bacterianos para el crecimiento, las placas se incubaron en condiciones anaeróbicas o microaerófilas a 37 °C durante 72 horas. La CBM se definió como la concentración de extracto más baja en la que no se observó crecimiento bacteriano. Se realizaron tres réplicas técnicas para cada determinación de la CBM.
Análisis estadístico
Los triplicados técnicos no presentaron variaciones significativas; por lo tanto, los datos se reportaron utilizando medias ± desviaciones estándar (DE). Se estimaron las CMI50, CMI90, CBM50 y CBM90 para el grupo de aislados clínicos. Por último, las diferencias de CMI y CBM entre los aislados clínicos de G. vaginalis y Lactobacillus se evaluaron mediante la prueba U de Mann-Whitney. El análisis de los datos se realizó en Stata v15 (StataCorp., College Station, TX, EE.UU.) considerando significativo un valor de p<0,050.
RESULTADOS
El DMSO al 40%, independientemente del volumen utilizado, no tuvo efecto bactericida ni bacteriostático frente a las cepas ATCC. En la Figura 1 (parte izquierda de las placas) se muestran los resultados de algunas cepas de referencia ATCC.
Actividad antimicrobiana frente a cepas de referencia ATCC
La zona de inhibición estuvo directamente relacionada con el volumen de extracto utilizado (Tabla 1). El extracto mostró una elevada actividad antimicrobiana contra todas las cepas de referencia ATCC, excepto L. crispatus ATCC 33197, P. bivia ATCC 29303 y V. parvula ATCC 10790 (Tabla 1). Curiosamente, el crecimiento de L. crispatus ATCC 33197 no se inhibió independientemente del volumen utilizado, y el crecimiento de V. parvula ATCC 10790 sólo se inhibió con 100 µl del extracto.
Tabla 1. Actividad in vitro del extracto de B. orellana L. frente a cepas de referencia ATCC.
|
Bacterias ATCC |
Zona de inhibición (mm) |
CMI (mg/mL) |
CBM (mg/mL) |
|||
|
10 µl a |
20µl a |
50 µl a |
100µl a |
|||
|
G. vaginalis (ATCC 14018) |
14,0 ± 1,0 |
20,3 ± 1,5 |
24,7 ± 0,6 |
30,3 ± 0,6 |
1,0 |
4,0 |
|
L. crispatus (ATCC 33197) |
0,0 ± 0,0 |
0,0 ± 0,0 |
0,0 ± 0,0 |
0,0 ± 0,0 |
32,0 |
32,0 |
|
A. vaginae (ATCC BAA-55) |
0,0 ± 0,0 |
12,0 ± 1,0 |
14,0 ± 1,0 |
18,3 ± 0,6 |
4,0 |
4,0 |
|
M. curtisii (ATCC 43063) |
0,0 ± 0,0 |
12,3 ± 1,2 |
18,3 ± 0,6 |
20,0 ± 1,0 |
4,0 |
8,0 |
|
P. niger (ATCC 27731) |
13,3 ± 0,6 |
15,0 ± 1,0 |
22,3 ± 0,6 |
25,0 ± 0,0 |
8,0 |
8,0 |
|
P. anaerobius (ATCC 27337) |
13,7 ± 1,5 |
18,7 ± 0,6 |
25.7 ± 1,2 |
28.3 ± 0,6 |
4,0 |
8,0 |
|
P. bivia (ATCC 29303) |
0,0 ± 0,0 |
10,3 ± 0,6 |
12,0 ± 1,0 |
18,7 ± 1,2 |
32,0 |
32,0 |
|
V. parvula (ATCC 10790) |
0,0 ± 0,0 |
0,0 ± 0,0 |
0,0 ± 0,0 |
12,3 ± 1,5 |
32,0 |
>32,0 |
a Media ± desviación estándar
En la tabla 1 se indican la CMI y la CBM para las cepas ATCC. G. vaginalis ATCC 14018 fue la bacteria más susceptible, con CMI y CBM de 1,0 mg/mL y 4,0 mg/mL, respectivamente. P. bivia ATCC 29303, V. parvula ATCC 10790 y L. crispatus ATCC 33197 fueron las bacterias más resistentes, mostrando valores de CMI y CBM más altos en comparación con otras cepas ATCC.
Actividad antimicrobiana frente a aislados clínicos
Entre los aislados clínicos de G. vaginalis, el más susceptible fue la cepa M10 (CMI y CBM: 1,0 mg/mL), seguida de las cepas MD (CMI: 1,0 mg/mL; CBM: 4,0 mg/mL) y M23 (CMI y CBM: 2,0 mg/mL), mientras que los otros ocho aislados mostraron valores de CMI y CBM de 2,0 mg/mL y 4,0 mg/mL, respectivamente (Tabla 2). En general, la CMI50 y la CMI90 fueron de 2 mg/mL, y la CBM50 y la CBM90 fueron de 4,0 mg/mL.
Los aislados de Lactobacillus spp. crecieron abundantemente en el intervalo de 1,0 a 16,0 mg/mL del extracto. Sin embargo, no hubo evidencia de crecimiento bacteriano a 32,0 mg/mL. En consecuencia, el valor CMI para todos los aislados clínicos de Lactobacillus spp. fue de 32,0 mg/mL (Tabla 2), y el CMI50 y CMI90 fueron de 32,0 mg/mL. En cuanto a la CBM, el 54,5% (6/11) de los aislados de Lactobacillus spp. (M7, M24, M25, M33, MA y MB; Tabla 2) mostraron un valor de 32,0 mg/mL, mientras que otros aislados clínicos mostraron valores superiores a 32,0 mg/mL. La CBM50 y la CBM90 para Lactobacillus spp. fueron 32,0 mg/mL y >32,0 mg/mL, respectivamente.
Tabla 2. Concentración mínima inhibitoria (CMI) y concentración bactericida mínima (CBM) en cepas de referencia ATCC y aislados clínicos de G. vaginalis y Lactobacillus spp.
|
Bacteria a |
CMI |
MBC |
|
|
G. vaginalis |
|||
|
M10 (n=1) |
1,0 mg/mL |
1,0 mg/mL |
|
|
ATCC 14018 y MD (n=2) |
1,0 mg/mL |
4,0 mg/mL |
|
|
M23 (n=1) |
2,0 mg/mL |
2,0 mg/mL |
|
|
MG, M5, M8, M9, M26, M29, M30 y M31 (n=8) |
2,0 mg/mL |
4,0 mg/mL |
|
|
Lactobacillus spp. |
|||
|
ATCC 33197, M7, M24, M25, M33, MA y MB (n=7) |
32,0 mg/mL |
32,0 mg/mL |
|
|
M1, M3, M4, M6 y M27 (n=5) |
32,0 mg/mL |
>32,0 mg/mL |
|
a Los aislados clínicos fueron codificados de la siguiente forma: M#, MD, MG, MA, y MB
El extracto mostró una actividad antimicrobiana significativa y diferencial entre las cepas de G. vaginalis y Lactobacillus spp. (p<0,001). Específicamente, los aislados de G. vaginalis se inhibieron a concentraciones bajas del extracto (CMI: 2,0 mg/mL, CBM: 4,0 mg/mL), mientras que los aislados de Lactobacillus spp. se inhibieron a concentraciones más altas (CMI: 32,0 mg/mL, CBM: 32,0 mg/mL).
DISCUSIÓN
En los últimos años, el uso de plantas o hierbas medicinales ha sido objeto de investigación científica debido a su actividad farmacológica, baja toxicidad y accesibilidad económica (15,16,19,25). Las plantas poseen y producen una amplia variedad de metabolitos secundarios como taninos, terpenoides, flavonoides, glucósidos, saponinas, antranoides, quinonas y cumarinas, a los que se han atribuido propiedades antimicrobianas (27). Varios estudios sugieren que B. orellana posee diversas propiedades, como actividad antimicrobiana, antifúngica, antioxidante, antiinflamatoria y analgésica (19, 28). La actividad antimicrobiana de B. orellana contra varios microorganismos ha sido descrita previamente (19,28), sin embargo, su actividad antimicrobiana sobre bacterias microaerófilas o anaeróbicas responsables de la VB ha sido escasamente descrita.
Nuestros resultados sugieren que, en ausencia de actividad bacteriostática o bactericida del DMSO al 40%, la actividad antimicrobiana observada puede atribuirse al extracto. Este hallazgo concuerda con otros informes que sugieren que los extractos de hojas de B. orellana, obtenidos por técnicas basadas en metanol o etanol, poseen actividad antimicrobiana contra cepas de referencia ATCC y aislados clínicos (19,29,30). Por lo tanto, sobre la base de nuestros resultados y los resultados reportados en otros estudios (19,28-30), es razonable considerar que el extracto evaluado posee actividad antimicrobiana.
La VB es una disbiosis caracterizada por cambios drásticos en la biota del tracto vaginal que dan lugar a una sustitución de la flora vaginal (predominantemente compuesta de lactobacilos) por bacterias anaerobias (3,6). G. vaginalis es una de las bacterias anaerobias más frecuentes causantes de VB, la cual puede formar, simbióticamente, una biopelícula polimicrobiana con bacterias anaerobias asociadas a VB, como A. vaginae y Prevotella spp (2,6,31). Otras bacterias anaerobias detectadas habitualmente en mujeres con VB son Peptoestreptococcus y Mobiluncus (6,32,33). Con respecto a los bajos valores observados de CMI y CBM, puede deducirse que el extracto evaluado en este estudio tiene una elevada actividad antimicrobiana frente a la mayoría de las cepas de referencia ATCC utilizadas y también frente a aislados clínicos de G. vaginalis. Sin embargo, es importante señalar que P. bivia y V. parvula, ambas cepas ATCC, mostraron baja susceptibilidad al extracto. Hasta donde sabemos, la actividad in vitro del extracto de B. orellana contra G. vaginalis y otros patógenos anaerobios apenas se ha descrito. Por lo tanto, se necesitan más estudios para validar nuestros hallazgos en una amplia variedad de aislados clínicos.
Los lactobacilos vaginales regulan el pH y protegen la mucosa frente al establecimiento de microorganismos patógenos (3,33). En este estudio, se utilizaron L. crispatus ATCC 33197 y aislados clínicos de Lactobacillus spp. como referencias del complejo de Lactobacillus que se encuentra en la vagina humana sana (6,32). Curiosamente, el extracto inhibió el crecimiento de los lactobacilos a concentraciones de 32,0 mg/mL. Sin embargo, nuestros resultados difieren de los descritos en otros estudios. Galindo-Cuspinera et al. (34) sugirieron que el extracto obtenido de frutos y semillas de B. orellana presentaba una actividad antimicrobiana limitada frente a L. lactis ATCC 11454 y L. casei ATCC 39539, y ninguna actividad frente a L. plantarum ATCC 700210. Del mismo modo, Ogunshe et al. (35) sugirieron que B. orellana tenía una actividad in vitro limitada contra varias cepas vaginales de Lactobacillus spp. En general, estos resultados discrepantes podrían explicarse por: i) el uso de diferentes métodos de extracción (es decir, tipo de extracto y disolvente utilizado) que dan lugar a una concentración variable de fitoquímicos, ii) el uso de diferentes partes de B. orellana (es decir, hojas, semillas, vainas o frutos) para la preparación del extracto, iii) la ubicación geográfica y la exposición a factores climáticos y medioambientales que afectan a B. orellana, y iv) por diferencias intrínsecas entre las cepas de Lactobacillus spp. utilizadas en otros estudios (19).
En general, nuestros hallazgos concuerdan con los de otros estudios que sugieren que el extracto de B. orellana posee actividad antimicrobiana (17-19,28,30). Un punto fuerte importante de este estudio in vitro es la evaluación de la actividad antimicrobiana del extracto frente a bacterias anaerobias representativas causantes de la VB y frente a bacterias representativas de la biota vaginal sana. Nuestros hallazgos pueden apoyar la ampliación y la innovación de la investigación para el desarrollo de posibles opciones terapéuticas. Sin embargo, también es importante tener en cuenta las limitaciones de este estudio in vitro. Hay múltiples fitoquímicos presentes en B. orellana, incluyendo flavonoides, polifenoles, taninos, quinonas, terpenoides y alcaloides que a través de procesos complejos ejercen actividad antimicrobiana (19). En este estudio preliminar no hemos caracterizado los compuestos fitoquímicos ni sus concentraciones; por lo tanto, no hemos podido establecer ni aislar la actividad antimicrobiana individual de cada componente del extracto frente a los aislados bacterianos estudiados. Además, es razonable suponer que la actividad antimicrobiana descrita no pueda extrapolarse a todas las especies de B. orellana, dadas las posibles diferencias intrínsecas entre ellas y las diferencias entre las formas de cultivo.
En resumen, nuestros experimentos in vitro sugieren que el extracto de B. orellana podría ser una fuente de compuestos antimicrobianos con una elevada actividad antimicrobiana selectiva contra la mayoría de las bacterias anaerobias asociadas a la VB, y con una actividad reducida contra las bacterias protectoras que se encuentran en la mucosa vaginal sana. Se necesitan más investigaciones para identificar el compuesto o los compuestos específicos con actividad antimicrobiana, para luego validar la actividad diferencial preliminarmente descrita aquí utilizando un diseño de estudio más riguroso y complejo.
Financiamiento: El estudio contó con el apoyo de INNOVATEPERU (030-INNOVATEPERU-ITAI-2016). Los financiadores no tuvieron ningún rol en el diseño del estudio, la recopilación y el análisis de datos, la decisión de publicar o la preparación del manuscrito
Referencias bibliográficas
1. Prabhu A, Gardella C. Common vaginal and vulvar disorders. Med Clin North Am. 2015;99(3):553-574. doi: 10.1016/j.mcna.2015.01.008.
2. Javed A, Parvaiz F, Manzoor S. Bacterial vaginosis: An insight into the prevalence, alternative treatments regimen and it’s associated resistance patterns. Microb Pathog. 2019;127:21-30. doi: 10.1016/j.micpath.2018.11.046.
3. Coudray MS, Madhivanan P. Bacterial vaginosis-A brief synopsis of the literature. Eur J Obstet Gynecol Reprod Biol. 2020;245:143-148. doi: 10.1016/j.ejogrb.2019.12.035.
4. van Schalkwyk J, Yudin MH. Vulvovaginitis: screening for and management of trichomoniasis, vulvovaginal candidiasis, and bacterial vaginosis. J Obstet Gynaecol Can. 2015;37(3):266-274. doi: 10.1016/S1701-2163(15)30316-9.
5. Abdul-Aziz M, Mahdy MAK, Abdul-Ghani R, Alhilali NA, Al-Mujahed LKA, Alabsi SA, et al. Bacterial vaginosis, vulvovaginal candidiasis and trichomonal vaginitis among reproductive-aged women seeking primary healthcare in Sana’a city, Yemen. BMC Infect Dis. 2019;19(1):879. doi: 10.1186/s12879-019-4549-3.
6. Onderdonk AB, Delaney ML, Fichorova RN. The Human Microbiome during Bacterial Vaginosis. Clin Microbiol Rev. 2016;29(2):223-238. doi: 10.1128/CMR.00075-15.
7. Tomás M, Palmeira-de-Oliveira A, Simões S, Martinez-de-Oliveira J, Palmeira-de-Oliveira R. Bacterial vaginosis: Standard treatments and alternative strategies. Int J Pharm. 2020;587:119659. doi: 10.1016/j.ijpharm.2020.119659.
8. Petrina MAB, Cosentino LA, Rabe LK, Hillier SL. Susceptibility of bacterial vaginosis (BV)-associated bacteria to secnidazole compared to metronidazole, tinidazole and clindamycin. Anaerobe. 2017;47:115-119. doi: 10.1016/j.anaerobe.2017.05.005.
9. Lopes dos Santos Santiago G, Grob P, Verstraelen H, Waser F, Vaneechoutte M. Susceptibility testing of Atopobium vaginae for dequalinium chloride. BMC Res Notes. 2012;5:151. doi:10.1186/1756-0500-5-151.
10. Faught BM, Reyes S. Characterization and Treatment of Recurrent Bacterial Vaginosis. J Womens Health (Larchmt). 2019;28(9):1218-1226. doi: 10.1089/jwh.2018.7383.
11. Larsson PG, Forsum U. Bacterial vaginosis--a disturbed bacterial flora and treatment enigma. APMIS. 2005;113(5):305-316. doi: 10.1111/j.1600-0463.2005.apm_113501.x.
12. Bradshaw CS, Morton AN, Hocking J, Garland SM, Morris MB, Moss LM, et al. High recurrence rates of bacterial vaginosis over the course of 12 months after oral metronidazole therapy and factors associated with recurrence. J Infect Dis. 2006;193(11):1478-1486. doi: 10.1086/503780.
13. Beigi RH, Austin MN, Meyn LA, Krohn MA, Hillier SL. Antimicrobial resistance associated with the treatment of bacterial vaginosis. Am J Obstet Gynecol. 2004;191(4):1124-1129. doi: 10.1016/j.ajog.2004.05.033.
14. Bradshaw CS, Sobel JD. Current Treatment of Bacterial Vaginosis-Limitations and Need for Innovation. J Infect Dis. 2016;214Suppl 1:S14-S20. doi: 10.1093/infdis/jiw159.
15. Cheesman MJ, Ilanko A, Blonk B, Cock IE. Developing New Antimicrobial Therapies: Are Synergistic Combinations of Plant Extracts/Compounds with Conventional Antibiotics the Solution? Pharmacogn Rev. 2017;11(22):57-72. doi: 10.4103/phrev.phrev_21_17.
16. Atanasov AG, Waltenberger B, Pferschy-Wenzig EM, Linder T, Wawrosch C, Uhrin P, et al. Discovery and resupply of pharmacologically active plant-derived natural products: A review. Biotechnol Adv. 2015;33(8):1582-1614. doi: 10.1016/j.biotechadv.2015.08.001.
17. Vilar Dde A, Vilar MS, de Lima e Moura TF, Raffin FN, de Oliveira MR, de Oliveira-Franco CM, et al. Traditional uses, chemical constituents, and biological activities of Bixa orellana L.: a review. ScientificWorldJournal. 2014;2014:857292. doi: 10.1155/2014/857292.
18. Stohs SJ. Safety and efficacy of Bixa orellana (achiote, annatto) leaf extracts. Phytother Res. 2014;28(7):956-960. doi: 10.1002/ptr.5088.
19. Coelho Dos Santos D, Silva Barboza AD, Ribeiro JS, Rodrigues Junior SA, Campos ÂD, Lund RG. Bixa orellana L. (Achiote, Annatto) as an antimicrobial agent: A scoping review of its efficiency and technological prospecting. J Ethnopharmacol. 2022;287:114961. doi: 10.1016/j.jep.2021.114961.
20. Rosca AS, Castro J, Cerca N. Evaluation of different culture media to support in vitro growth and biofilm formation of bacterial vaginosis-associated anaerobes. PeerJ. 2020;8:e9917. doi: 10.7717/peerj.9917.
21. Pendharkar S, Magopane T, Larsson PG, de Bruyn G, Gray GE, Hammarström L, Marcotte H. Identification and characterization of vaginal lactobacilli from South African women. BMC Infect Dis. 2013;13:43. doi: 10.1186/1471-2334-13-43.
22. Totten PA, Amsel R, Hale J, Piot P, Holmes KK. Selective differential human blood bilayer media for isolation of Gardnerella (Haemofilus) vaginalis. J Clin Microbiol. 1982;15(1):141-147. doi: 10.1128/JCM.15.1.141-147.1982.
23. Amsel R, Totten PA, Spiegel CA, Chen KC, Eschenbach D, Holmes KK. Nonspecific vaginitis. Diagnostic criteria and microbial and epidemiologic associations. Am J Med. 1983;74(1):14-22. doi: 10.1016/0002-9343(83)91112-9.
24. Duraffourd C, D’ Hervicourt L, La Praz JC. Cuaderno de Fitoterapia Clínica. Francia: Editorial Masson; 1983.
25. Klancnik A, Piskernik S, Jersek B, Mozina SS. Evaluation of diffusion and dilution methods to determine the antibacterial activity of plant extracts. J Microbiol Methods. 2010;81(2):121-126. doi: 10.1016/j.mimet.2010.02.004.
26. Mogana R, Adhikari A, Tzar MN, Ramliza R, Wiart C. Antibacterial activities of the extracts, fractions and isolated compounds from Canarium patentinervium Miq. against bacterial clinical isolates. BMC Complement Med Ther. 2020;20(1):55. doi: 10.1186/s12906-020-2837-5.
27. Patra AK. An Overview of Antimicrobial Properties of Different Classes of Phytochemicals. Dietary Phytochemicals and Microbes. 2012;1-32. doi: 10.1007/978-94-007-3926-0_1.
28. Poma-Castillo L, Espinoza-Poma M, Mauricio F, Mauricio-Vilchez C, Alvítez-Temoche D, Mayta-Tovalino F. Antifungal Activity of Ethanol-extracted Bixa orellana (L) (Achiote) on Candida albicans, at Six Different Concentrations. J Contemp Dent Pract [Internet]. 2019 [citado el 9 de diciembre de 2022]; 20(10): 1159-1163. Disponible en: https://thejcdp.com/doi/JCDP/pdf/10.5005/jp-journals-10024-2672.
29. Kar B, Chandar B, Rachana SS, Bhattacharya H, Bhattacharya D. Antibacterial and genotoxic activity of Bixa orellana, a folk medicine and food supplement against multidrug resistant clinical isolates. J Herb Med. 2022;32:100502. doi: 10.1016/j.hermed.2021.100502.
30. Banadkoki AZ, Kouhsari E, Amirmozafari N, Roudbary M, Nasrabadi MRB. Antibacterial, antifungal and cytotoxic activities of some medicinal plants against multidrug resistance pathogens. Rev Med Microbiol. 2018;29:182–188. doi: 10.1097/MRM.0000000000000146.
31. Rosca AS, Castro J, Sousa LGV, Cerca N. Gardnerella and vaginal health: the truth is out there. FEMS Microbiol Rev. 2020;44(1):73-105. doi: 10.1093/femsre/fuz027.
32. Srinivasan S, Hoffman NG, Morgan MT, Matsen FA, Fiedler TL, Hall RW, et al. Bacterial communities in women with bacterial vaginosis: high resolution phylogenetic analyses reveal relationships of microbiota to clinical criteria. PLoS One. 2012;7(6):e37818. doi: 10.1371/journal.pone.0037818.
33. Diop K, Dufour J-C, Levasseur A, Fenollar F. Exhaustive repertoire of human vaginal microbiota. Hum Microbiome J. 2019;11:100051. doi: 10.1016/j.humic.2018.11.002.
34. Galindo-Cuspinera V, Westhoff DC, Rankin SA. Antimicrobial properties of commercial annatto extracts against selected pathogenic, lactic acid, and spoilage microorganisms. J Food Prot. 2003;66(6):1074-1078. doi: 10.4315/0362-028x-66.6.1074.
35. Ogunshe AA, Lawal OA, Iheakanwa CI. Effects of simulated preparations of plants used in Nigerian traditional medicine on Candida spp. associated with vaginal candidiasis. Ethnobot Res Appl [Internet]. 2008 [citado el 2 de octubre de 2021]; 6:373–383. Disponible en: https://ethnobotanyjournal.org/era/index.php/era/article/view/165.
Citar como: Marcas J, Romero L, Tipiani O, Loyola S, Tamariz J. Actividad antimicrobiana in vitro del extracto de hojas de Bixa orellana L. contra bacterias anaerobias asociadas a la vaginosis bacteriana y Lactobacillus spp. Rev Peru Med Exp Salud Publica. 2022;39(4):408-14. doi: https://doi.org/10.17843/rpmesp.2022.394.11978.
Correspondencia: Steev Loyola; steev.loyola@gmail.com
Recibido: 11/08/2022
Aprobado: 14/12/2022
En línea: 27/12/2022