Reporte de Caso
Coinfección por Mycobacterium malmoense y Mycobacterium tuberculosis en paciente con el síndrome de inmunodeficiencia humana
Coinfection of Mycobacterium malmoense and mycobacterium tuberculosis in a patient with acquired inmune deficiency syndrome
Lilian María Mederos Cuervo1,a, Angélica Reyes Pérez 2,b, Lidunka Valdes Alonso3,c, Francisco Rodríguez Delgado 3,d, Misleydis Sardiñas Aragón3,e, María Rosarys Martínez Romero3,f, Raúl Díaz Romero3,g
1 Laboratorio Nacional de Referencia e Investigaciones de Micobacterias y Tuberculosis. La Habana, Cuba
2 Hospital Nacional de Referencia para la Atención a pacientes VIH/sida. La Habana, Cuba
3 Instituto de Medicina Tropical “Pedro Kourí”. La Habana, Cuba
a Licenciada en Microbiología, máster en Bacteriología-Micología; b especialista de primer grado de Nefrología, máster en Infectología; c especialista de segundo grado en Gastroenterología, máster en Infectología; d especialista de segundo grado en Medicina Interna, máster en Infectología; e licenciada en Tecnología de la Salud; f especialista de segundo grado de Microbiología, máster en Bacteriología Micología; g licenciado en Bioquímica, doctor en Ciencias Médicas.
Se presenta un caso de coinfección por Mycobacterium malmoense y Mycobacterium tuberculosis en un paciente cubano con síndrome de inmunodeficiencia adquirida (sida), que producía enfermedad respiratoria y hepática respectivamente. Los cultivos realizados a partir de las muestras de esputo demostraron la presencia de una cepa micobacteriana no pigmentada de crecimiento lento perteneciente al grupo III de Runyon e identificada como Mycobacterium malmoense. A partir de los cultivos del tejido hepático extraído laparoscópicamente se aisló una cepa posteriormente identificada como Mycobacterium tuberculosis. El estudio anatomopatológico confirmó el diagnóstico de tuberculosis, el paciente recibió tratamiento específico y evolucionó clínicamente bien. Se reporta un caso infrecuente de coinfección por Mycobacterium, el cual describe el primer reporte de tuberculosis hepática en una paciente con sida en Cuba.
Palabras clave: Coinfección; Mycobacterium tuberculosis; Infecciones por Mycobacterium; Síndrome de inmunodeficiencia adquirida (fuente: DeCS BIREME).
ABSTRACT
A case is presented of coinfection with Mycobacterium malmoense and Mycobacterium tuberculosis in a Cuban patient with AIDS which produced respiratory and liver disease respectively. Cultures done from sputum samples showed the presence of a non-pigmented, slow growing mycobacterial strain belonging to Runyon group III and identified as Mycobacterium malmoense. From cultures of liver tissue removed laparoscopically, a strain was isolated and subsequently identified as Mycobacterium tuberculosis. Anatomapathologic examination confirmed the diagnosis of tuberculosis, the patient received specific treatment and had a favorable clinical course. This report of a rare case of coinfection of Mycobacterium describes the first report of hepatic tuberculosis in a patient with AIDS in Cuba.
Key words: Coinfection; Mycobacterium tuberculosis; Mycobacterium infections; Acquired immunodeficiency syndrome (source: MeSH, NLM).
INTRODUCCIÓN
La tuberculosis (TB) es una enfermedad infectocontagiosa causada por Mycobacterium tuberculosis, patógeno tanto para el hombre como para algunos animales. Histológicamente se caracteriza por la formación de granulomas (1). El desarrollo o no de la infección tuberculosa está mediada por la respuesta de nuestro sistema inmune, entre otros factores, por esta razón en los pacientes con SIDA la incidencia de esta enfermedad va en franco aumento, pues precisamente la deficiencia de linfocitos CD4 hace que la infección en muchos casos se disemine rápidamente (2,3). Normalmente la enfermedad se localiza en los pulmones, pero puede afectar cualquier órgano del cuerpo humano. La enfermedad extrapulmonar puede afectar a ganglios linfáticos, la médula ósea, el hígado, el riñón, las meninges, el pericardio y el tracto gastrointestinal. Otras afecciones más raras son osteoarticular, peritonitis tuberculosa, laringitis, etc. (4-7).
Para el diagnóstico de la TB extrapulmonar usualmente se requiere utilizar métodos invasivos, su contagiosidad es mínima aun cuando el espécimen cultivado a partir de las lesiones sea positivo. Generalmente, el tratamiento es el mismo que para la TB pulmonar. El compromiso hepático por tuberculosis es una forma inusual de la enfermedad, clínicamente se presenta con absceso hepático tuberculoso que comúnmente se origina como consecuencia de la tuberculosis miliar primaria, pero también como afección parenquimatosa difusa del hígado, puede originar dolor en el hipocondrio derecho, hepatomegalia, íctero, síndrome febril y sudoraciones nocturnas (8-10).
Las enfermedades producidas por micobacterias no tuberculosas (MNT) eran hasta hace unas décadas poco frecuentes, sin embargo, actualmente asociándolas a la pandemia del sida, estas infecciones tienen un significativo incremento. Varios han sido los reportes de micobacteriosis por Mycobacterium malmoense, especie de crecimiento lento, perteneciente al Grupo III según clasificación realizada por Runyon en 1959, que mayoritariamente se aísla de infecciones pulmonares (10-13). El objetivo de este estudio es dar a conocer un infrecuente caso de coinfección por Mycobacterium malmoense y Mycobacterium tuberculosis, en el cual se describe el primer reporte de tuberculosis hepática en un paciente cubano con sida.
REPORTE DEL CASO
Paciente masculino de 42 años, raza blanca, alcohólico, fue diagnosticado como paciente VIH positivo el 1 de octubre de 2000. En el año 2004, por bajo conteo de CD4 (11%- 261 células) comenzó una terapia antirretroviral (TARGA) con lamivudina 150 mg/12 h; zidovudina 300 mg/12 h y nevirapina 200 mg/12 h, desde un inicio mantuvo mala adherencia al tratamiento manteniendo la cifra de CD4 en menos de 200 células, por lo que se determinó cambiar la nevirapina por indinavir 2400 mg/ día con lo que se obtuvo mejores resultados.
En enero de 2008 marcó parámetros de “paciente sida” por desarrollar una grave neurotoxoplasmosis que respondió favorablemente al tratamiento, posteriormente, se mantuvo estable hasta finales del año 2012 donde presentó episodio de sepsis respiratoria, astenia, anorexia, pérdida de peso, fiebre, tos y disnea mayor de 14 días, por lo que se decidió realizarle una radiografía de tórax, donde no se encontró imágenes difusas a neumonía; tres esputos seriados; bacteriológicos, micológicos y BAAR, todos analizados en los Laboratorios de Microbiología, Micología y Micobacteriología del Instituto de Medicina Tropical ¨Pedro Kourí¨ (IPK), La Habana, Cuba. Los esputos bacteriológicos y micológicos fueron negativos. A las muestras de esputo BAAR se les realizó las técnicas de examen directo o baciloscopía y cultivo; estas fueron descontaminadas y cultivadas a 37 °C (14-16), las tres baciloscopías tuvieron codificación 0. Las lecturas de los cultivos se realizaron semanalmente, de 3-4 semanas se detectó la presencia de algunas colonias, se le realizó tinción de Zielh Neelsen para descartar la presencia de BAAR, los cultivos fueron positivos con codificación entre 6-7 respectivamente (de 6-24 colonias y de 25-100 colonias).
La cepa fue identificada como Mycobacterium malmoense, especie no tuberculosa perteneciente al Grupo III según clasificación de Runyon (17); las pruebas realizadas fueron: presencia de pigmentos, tiempo de crecimiento, niacina, catalasa 68 °C, catalasa vertical, nitratasa, lipasa, ureasa, pirazidamidasa, arylsulfatasa, telurito de potasio, toma de hierro y tolerancia al NaCl al 5%.
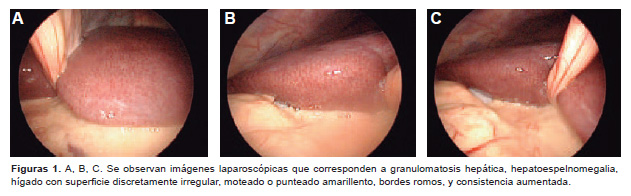
Posterior al diagnóstico, el paciente comienza tratamiento con claritromicina 500 mg/12 h, rifampicina 600 mg/24 h, etambutol 250 mg/8 h y ciprofloxacina 500 mg/12 h por 60 días, que mejoraron significativamente el cuadro respiratorio y la calidad de vida. Posteriormente, en febrero/2013 el paciente comienza a presentar; síndrome febril mantenido, orina oscura, fuerte ictericia de piel y mucosa y dolor abdominal intenso, por lo que se decide que ingrese en nuestra institución hospitalaria por presentar síndrome hepatorrenal, se le realizó los estudios analíticos complementarios requeridos, incluyendo una laparoscopia con biopsia de tejido hepático para descartar la presencia de BAAR. Los resultados de la hemoquímica fueron: glicemia 3,9 mmol/L, ácido úrico 333,6 umol/L, proteínas totales 8,2 g/dL , albúmina 3,4 g/dL, globulina 4,8 g/dL. AST 952 U/L, ALT 333 U/L, bilirrubina total 304,8 umol/L, bilirrubina directa 239,8 umol/L, bilirrubina indirecta 65 umol/L, GGT 125 U/L, LDH 271U/L, fosfatasa alcalina 178 U/L, úrea 13,4 mmmol/L, creatinina 191 umol/L y grupo y factor (AB+). El hemograma resultó: hemoglobina 93 g/L, leucocitos 3,3 x 10 9/L, Hto 028, segmentados 52, linfocitos 34, monocitos 12, y eosinófilos 2. La ecografía realizada mostró vesícula con imagen de litiasis de 16 mm, hígado aumentado de tamaño (180 mm, homogéneo), páncreas, bazo y riñones normales. Los resultados de la laparoscopía fueron: granulomatosis hepática, hepatoesplenomegalia, hígado con superficie discretamente irregular, moteado o punteado amarillento, cilindro hepático pequeño, fragmentado en dos hepatocitos con degeneración balonizante, colestasis, hepatocitos apoptóticos, ensanchamiento de espacios porta, infiltrado inflamatorio crónico periportal (Figura 1), resultados que también hubieran podido corresponder con hepatitis, por lo que se sugiere realizar estudios serológicos para hepatitis B y C los cuales resultaron negativos, VDRL negativo. El conteo de células CD4 durante todo este período fue variable.
La muestra de tejido hepático tomada por laparoscopía también fue procesada en el LNRI-TB/Micobacterias del IPK, por lo que se le realizó el estudio de cultivo BAAR. La muestra fue descontaminada, procesada y cultivada según técnica establecida en los Laboratorios de Micobacteriología 14-16. A partir de las 3-4 semanas se observó en los cultivos la presencia de colonias resecas, rugosas, no pigmentadas, de crecimiento lento, la codificación de los cultivos osciló entre 3-5 o sea aparición de 3 y 5 colonias respectivamente; para confirmar la presencia de BAAR se realizó la tinción de Zielh-Neelsen a partir de las colonias aisladas. La cepa fue identificada como Mycobacterium tuberculosis por las técnicas de niacina, catalasa 68°, nitratasa y por el test de detección del antígeno MPT64 (SDTB Ag MPT 64 Rapid, BIO-LINE).
Se discute iniciar tratamiento anti-TB al paciente, y se decide mantenerlo sin tratamiento por espacio de 1 mes hasta observar mejoría de la función hepática. Mejoró espontáneamente luego de la realización del drenaje, por lo que se comienza tratamiento antituberculoso con isoniacida 300 mg/día, rifampicina 600 mg/ día, pirazinamida 1500 mg/día y etambutol 1 g/día, tratamiento con el cual tuvo una evolución favorable, el paciente se siguió ambulatoriamente por consulta.
DISCUSIÓN
Dentro del género Mycobacterium, el agente causal más importante que produce TB tanto pulmonar como extrapulmonar sigue siendo Mycobacterium tuberculosis. Con la aparición del VIH, la tuberculosis ha tenido un significativo aumento; se ha planteado que esta coinfección es denominada como el “dúo mortal” uno acelera el avance de la otra y viceversa, por lo que cada día su temprano diagnóstico se hace más necesario. Lograr un diagnóstico temprano en esta patología infecciosa es muy importante para evitar la diseminación de la infección por vía linfática, sobre todo en los pacientes con algún problema en su sistema inmunitario, en particular los pacientes VIH/ sida. Como enfermedad infecciosa, el diagnóstico de esta patología extrapulmonar depende del aislamiento del microorganismo, que en algunos casos es difícil por la escasa concentración de gérmenes existentes en la muestra tomada (18).
El compromiso hepático por tuberculosis es una forma inusual de la enfermedad, debido a que en teoría, la baja tensión de oxígeno del hígado es poco favorable para el crecimiento de este germen que precisamente es estrictamente aeróbico, esta tiene un amplio espectro de presentación clínica, esta imprecisión diagnóstica la convierte en una enfermedad que difícilmente se sospecha, siendo por lo general identificada por toma de muestra de la lesión laparoscópicamente, o periodo posoperatorio. El tratamiento principal son las drogas antibacilares, pues muy ocasionalmente se requiere cirugía para las lesiones solitarias. La TB hepática es un evento inusual, con pocos casos reportados. El diagnóstico imagenológico de este tipo de tuberculosis extrapulmonar es un reto, las imágenes pueden imitar a una neoplasia maligna (primaria o metastásica), o a un proceso infeccioso, lo que dificulta el diagnóstico antes del estudio histológico (19-20).
Existen además otras infecciones denominadas “micobacteriosis” producidas por otras especies de micobacterias no tuberculosas MNT. En las últimas décadas estas infecciones alcanzan grados significativos y son ya reconocidas como enfermedad emergente.Apesar de que el pulmón es el órgano diana por excelencia de la tuberculosis y las micobacteriosis, cualquier otro órgano y sistema puede ser afectado. En la literatura han sido varios los reportes de estas infecciones respiratorias producidas por Mycobacterium malmoense, casi siempre asociada a pacientes con algún tipo de deterior inmunológico, en estos pacientes también se ha visto asociada a infecciones extrapulmonares y diseminadas.
La epidemiología de la infección por el género Mycobacterium en estos pacientes es muy variable en las poblaciones en dependencia de la eficacia de los programas de control de tuberculosis, la aplicación y adherencia a la TARGA, y la disponibilidad de tecnología médica (21-22).
La coinfección entre MNT y Mycobacterium tuberculosis es bastante infrecuente, los casos descritos generalmente se desarrollan en pacientes inmunodeficientes, particularmente en pacientes VIH/ sida. En nuestro laboratorio se realizó el primer reporte de esta inusual infección entre Mycobacterium gastri y Mycobacterium tuberculosis produciendo ambos patología respiratoria en un paciente sida (23-25).
En este reporte se describe el primer caso de coinfección por Mycobacterium malmoense y Mycobacterium tuberculosis en paciente sida, quien presentó afección respiratoria y posteriormente tuberculosis hepática. En esta oportunidad se demostró una vez más el importante valor de las técnicas convencionales de diagnóstico, en particular del examen de cultivo BAAR, tanto para las muestras pulmonares como extrapulmonares, en este caso procedente de muestras de biopsia a partir de fragmentos de tejido hepático tomados por laparospopía. Se hace un llamado de atención a los laboratorios de micobacteriología sobre los aislamientos micobacterianos que se obtengan a partir de todo tipo de material biológico obtenido de pacientes inmunodeficientes, pues en ellos el incremento de las infecciones por Mycobacterium se hacen más frecuentes, y la posibilidad de diseminación de la infección es mucho mayor, en algunos casos con resultado fatal.
Contribuciones de autoría: LMMC: Concepción y diseño del artículo, recolección y obtención de resultados, Análisis e interpretación de datos, Redacción del artículo, revisión crítica del artículo, aprobación de su versión final. ARP participó en la redacción del artículo, LVA aporte del paciente y material de estudio, FRD seguimiento clínico; MSA ayuda técnica, GGL ayuda técnica, RDR participo en la aprobación de su versión final y aprobación administrativa.
Referencias Bibliográficas
1. Ausina Ruiz V. Tuberculosis. En: Rozman F, 13 ed. Medicina Interna. Barcelona: Doyma; 1996. p. 2357-66.
2. Palomino JC. Current developments and future perspectives for TB diagnostics . Future Microbiol. 2012 Jan;7(1):59-71. doi: 10.2217/ fmb.11.133.
3. Bustamante R, Azuara B, Bustamante E, Villanueva B. Shock séptico por Mycobacterium tuberculosis . Med Intensiva 2006;30(5):236-9.
4. Fanlo P, Tiberio G. Tuberculosis extrapulmonar . An Sist Sanit Navar. 2007;30(Supl 2):143-62.
5. Hussain M, Rizvi N. Clinical and morphological evaluation of tuberculous peripheral lymphadenopathy . J Coll Physicians Surg Pak. 2003 Dec;13(12):694-6.
6. Mederos LM, Fleites G, Capó V, De Armás Yaxier, Acosta MA, Martínez MR, et al. Linfadenitis por Mycobacterium incluyendo pacientes infectados por el Virus de Inmunodeficiencia Humana . Arch Venez Farmacol Terap 2011;30:54-7.
7. Urrejola G, Villalón R, Rodríguez N. Ulceración perianal: dos casos de una rara manifestación de tuberculosis extrapulmonar . Rev Med Chile. 2010;138(2):220-2.
8. Gaya DR, Thorbum D, Oien KA, Morris AJ, Stanley AJ. Hepatic granulomas: a 10 year single centre experience . J Clin Pathol. 2003 Nov;56(11):850-3.
9. Matheus T, Muñoz S. Granulomatous liver disease and cholestasis . Clin Liver Dis. 2004 Feb;8(1):229-46.
10. Mederos LM, Fonseca C, Valdés L, Pérez D, Pomier O, Montoro EH. Infección diseminada por Mycobacterium malmoense en un paciente con SIDA. Salud (i) Ciencia 2009;16 (8):891-892. Mederos LM, Fonseca C, Valdés L, Pérez D, Pomier O, Montoro EH. Infección diseminada por Mycobacterium malmoense en un paciente con SIDA. Salud (i) Ciencia. 2009;16(8):891-92.
11. Mederos LM, González D, Pérez D, Paneque A, Montoro EH. Linfadenitis causada por Mycobacterium malmoense en paciente infectado con el virus de inmunodeficiencia humana . Rev Chil Infectol. 2004;21(3):229-31.
12. Hoefsloot W, van Ingen J, de Lange WC, Dekhuijzen PN, Boeree MJ, van Soolingen D.Clinical relevance of Mycobacterium malmoense isolation in The Netherlands . Eur Respir J. 2009 Oct;34(4):926-31. doi: 10.1183/09031936.00039009.
13. McGrath EE, Blades Z, McCabe J, Jarry H, Anderson PB. Nontuberculous mycobacteria and the lung: from suspicio to treatment . Lung. 2010 Aug;188(4):269-82. doi: 10.1007/ s00408-010-9240-9.
14. Organización Panamericana de la Salud. Manual para el diagnóstico bacteriológico de la tuberculosis. Normas y Guía técnica. Parte 2 Cultivo . Washington DC: OPS; 2008.
15. Organización Panamericana de la Salud. Manual para el diagnóstico bacteriológico de la tuberculosis. Normas y Guía técnica. Parte 1 Baciloscopía . Washington DC: OPS; 2008.
16. Baron EJ, Miller JM, Weinstein MP, Richter SS, Gilligan PH, Thomson RB Jr. et al. A guide to utilization of the microbiology laboratory for diagnosis of infectious diseases: 2013 recommendations by the Infectious Diseases Society of America (IDSA) and the American Society for Microbiology (ASM)(a) . Clin Infect Dis. 2013 Aug;57(4):e22-e121. doi: 10.1093/cid/cit278.
17. American Thoracic Society Documents. American Thoracic Society/Center for Disease Control and Prevention/ Infectious Diseases Society of America. Controlling Tuberculosis in the United States . Am J Respir Crit Care Med. 2005;172:1169-227.
18. Mederos LM. Infection for Mycobacte rium tuberculosis and Nontuberculous Mycobacteria in the HIV/AIDS patients . Part 1, Chapter 1. En: Venketaraman V. Global view of HIV infection. Croacia: InTech; 2011. p. 3-21.
19. Desai CS, Josh AG, Abraham P, Desai DC, Deshponde RB, Bhaduri A, et al.Hepatic tuberculosis in absence of disseminated abdominal tuberculosis . Ann Hepatol. 2006 Jan-Mar;5(1):41-3.
20. Cherki S, Cotte E, Boibieux A, Baulieux J, Adham M. [ Hepatic tuberculosis: case report of pseudotumoral form ]. Gastroenterol Clin Biol. 2006 Nov;30(11):1317-20. [Artículo en frances].
21. Nunes EA, De Capitani EM, Coelho E, Panunto AC, Joaquim OA, Ramos Mde C.Mycobacterium tuberculosis and nontuberculous mycobacterial isolates among patients with recent HIV infection in Mozambique . J Bras Pneumol. 2008 Oct;34(10):822-8.
22. Mederos LM, Blanco O, Fleites G, Acosta MA, Castro O. Escrofulosis inguinal bilateral diseminada por Mycobacterium avium-intracellulare en paciente inmunocompetente. La Habana: SIICSalud; 2013.
23. Sardar P, Bandyopadhyay D, Roy D, Guha P, Guha G, Banerjee AK. Non Tuberculous Mycobacteria and toxoplasma co-infection of the central nervous system in a patient with AIDS . Braz J Infect Dis. 2009 Dec;13(6):449-51.
24. de Armas Y, Capó V, Mederos LM, Díaz R, Hengge UR. Simultaneous Isolation of Mycobacterium gastri and Mycobacterium tuberculosis in a Patient With Human Immunodeficiency Virus Infection. Infect Dis Clin Prac. 2008; 20:156-60.
25. de Armas Y, Capó V, González I, Mederos L, Díaz R, de Waard JH, et al. Concomitant Mycobacterium avium infection and Hodgkin’s disease in a lymph node from an HIV negative child . Pathol Oncol Res. 2011 Mar;17(1):139-40. doi: 10.1007/ s12253-010-9275-5.
Correspondencia:
Lilian Mederos Cuervo
Dirección: Instituto de Medicina Tropical ¨Pedro Kourí¨
Teléfono: 255-3528
Correo electrónico:
mederos@ipk.sld.cu
Recibido: 21-02-14
Aprobado: 20-08-14