Artículo Original
Poblaciones linfocitarias, células dendríticas y perfil de citoquinas en ratones con melanoma tratados con Uncaria tomentosa
Lymphocyte subsets, dendritic cells and cytokine profiles in mice with melanoma treated with Uncaria tomentosa
Iván Lozada-Requena1,2,a, César Núñez 1,2,b, Yubell Alvárez1,c, Laura Kahn1,d, José Aguilar1,e
1 Laboratorio de Inmunología. Departamento de Ciencias Celulares y Moleculares. Facultad de Ciencias y Filosofía. Universidad Peruana Cayetano Heredia. Lima, Perú.
2 EMINDES SAC (empresa de investigación y desarrollo en cáncer). Lima, Perú.
a Magíster en Ciencias, b médico cirujano; c bióloga; d bachiller en Biología; e médico reumatólogo especialista en Inmunología
RESUMEN
Objetivos. Evaluar el efecto inmunomodulador sobre poblaciones linfocitarias, células dendríticas (DC), citoquinas Th1/Th2/Th17 (T-helper) e inflamatorias en el ámbito sistémico y/o en el microambiente tumoral de ratones con o sin melanoma. Materiales y métodos. Se obtuvieron muestras de sangre periférica y/o de tumores primarios de ratones con melanoma B16 tratados o no con un extracto hidroalcohólico de Uncaria tomentosa (UT) con 5,03% de alcaloides oxindólicos pentacíclicos (UT-POA) obtenido de la corteza de la planta. Todos los ensayos de medición de células y citoquinas fueron realizados por citometría de flujo. Resultados. UT-POA a nivel sistémico incrementa la relación CD4/CD8a (Cluster of Differenciation), mientras que la activación celular es inversamente proporcional; incrementa la proporción de DCm (DC mieloides); induce un perfil Th1 proinflamatorio y reduce la respuesta Th17. TNF-a (tumor necrosis factor alpha) y IL-17A (interleuquina) correlacionan positiva y negativamente con la relación CD4/CD8a. Conclusiones. El incremento de Th1 (TNF-a) puede tener como consecuencia el incremento de linfocitos CD4 o la activación de macrófagos M1. Aunque UT-POA muestra un incremento de DCm, este no es dosis-dependiente. La disminución de Th17 (IL-17A) puede favorecer el funcionamiento de los linfocitos CD8a. UT-POA muestra mejores efectos inmunomoduladores en el ámbito sistémico que intratumoral.
Palabras clave: Uncaria tomentosa; Activación de linfocitos; Células dendríticas; Melanoma (fuente: DeCS BIREME).
ABSTRACT
Objectives. To evaluate the immunomodulatory effect on lymphocyte subsets, dendritic cells (DC), Th1 / Th2 / Th17 and inflammatory cytokines on systemic level and/or in the tumor microenvironment of mice with or without melanoma. Materials and methods: Peripheral blood and/or primary tumors samples were obtained of mice with B16 melanoma treated or not with a hydroalcoholic extract of Uncaria tomentosa (UT) with 5.03% of pentacyclic oxindole alkaloids (UT-POA) obtained from the bark of the plant. All cell assays and cytokine measurements were performed by flow cytometry. Results. UT-POA systemically increased CD4/CD8a relation while cell activation was inversely proportional; increased the proportion of DCm; induced a pro-inflammatory Th1 profile and reduced Th17 response. TNF-α and IL-17A positively and negatively correlated with CD4/CD8a relation. Conclusions. The increase of Th1 (TNF-α) may result in the increase of CD4 or M1 macrophage activation. Although UT-POA shows increased DCm, is not dose-dependent. Th17(IL-17A) decreased can support the function of CD8a lymphocytes. UT-POA shows better systemic immunomodulatory effects than intratumoral.
Key words: Uncaria tomentosa; Lymphocyte activation; Dendritic cells; Melanoma (source: MeSH NLM).
INTRODUCCIÓN
El melanoma maligno, tumor derivado de melanocitos cutáneos, es la forma más mortífera de cáncer de piel (1). El incremento de melanoma humano se relaciona con factores hereditarios o étnicos; ambientales, como exposición a rayos UV; nutricionales y de estilo de vida (2). Los modelos murinos como melanoma B16 en ratones BALB/c y C57BL/6 son aceptados por el entendimiento de su genética y porque reproducen características presentes en el humano (3). Por tanto, este modelo se utiliza para la evaluación de drogas, inmunoterapias y plantas medicinales.
Las plantas medicinales tienen reducidos efectos colaterales, baja citotoxicidad, capacidad de actuar sobre células blanco sin afectar a células normales y, además, son una opción terapéutica de bajo costo. Las investigaciones con plantas medicinales tienen resultados alentadores. Park W-B et al. evaluaron el efecto de las lectinas de Viscum album (muérdago) en ratones con melanoma, encontrando un efecto proapoptótico, antiangiogénico, antimetastásico e incrementador de la supervivencia (4). Currier NL et al. demostraron un aumento de células Natural killer (NK) en ratones con leucemia y tratados con Echinacea purpurea (Equinacea) (5). El polifenol epigalato (EG) derivado de Camelia sinensis (té verde) posee actividad antimetastásica. Asimismo, el epigalatocatequina 3 galato (EGCG) y la dacarbazina en ratones con melanoma redujeron la metástasis y el crecimiento tumoral (6).
La Uncaria tomentosa (UT) (uña de gato), es una liana de la selva amazónica peruana con propiedades antinflamatorias, antioxidantes, inmunomoduladoras y antiproliferativas (7,8). Dreifuss et al., utilizando el mismo extracto de este estudio, demostró efectos antitumorales y antioxidantes en ratas Walker-256 con carcinosarcoma (9). También se ha demostrado la actividad antiproliferativa y antitumoral de la UT en líneas celulares de cáncer de mama (MT-3) y sarcoma de Ewing (MHH-ES-a) (10). Aunque existen pocos estudios en humanos, se destaca uno que demuestra una mejora en la calidad de vida en pacientes con tumores sólidos (11) y otro que demuestra una reducción de la neutropenia y restauración del daño del ADN relacionado con quimioterapia (12). La UT contiene glicósidos del ácido quinóvico, esteroides, polifenoles, triterpenos polihidroxilados, proantocianidinas, catequinas, saponinas, taninos, esteroles, flavonoides y alcaloides; sin embargo, los más importantes efectos se dan cuando estos compuestos actúan en sinergia (13). Sheng et al. demostraron que C-MED100 (un extracto de UT con menos de 0,05% de alcaloides oxindólicos) incrementó los linfocitos T (LT) en ratas con leucopenia inducida por doxorubicina (14). Además, repara el ADN de esplenocitos de rata irradiados con UV (15). Aguilar et al. y Aquino et al., demostraron que los extractos etanólico y metánolico de UT reducen la inflamación en el edema plantar (7,16). Sandoval et al., demostraron que la inhibición de la inflamación se relaciona con la disminución de TNF-α y es mediado por la inhibición de NFκB (17). Fazio et al., demostraron que la UT reduce tumores de melanoma, metástasis pulmonar e inhibe TNF-α e IL-6 (8).
Sobre inflamación y cáncer, no se sabe aún si es el estado de inflamación crónica el que lleva al desarrollo de células neoplásicas, o viceversa (18). Coussens et al. demostraron la presencia de factores de crecimiento, TNF-α y especies reactivas del oxígeno (ROS) en el microambiente tumoral (MT), las cuales causan daño al ADN e inician las neoplasias (19). La inmunoterapia tumoral induce una inmunidad mediada por células, como las vacunas de células dendríticas (DC) o la activación de LT CD4+, involucrados con una protección directa contra el desarrollo de células tumorales y la regresión de tumores (20). Asimismo, el aumento de IL-2 por tumores ha resultado en una disminución de masas tumorales dosis-dependiente (21), y se ha visto que PBI-1393 es capaz de reducir tamaños tumorales así como de estimular a linfocitos para que produzcan IFN e IL-2 antitumorales (22). Todo indica que los LT cumplen un rol crucial en la defensa del huésped contra la enfermedad. Los LT CD4+ se diferencian en subpoblaciones Th1, Th2, Th17, Th22, Treg, Th9, Th foliculares (23); sin embargo, por mucho tiempo el sistema Th1/Th2 representó una paradoja inmunológica. Las Th1 (IFN-γ e IL-2) o citoquinas proinflamatorias promueven la respuesta a patógenos intracelulares. Los linfocitos Th1 reconocen antígenos tumorales, ya sea directamente (algunos melanomas expresan MHC II in situ) o por mecanismos de presentación cruzada por DC (24). Es posible que las Th1, a través de IFN-γ, generen una respuesta antitumoral en la que no participan directamente los LT CD8 debido a que activan a NK, macrófagos y monocitos, involucrados en la defensa contra neoplasias (25); mientras que las Th2 (IL-4, IL-5 y IL-10) o citoquinas antiinflamatorias estimulan la eliminación de parásitos extracelulares e inducen la polarización de macrófagos asociados al tumor (TAM) o M2d que inducirían la progresión del cáncer (26); aunque también se les atribuye un rol anticancerígeno porque indirectamente activarían al sistema fagocítico a liberar ROS y óxido nítrico sintetasa (NOS) que ejercen citotoxicidad sobre células tumorales (27).
En melanoma, hay estudios in vivo e in vitro que demuestran una direccionalidad Th2 (28). La otra subpoblación descubierta es la Th17, esta se genera en presencia de TGF-β e IL-6 y prolifera bajo la influencia de IL-23 (29). En el desarrollo de tumores, las Th17 se encontraron en cáncer de próstata y en el MT (30). Las citoquinas producidas, incluyendo IL-17, tienen funciones controversiales. Por un lado perjudican la función de los LT CD8+ y promueven la carcinogénesis y neovascularización de tumores vía STAT3, pero por otro lado, se les ha atribuido función antitumoral. El hecho de que puedan causar inflamación y destrucción de tejido las hace de interés en la terapia de cáncer. La IL-17 induce la producción de citoquinas inflamatorias y quimioquinas cerca al MT, lo que facilitaría el reclutamiento de DC especializadas en la presentación de antígenos tumorales y células efectoras citotóxicas como los LT CD8+, NK y NKT que atacarían al tumor (31). Las DC tienen varias subpoblaciones y las más importantes son las DC mieloides (DCm) y las plasmacitoides (DCp) (32, ambas son importantes en la respuesta antitumoral (33).
Todos estos datos sugieren que las poblaciones inmunocompetentes, el balance Th1/Th2/Th17 y las citoquinas inflamatorias son importantes en el desarrollo del cáncer. Toda la evidencia indica una correlación, pero aún no se precisa el rol específico de las citoquinas, ni la complejidad de sus interacciones. Por tal motivo, en este estudio, a través del uso de un modelo de melanoma murino tratado con un extracto de UT, se evaluó el efecto modulador sobre poblaciones linfocitarias y DC y el perfil de citoquinas Th1/Th2/Th17 e inflamatorias en el ámbito sistémico y en el MT.
MATERIALES Y MÉTODOS
DISEÑO EXPERIMENTAL
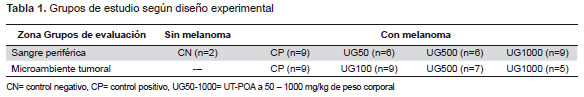
Se utilizaron 62 ratones divididos en 4 o 5 grupos experimentales según zona de evaluación (Tabla 1). Se les administró un extracto hidroalcohólico de UT con 5,03% de alcaloides oxindólicos pentacíclicos (UT-POA) o agua destilada (control negativo, CN) con sonda gástrica, 7 días antes de la inoculación de las células B16, y por 22 días en el caso de la evaluación en sangre periférica (PB) o hasta que el tumor alcanzará 4,5 mm en la evaluación del MT.
Uncaria tomentosa (UT)
Se utilizó un extracto hidroalcohólico obtenido de la corteza de UT, en forma de un polvo fino color marrón rojizo. Este extracto fue proporcionado cordialmente por Peruvian Heritage®, preparado por decocción usando etanol y agua en proporción de 70:30 por 1 h a 20 ºC y subsecuente secado por atomización, contuvo 5,03% de alcaloides oxindólicos pentacíclicos, cuantificados por cromatografía líquida de alta eficiencia (HPLC) según lo indicado por Dreifuss et al. (9). Se preparó una solución stock de UT-POA: 30 g diluidos en 1L de agua bidestilada, hervir por 30 min, decantar, filtrar dos veces en papel Whatman N.° 3 y microfiltrar (0,22 um) para esterilizar.
ANIMALES
Se obtuvieron ratones C57BL/6, hembras y machos aleatorizados, del Bioterio de la Universidad Peruana Cayetano Heredia. Los experimentos se desarrollaron con grupos en promedio de 6 ratones de 7 a 9 semanas y de 20-25 g. Se les proporcionó alimento balanceado estándar y agua ad-libitum. Los extractos de UT-POA y el agua destilada fueron administrados diariamente con sonda gástrica (Tabla 1).
CULTIVO DE LÍNEA CELULAR B16
La línea celular B16/BL6 (melanoma murino), se cultivó en 5% CO2, a 37 °C, en RPMI-1640 con 10% de suero bovino fetal, penicilina (100 U/mL), estreptomicina (100 ug/mL) y piruvato de sodio 0,01%. Tras confluencias mayores a 70% las células fueron tripsinizadas, lavadas, contadas y resuspendidas en PBS pH 7,2 para su uso.
INDUCCIÓN DE TUMOR
La dosis estandarizada para la inoculación subcutánea fue 5x104 células/100 uL de suspensión. Las células se inocularon en el flanco izquierdo de la región abdominal. En el caso de la evaluación en PB los animales fueron sacrificados el día 22, mientras que en la evaluación del MT se sacrificaron cuando el tumor alcanzó un tamaño de 4,5 mm.
AISLAMIENTO Y CULTIVO DE CÉLULAS MONONUCLEARES DE SANGRE PERIFÉRICA (PBMC) Y DEL MICROAMBIENTE TUMORAL (MTMC)
El día 22 se obtuvieron muestras de PB por punción cardiaca (aproximadamente 1 mL) y se realizó un pool de 2 a 3 animales diluyendo la sangre en partes iguales con RPMI-1640 completo (Sigma, St Louis, MO, USA). En el caso del tumor sólido (4,5 mm), este se disecó, se fragmento mecánicamente, se digirió con colagenasa tipo I al 1% (Gibco, USA) durante 30 min a 37 ºC y se diluyó en partes iguales con RPMI-1640 completo. Con ambos tipos de muestra se realizó una gradiente de densidad por centrifugación con tubos con 3 mL o 1 mL de Histopaque 1,083 g/mL (Sigma, St Louis, MO, USA), respectivamente. Se centrifugó a 1800 rpm a temperatura ambiente (TA) por 30 min, sin freno. Se recuperó el anillo celular, se lavó dos veces con 15 mL de RPMI-1640 completo a TA el primer lavado y a 4 °C el segundo lavado a 2500 rpm por 10 min. Se contaron las células en una cámara de Neubauer, relación 1:1 con azul de Trypan (Sigma, St Louis, MO, USA). Una vez aisladas las PBMC o MTMC, se sembraron 5x104 células por cada 100 uL de suspensión en tubos estériles, y se incubaron a 37 °C con 5% de CO2 en RPMI-1640 completo por 24 h. Se obtuvieron los sobrenadantes de cultivo (SND) para la medición de citoquinas y las células fueron lavadas y suspendidas en Cell wash (solución de lavado celular, 1% suero fetal bovino (Hyclone) en PBS (pH 7,4)).
CITOMETRÍA DE FLUJO
Se utilizaron anticuerpos monoclonales específicos marcados con fluorocromos: anti-CD3-PerCP, CD4-FITC, CD8a-PE, CD44-APC, CD69-PerCP, CD8a-APC, CD11b-FITC, I-Ad-PE y CD11c-APC y sus respectivos controles de isotipo (Becton Dickinson, San Jose, CA, USA). La titulación de los anticuerpos, compensación y adquisición fueron realizados con un citómetro de flujo FACSCantoTM II (BD Immunocytometry Systems, USA). El análisis de los datos se realizó con el software Flow Jo v X10.0.7r2.
En todos los casos, las respectivas combinaciones de cuatro anticuerpos, según la población o poblaciones por identificar, fueron agregados a tubos que contenían las células. Se incubaron por 30 min a 2-8 °C, y luego se lavaron dos veces con 1 mL de Cell wash a 1800 rpm por 5 min. Finalmente, los sedimentos celulares fueron resuspendidos en 500 μL de Cell fix (1% paraformaldehído en PBS pH 7,4) y adquiridos en el citómetro.
CITOMETRÍA DE FLUJO PARA LA DETERMINACIÓN DE CITOQUINAS POR CBA (CYTOMETRIC BEAD ARRAY)
Se utilizaron kits de medición de citoquinas por citometría (BD CBA Mouse Th1/Th2/Th17 y Inflammation kits, USA) para la determinación cuantitativa de citoquinas Th1 (IFN-γ, IL-2); Th2 (IL-4, IL-6, IL-10); Th17 (IL-17A) y citoquinas inflamatorias (IL-6, IL-10, MCP-1 [proteína quimioatrayente de monocitos], IFN-γ, TNF-α y IL-12p70). Los SND fueron procesados siguiendo estrictamente las instrucciones del fabricante. La adquisición de datos se hizo en un citómetro de flujo FACSCantoTM II (BD Immunocytometry Systems, USA) y el análisis de datos en el software BD™ Cytometric Bead Array Software, version 1.4.
ANÁLISIS ESTADÍSTICO
Los resultados son presentados como el promedio ± EEM (error estándar de la media). Se realizó el test-T one-tailed; el ANOVA One-way, seguido por el test Pos hoc de comparación de medias de Dunnett y el test de correlación de Pearson, one-tailed usando GraphPad Prism version 6.00 para Mac, GraphPad Software, La Jolla California USA. Se consideraron significativos valores de p<0,05.
CONSIDERACIONES ÉTICAS
Todos los experimentos con animales fueron desarrollados de acuerdo con Principles of Laboratory Animal Care (Publicación NIH 85-23, revisado en 1985). El proyecto fue aprobado por el Comité Institucional de Ética de la Universidad Peruana Cayetano Heredia, código de inscripción 56290 (SIDISI).
RESULTADOS
RELACIÓN CD4+/CD8a+ Y ACTIVACIÓN LINFOCITARIA EN PB Y MT
Se determinó el porcentaje de poblaciones de LT helper (CD3+CD4+) y citotóxicos (CD3+CD8a+) y se calculó la relación CD4/CD8a. Adicionalmente, a ambas poblaciones de LT se les midió el nivel de activación con dos marcadores que se pueden utilizar indistintamente, CD44 y CD69. Las poblaciones se midieron en grupos tratados o no con UT-POA con respecto al PBMC (50, 500 y 1000 mg/kg) y en el MTMC (100, 500 y 1000 mg/kg). Los resultados indican que la relación CD4/CD8a se incrementó significativamente en el ámbito sistémico a 1000mg/kg de UT-POA (Figura 1A); mientras que la activación celular sistémica expresada por la relación CD4+CD44+/CD8a+CD44+ fue incrementada significativamente a 50 mg/kg y 500mg/kg y aunque a 1000 mg/kg se muestra mayor nivel de activación que el CP este no fue significativo (Figura 1C ). En el MT no se encontraron cambios significativos ni en la relación CD4/CD8a, ni en la relación de activación CD4+CD69+/CD8a+CD69+ (Figura 1B y 1D).
POBLACIONES INMUNOCOMPETENTES EN MT
Se determinaron los porcentajes de LT totales (CD3+); linfocitos NK (NK1.1+CD3-); linfocitos NKT (NK1.1+CD3+) y células dendríticas mieloides (DCm, CD11c+CD11bbrigth) y plasmacitoides (DCp, CD11c+CD11blow/-) en el MT de ratones tratados o no con UT-POA (100, 500 y 1000 mg/kg). Los resultados muestran que ninguna de las poblaciones de LT, NK y NKT presentó alguna variación significativa ante el tratamiento con UT-POA (Figura 2A-D , Figura 3). Asimismo, se encontró que UT-POA a 100 mg/kg incrementó significativamente el porcentaje de DCm, mientras que las DCp no sufrieron variación (Figura 2E-F). Histológicamente, se observó la presencia de células inmunocompetentes en el microambiente tumoral (Figura 2G).
CITOQUINAS SISTÉMICAS Y DEL MT
Se determinó por citometría (CBA) la concentración de citoquinas Th1 (IFN-γ, TNF-a) y Th2 (IL-6, IL-10) en el sobrenadante de PBMC y MTMC; Th17 (IL17-A) en PBMC; Th1 (IL-2) y Th2 (IL-4) en PBMC; IL-12p70 y MCP-1 en MTMC. Se determinó un incremento de TNF-a (Figura 4C) y una disminución de IL-17A significativos en PBMC a 1000 mg/kg de UT-POA (Figura 5). No se obtuvieron diferencias significativas con IL-2 y IL-4 en PBMC ni IL-12p70 y MCP-1 en MTMC (datos no publicados).
CORRELACIÓN ENTRE LT Y CITOQUINAS SISTÉMICAS
Se evaluó la correlación entre la relación de LT CD4/CD8a, TNF-a y IL-17A. Los resultados indican que existe una correlación positiva (r=0,8559) entre CD4/CD8a y TNF-a y una correlación negativa (r=0,8344) entre CD4/CD8a y IL-17A. En ambos casos hubo significancia estadística (p<0,05) (Figura 6).
DISCUSIÓN
Este es el primer estudio que evalúa el efecto de un extracto de Uncaria tomentosa en el MT. Anteriormente se han hecho mediciones con respecto a MT solo para evaluar parámetros oxidativos en homogenizados de tumor en el modelo Walker-256 con ratas (9). En melanoma B16 se ha evaluado en metástasis pulmonar (8). Se han medido poblaciones de LT CD4 y CD8a y citoquinas Th1/Th2 en cultivo de esplenocitos, pero de ratones Balb-c sanos (34). Nuestros resultados indican que existe un incremento significativo en la relación CD4/CD8a de los LT provenientes de PBMC de ratones con melanoma tratados con 1000 mg/kg de peso corporal a diferencia del MT, este incremento implica la presencia de un mayor porcentaje de LT CD4+ o helper, linfocitos que se caracterizan por colaborar activamente con la respuesta inmune celular, ya que son capaces de activar a NK, NKT, macrófagos, LT citotóxicos y Linfocitos B.
Estos resultados son similares a los de Domingues et al., quien encuentra un incremento de los LT CD4+ a 125 y 500 mg/kg de un extracto hidroetanólico, aunque, como se mencionó, se utilizaron ratones sanos. De tal manera, que es probable que una mayor dosis de UT-POA en ratones con melanoma sea necesaria para generar un incremento como ha sido nuestro caso. El nivel de activación (CD44+) de la relación CD4+CD44+/CD8a+CD44+ fue inverso, es decir, a concentraciones menores (50 y 500 mg/kg de UT-POA) existió un incremento significativo; mientras que a 1000 mg/kg la relación fue menor pero aún se mantuvo por encima del control positivo. Estos resultados sugieren que UT-POA es capaz de incrementar no solo el porcentaje de LTCD4 sino también su nivel de activación. Es posible que el nivel de activación sea dependiente de la dosis de UT-POA, pero se esperaba que en el MT esta diferencia se mantenga; sin embargo, no cambió significativamente con respecto al CP. Aunque no hay diferencias en la relación de porcentajes y activación de estas células en el MT es importante destacar su presencia y, además, la posibilidad de que su actividad se vea afectada por factores tumorales liberados por el melanoma. En este estudio no fue posible evaluar otras poblaciones linfocitarias del ámbito sistémico; sin embargo, sí se hizo en el MT donde estas poblaciones linfocitarias representadas por LT totales, NK y NKT no fueron modificadas por el tratamiento con UT-POA; sin embargo, también es importante destacar su presencia y el posible efecto inhibidor de factores tumorales.
Esta demostrada la capacidad de las DC mieloides (DCm) de intervenir e inducir las respuestas Th1 antitumorales. Nuestros resultados demuestran que UT-POA a 100 mg/kg indujo un incremento significativo del %DCm y a esta misma concentración el %DCp es 7,5 veces menor que %DCm, este hecho podría ser explicado por los estudios de Zuniga et al. quien sostiene que tras una infección viral las DCp pueden convertirse en DCm adoptando cambios fenotípicos y funcionales, incluyendo la mejora en la capacidad de presentación de antígenos. En nuestro caso, es posible que UT-POA logre un efecto similar al encontrado por Zuniga. Sin embargo, habría que investigar cuáles son los mecanismos y si realmente ocurren, o si simplemente es un efecto dirigido específicamente a las DCm, mientras que las DCp se encuentran normalmente a las cantidades encontradas.
El TNF-a es producido no solo por macrófagos activados sino también por células tumorales, y en cáncer se le atribuye un comportamiento paradójico, ya que es requerida para la proliferación y función de NK, LT, LB, macrófagos y DC y es una molécula importante en la eliminación mediada por células de ciertos tumores, al menos en la etapa aguda de la enfermedad. Cuando es producida por macrófagos genera una polarización M1 que podría ser útil en la etapa aguda; sin embargo, las evidencias también demuestran que el TNF-a es uno de los principales mediadores de la inflamación relacionada con cáncer y que actúa como un factor protumoral, al menos en la etapa crónica de la enfermedad (35). Nuestros resultados muestran un incremento significativo de TNF-a a 1000 mg/kg en el ámbito sistémico, y este incremento se correlaciona positivamente con la relación de LT CD4/CD8a, lo que en nuestro modelo se puede interpretar como un efecto inductor de UT-POA de una respuesta celular adaptativa durante los 29 días de régimen de tratamiento, que podríamos considerarlos como la etapa aguda. La IL17-A también muestra un comportamiento paradójico ya que puede perjudicar la acción de los LT CD8, pero también puede inducir la aparición de citoquinas inflamatorias y quimioquinas que atraerían a LT CD8, NK y DC (31).
Nuestros resultados muestran una correlación negativa entre IL-17A y la relación CD4/CD8a a 1000 mg/kg, es decir, que la disminución de IL-17A por UT-POA se podría asociar con una baja proporción de LT CD8a en el ámbito sistémico. Aunque en este estudio no se pudo evaluar los niveles de IL17-A en el MT, hubiese sido importante determinar si la presencia de linfocitos y DC se correlacionaban con esta citoquina. La evaluación de algunos parámetros inmunológicos nos permite concluir que UT-POA muestra mejores efectos a nivel sistémico que en el MT, mejorando principalmente la relación CD4/CD8a e induciendo respuestas tipo Th1 o inflamatoria o de polarización de macrófagos M1 y reduciendo la respuesta Th17. Aunque estos efectos se observan a dosis altas debemos tener en cuenta que luego de la primera extracción hidroalcohólica se hizo una segunda extracción acuosa, con lo que es posible que algunos compuestos hayan sido disueltos y su potencia haya disminuido; sin embargo, a pesar de esta condición UT mostró efectos inmunomoduladores. Sugerimos evaluar este extracto sólo con la primera extracción hidroalcohólica. Según lo anterior, las concentraciones utilizadas deben ser tomadas como referenciales. A pesar que el modelo estudiado utiliza un tipo de cáncer extremadamente agresivo, los resultados obtenidos son una buena referencia para estudios futuros de la capacidad antitumoral de UT-POA y su uso como adyuvante en el tratamiento convencional del cáncer.
Agradecimientos: este trabajo ha sido subvencionado por EMINDES CANCER SAC (empresa de investigación y desarrollo en cáncer). Se agradece a la empresa Becton Dickinson del Uruguay SA Sucursal Perú por su apoyo para la realización de la citometría de flujo. Se agradece a los integrantes del Laboratorio de Inmunología (LID-108), Laboratorios de Investigación y Desarrollo (LID), Universidad Peruana Cayetano Heredia, Lima-Perú.
Contribuciones de autoría: ILR y CN participaron en la concepción y diseño del protocolo del estudio y en la obtención del financiamiento. ILR, YA, LK participaron en la recolección de muestras, obtención de resultados y realización del análisis estadístico de los datos. ILR, CN, YA, LK y JA participaron en el análisis y redacción del artículo. Todos los autores han dado su revisión crítica del artículo.
Fuentes de financiamiento: este estudio fue financiado por EMINDES SAC.
Conflictos de interés: no hay ningún potencial conflicto de interés.
Referencias Bibliográficas
1. Parkin DM, Bray F, Ferlay J, Pisani P. Global Cancer Statistics, 2002 . CA Cancer J Clin. 2005;55(2):74–108. [Enlace]
2. Naldi L, Altieri A, Imberti GL, Giordano L, Gallus S, La Vecchia C, et al. Cutaneous malignant melanoma in women. Phenotypic characteristics, sun exposure, and hormonal factors: A case-control study from Italy . Ann Epidemiol. 2005;15(16):545–50. [Enlace]
3. Dwek M, Brooks SA, Schumacher U. NY: Metastasis Research Protocols. Humana Press; 2012.
4. Park WB, Lyu SY, Kim JH, Choi SH, Chung HK, Ahn SH, et al. Inhibition of tumor growth and metastasis by Korean mistletoe lectin is associated with apoptosis and antiangiogenesis. Cancer Biother Radiopharm. 2001;16(5):439–47. [Enlace]
5. Currier NL, Miller SC. Echinacea purpurea and melatonin augment natural-killer cells in leukemic mice and prolong life span . J Altern Complement Med. 2001;7(3):241–51. [Enlace]
6. Liu JD, Chen SH, Lin CL, Tsai SH, Liang YC. Inhibition of melanoma growth and metastasis by combination with (-)-epigallocatechin-3-gallate and dacarbazine in mice . J Cell Biochem. 2001;83(4):631–42. [Enlace]
7. Aguilar L, Rojas P, Marcelo A, Plaza A, Bauer R, Reininger E , et al. Anti-inflammatory activity of two different extracts of Uncaria tomentosa (Rubiaceae) . J Ethnopharmacol. 2002;81(2):271–6. [Enlace]
8. Fazio AL, Ballén D, Cesari IM, Abad MJ, Arsenak M, Taylor P. An ethanolic extract of Uncaria tomentosa reduces inflammation and B16- BL6 melanoma growth in C57BL/6 mice. Bol Latinoam Caribe Plant Med Aromaticas. 2008;7:217–24. [Enlace]
9. Dreifuss AA, Bastos-pereira AL, Avila TV, Soley Bda S , Rivero AJ , Aguilar JL , et al. Antitumoral and antioxidant effects of a hydroalcoholic extract of cat’s claw (Uncaria tomentosa) (Willd. Ex Roem. & Schult) in an in vivo carcinosarcoma model . J Ethnopharmacol. 2010;130(1):127-33. doi: 10.1016/j.jep.2010.04.029. [Enlace]
10. García Giménez D, García Prado E, Sáenz Rodríguez T, Fernández Arche A, De La Puerta R. Cytotoxic effect of the pentacyclic oxindole alkaloid mitraphylline isolated from Uncaria tomentosa bark on human Ewing’s sarcoma and breast cancer cell lines . Planta Med. 2010;76(2):133-6. doi: 10.1055/s-0029-1186048. [Enlace]
11. de Paula CL, Fonseca F, Perazzo F, Cruz FM, Cubero D, Trufelli DC, et al. Uncaria tomentosa (cat’s claw) improves quality of life in patients with advanced solid tumors . J Altern Complement Med. 2015;21(1):22-30. doi: 10.1089/acm.2014.0127. [Enlace]
12. Santos Araújo Mdo C, Farias IL, Gutierres J, Dalmora SL, Flores N, Farias J, et al. Uncaria tomentosa-adjuvant treatment for breast cancer: clinical trial . Evid Based Complement Alternat Med. 2012;2012:676984. doi: 10.1155/2012/676984. [Enlace]
13. Falkiewicz B. Vilcacora [Uncaria tomentosa (Willd.) DC. and Uncaria guianensis (Aublet) Gmell.]–a review of published scientific literature . Case Rep Clin Pr Rev. 2001;2(4):305–16. [Enlace]
14. Sheng Y, Pero RW, Wagner H. Treatment of chemotherapy-induced leukopenia in a rat model with aqueous extract from Uncaria tomentosa. Phytomedicine. 2000;7(2):137–43. [Enlace]
15. Sheng Y, Bryngelsson C, Pero RW. Enhanced DNA repair, immune function and reduced toxicity of C-MED-100, a novel aqueous extract from Uncaria tomentosa . J Ethnopharmacol. 2000;69(2):115–26. [Enlace]
16. Aquino R, De Feo V, De Simone F, Pizza C, Cirino G. Plant metabolites. New compounds and anti-inflammatory activity of Uncaria tomentosa . J Nat Prod. 1991;54(2):453–9. [Enlace]
17. Sandoval M, Charbonnet RM, Okuhama NN, Roberts J, Krenova Z, Trentacosti AM, et al. Cat’s claw inhibits TNFalpha production and scavenges free radicals: role in cytoprotection . Free Radic Biol Med. 2000;29(1):71–8. [Enlace]
18. Rakoff-nahoum S. Why Cancer and Inflammation ? Yale J Biol Med. 2006;79(3-4):123–30. [Enlace]
19. Coussens LM, Werb Z. Inflammation and cancer . Nature. 2002;420(6917):860–7. [Enlace]
20. Zhang S, Li W, Xia Z, Mao Y. CD4 T cell dependent tumor immunity stimulated by dendritic cell based vaccine . Biochem Biophys Res Commun. 2011;413(2):294-8. doi: 10.1016/j.bbrc.2011.08.089. [Enlace]
21. Schmidt W, Schweighoffer T, Herbst E, Maass G, Berger M, Schilcher F, et al. Cancer vaccines: the interleukin 2 dosage effect . Proc Natl Acad Sci USA. 1995;92(10):4711–4. [Enlace]
22. Allam M, Julien N, Zacharie B, Penney C, Gagnon L. Enhancement of Th1 type cytokine production and primary T cell activation by PBI-1393 . Clin Immunol. 2007;125:318–27. [Enlace]
23. Zhu J, Paul WE. Heterogeneity and plasticity of T helper cells . Cell Res. 2010;20(1):4-12. doi: 10.1038/cr.2009.138. [Enlace]
24. Coffman RL. Origins of the T(H)1-T(H)2 model : a personal perspective . Nat Immunol. 2006;7(6):539–41. [Enlace]
25. Goto S, Sato M, Kaneko R, Itoh M, Sato S, Takeuchi S. Analysis of Th1 and Th2 cytokine production by peripheral blood mononuclear cells as a parameter of immunological dysfunction in advanced cancer patients . Cancer Immunol Immunother. 1999;48:435–42. [Enlace]
26. Kidd P. Th1/Th2 balance: the hypothesis, its limitations, and implications for health and disease . Altern Med Rev. 2003 Aug;8(3):223-46. [Enlace]
27. Dranoff G. Cytokines in cancer pathogenesis and cancer therapy . Nat Rev Cancer 2004;4(1):11–22. [Enlace]
28. Lee AF, Sieling PA, Lee DJ. Immune correlates of melanoma survival in adoptive cell therapy . Oncoimmunology. 2013;2(2):e22889. [Enlace]
29. Harrington LE, Hatton RD, Mangan PR, Turner H, Murphy TL, Murphy KM, et al. Interleukin 17-producing CD4+ effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages . Nat Immunol. 2005;6(11):1123–32. [Enlace]
30. Steiner GE, Newman ME, Paikl D, Stix U, Memaran-Dagda N, Lee C, et al. Expression and function of pro-inflammatory interleukin IL-17 and IL-17 receptor in normal, benign hyperplastic, and malignant prostate . Prostate. 2003;56(3):171–82. [Enlace]
31. Zou W, Restifo NP. T(H)17 cells in tumour immunity and immunotherapy . Nat Rev Immunol. 2010;10(4):248–56. doi: 10.1038/nri2742. [Enlace]
32. Zuniga EI, McGavern DB, Pruneda-Paz JL, Teng C, Oldstone MB. Bone marrow plasmacytoid dendritic cells can differentiate into myeloid dendritic cells upon virus infection . Nat Immunol. 2004;5(12):1227–34. [Enlace]
33. Aspord C, Leccia MT, Charles J, Plumas J. Plasmacytoid dendritic cells support melanoma progression by promoting Th2 and regulatory immunity through OX40L and ICOSL . Cancer Immunol Res. 2013;1(6):402–15. doi: 10.1158/2326-6066.CIR-13-0114-T. [Enlace]
34. Domingues A, Sartori A, Maria L, Valente M, Golim MA, Siani AC, et al. Uncaria tomentosa aqueous-ethanol extract triggers an immunomodulation toward a Th2 cytokine profile . Phyther Res. 2011;25(8):1229–35. doi: 10.1002/ptr.3549. [Enlace]
35. Wu Y, Zhou BP. TNF-alpha/NF-kappaB/Snail pathway in cancer cell migration and invasion . Br J Cancer. 2010;102(4):639–44. doi: 10.1038/sj.bjc.6605530. [Enlace]
Correspondencia: Iván Lozada Requena
Dirección: Av. Honorio Delgado 430 Urb. Ingeniería – San Martin de Porres. Lima, Perú.
Teléfono: (511) 998674601
Correo electrónico: ivan.lozada@upch.pe
Recibido: 05-03-15
Aprobado: 23-07-15