Artículo Original
Propuesta de esquemas de tratamiento antituberculosis basados en la susceptibilidad a isoniacida y rifampicina
Proposal of anti-tuberculosis regimens based on susceptibility to isoniazid and rifampicin
Alberto Mendoza-Ticona1,a, David AJ Moore2,a, Valentina Alarcón3,b, Frine Samalvides4,a, Carlos Seas 4,a
1 Instituto Nacional de Salud, Lima, Perú.
2 London School of Tropical Medicine and Hygiene. Imperial College London. London, England.
3 Estrategia Sanitaria Nacional de Prevención y Control de la Tuberculosis, Ministerio de Salud. Lima, Perú.
4 Instituto de Medicina Tropical Alexander von Humboldt, Universidad Peruana Cayetano Heredia. Lima, Perú.
a Médico infectólogo; b médico cirujano
* El presente estudio fue presentado como exposición oral en la 41 Conferencia Mundial de La Unión Internacional Contra la Tuberculosis y Enfermedades Respiratorias en Berlín, 2010.
RESUMEN
Objetivo. Elaborar esquemas de tratamiento para tuberculosis de acuerdo con sus perfiles de susceptibilidad a isoniacida (H) y rifampicina (R). Materiales y métodos. Un total de 12 311 aislamientos de M. tuberculosis (Instituto Nacional de Salud, 2007-2009) se clasificaron en cuatro grupos de acuerdo con su susceptibilidad a H y R. En cada grupo se analizó la sensibilidad a etambutol (E), pirazinamida (Z), estreptomicina (S), kanamicina (Km), capreomicina (Cm), ciprofloxacina (Cfx), etionamida (Eto), cicloserina (Cs) y ácido p-amino salicílico (PAS). En base a los perfiles de resistencia, principios de terapéutica de la Organización Mundial de la Salud y costos en el país, se elaboraron los esquemas más adecuados para cada grupo. Se definió la eficacia potencial (EP) como la proporción de cepas sensibles a tres o cuatro drogas del esquema evaluado. Resultados. Los esquemas con el menor costo y la mayor EP a tres y cuatro drogas para tuberculosis sensible a H y R fueron: HRZ (EP=99,5%), HREZ (EP=99,1%); REZCfx (EP=98,9%) y para tuberculosis resistente a H: REZCfxKm (EP=97,7%). Para tuberculosis resistente a R: HEZCfx (EP=96,8%) y HEZCfxKm (EP=95,4%); el esquema con mejor eficacia potencial para tuberculosis multidrogorresistente fue EZCfxKmEtoCs (EP=82,9%). Conclusión. Basados en la resistencia a H y R se han elaborado y seleccionado esquemas de tratamiento con la más alta probabilidad de eficacia. Esta propuesta es una alternativa viable para hacer frente a la tuberculosis en Perú donde el acceso a pruebas de sensibilidad rápida a H y R se viene expandiendo.
Palabras clave: Tuberculosis; Tratamiento; Pruebas diagnósticas de rutina; Isoniazida; Rifampicina; Perú (fuente: DeCS BIREME).
ABSTRACT
Objective: To elaborate optimal anti-tuberculosis regimens following drug susceptibility testing (DST) to isoniazid (H) and rifampicin (R). Design: 12 311 M. tuberculosis strains (National Health Institute of Peru 2007-2009) were classified in four groups according H and R resistance. In each group the sensitivity to ethambutol (E), pirazinamide (Z), streptomycin (S), kanamycin (Km), capreomycin (Cm), ciprofloxacin (Cfx), ethionamide (Eto), cicloserine (Cs) and p-amino salicilic acid (PAS) was determined. Based on resistance profiles, domestic costs, and following WHO guidelines, we elaborated and selected optimal putative regimens for each group. The potential efficacy (PE) variable was defined as the proportion of strains sensitive to at least three or four drugs for each regimen evaluated. Results: Selected regimes with the lowest cost, and highest PE of containing 3 and 4 effective drugs for TB sensitive to H and R were: HRZ (99,5%) and HREZ (99,1%), respectively; RZECfx (PE=98,9%) and RZECfxKm (PE=97,7%) for TB resistant to H; HZECfx (96,8%) and HZECfxKm (95,4%) for TB resistant to R; and EZCfxKmEtoCs (82.9%) for MDR-TB. Conclusion: Based on resistance to H and R it was possible to select anti-tuberculosis regimens with high probability of success. This proposal is a feasible alternative to tackle tuberculosis in Peru where the access to rapid DST to H and R is improving progressively.
Key words: Tuberculosis; Therapy; Diagnostic tests, routine; Isoniazid; Rifampin (source: MeSH NLM).
INTRODUCCIÓN
La expansión de las pruebas de susceptibilidad a drogas (PSD) antituberculosis es un paso fundamental para disminuir la incidencia de tuberculosis (TB) resistente (1, 2). Varias PSD rápidas para la detección de TB multidrogorresistente (TB-MDR) están siendo aprobadas e implementadas en países en desarrollo (3, 4). La Organización Mundial de la Salud (OMS) respalda tanto a las PSD rápidas que evalúan simultaneamente la resistencia a rifampicina (R) e isoniacida (H) (5), como la prueba de observación microscópica para la susceptibilidad a drogas (MODS, por sus siglas en inglés) (6), la prueba de nitrato reductasa (o prueba Griess) (7) y la prueba molecular de sondas y de ADN (Genotype® MTBDR plus) (8); como las PSD rápidas para determiar la resistencia solo a rifampicina, como la prueba Xpert MTB/RIF (9) e INNO-LiPA Rif TB (10).
La decisión terapéutica basada exclusivamente en la evaluación de la resistencia a H y R depende de un claro entendimiento de los patrones de resistencia a las otras drogas anti-TB y de la exposición previa del paciente a drogas anti-TB. Sin embargo, a pesar de la fuerte recomendación de la OMS de implementar pruebas rápidas, no existen lineamientos para elaborar esquemas de tratamiento basados en sus resultados. Las guías internacionales recomiendan usar, por lo menos, tres drogas activas para tratar un caso de TB que no cumpla criterio de TB-MDR y, por lo menos, cuatro drogas activas para tratar un caso de TB-MDR (11-13).
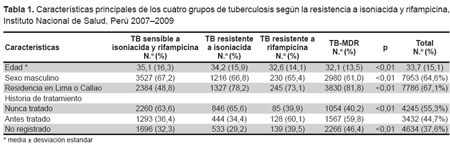
En Perú, la prevalencia de TB-MDR es una de las más altas del continente (14,15). El estudio de vigilancia nacional de resistencia a drogas anti-TB del año 2006 determinó que el 20% de los casos de TB en Lima y Callao, y el 11% del resto del país son resistentes a H o a R. La prevalencia nacional de TB-MDR en casos nunca tratados fue de 5,3%, y en antes tratados de 23,6%. El 5,9% de los casos de TB-MDR cumplían criterio de TB - extensamente resistente (TB-XDR: resistencia a H, R, una fluoroquinolona y una droga inyectable de segunda línea) (16).
En 2005 la prueba Griess y en 2008 la prueba MODS fueron implementadas en el país. Posteriormente, desde el 2010 la prueba molecular Genotype® MTBDR plus está disponible en el Laboratorio Nacional de Micobacterias del Instituto Nacional de Salud del Perú.
En este contexto, dada la creciente disponibilidad de PSD rápidas en el país, el objetivo de la presente investigación fue diseñar esquemas para tuberculosis que incluyeran un número suficiente de drogas activas para cada uno de los cuatro grupos generados según los resultados de resistencia a H y R: 1) sensible a H y R; 2) resistente a H; 3) resistente a R, y 4) TB-MDR.
MATERIALES Y MÉTODOS
TIPO DE ESTUDIO
Estudio operacional de tipo transversal. Se utilizó la base de datos de los perfiles de susceptibilidad a drogas a medicamentos anti-TB de las cepas de M. tuberculosis evaluadas en el INS.
ESCENARIO DE ESTUDIO
Perú ocupa el quinto lugar en cuanto a incidencia de TB en las Américas, precedido por Haití, Guyana, Surinam y Bolivia, con 106 casos por 100 mil habitantes por año (17),pero es el que reporta más casos de TB-MDR y TB-XDR (15). Los casos tanto de TB sensible como de las formas resistentes se concentran en Lima y el Callao, donde el 54% de casos de TB sensible, el 83% de los de TB-MDR y el 90% de los de TB-XDR son reportados cada año. La proporción de los casos coinfectados con TB-VIH es de 2 a 3% y la estrategia DOTS está implementada en todos los establecimientos del Ministerio de Salud (17). El clásico esquema de “categoría uno” (2HRZE/4H2R2) de la OMS es usado como primera línea de tratamiento. Cuando un caso de TB fracasa a este régimen o se detecta resistencia a drogas de primera línea, se inicia tratamiento con drogas de segunda línea de acuerdo al perfil de resistencia y la evaluación del Comité de Evaluación de Retratamiento de cada región de salud a lo largo del país.
PROCESOS MICROBIOLÓGICOS
El Laboratorio de Micobacterias del Instituto Nacional de Salud (INS) recibe aislamientos de M. tuberculosis de todo el país para realizar la PSD por el método de proporciones en agar en placa (18) para: isoniacida a bajas y altas concentraciones; rifampicina; etambutol (E); estreptomicina (S); ciprofloxacina (Cfx); kanamicina (Km); capreomicina (Cm); etionamida (Eto); cicloserina (Cs), y ácido p-amino salicílico (PAS).
La pirazinamida (Z) es evaluada por los métodos BACTEC 460 (Becton Dickinson, USA) o por la prueba de Wayne (19).Seis laboratorios regionales realizan PSD por el método de Canetti (20),cuatro con el método MODS y dos utilizan Griess. El Laboratorio de Micobacterias del INS participa regularmente en las rondas de evaluación externa de la calidad de los laboratorios supranacionales de la OMS (21). De acuerdo con lo dispuesto por el INS, todos los aislamientos de M. tuberculosis con resistencia a H o R, y un 5 a 10% de aislamientos sensibles deben ser remitidos al INS para completar el perfil de resistencia o control de calidad. Además el INS recibe aislamientos de M. tuberculosis de regiones que no cuentan con laboratorios que procesen PSD.
SELECCIÓN DE CEPAS
El estudio incluyó a todas las cepas de M. tuberculosis evaluadas desde el primero de enero de 2007 al 31 de diciembre de 2009 en el INS. Se excluyeron las cepas que no tenía un perfil completo de resistencia a las cinco drogas de primera línea y a las seis drogas de segunda línea que el INS evalúa regularmente.
Se incluyeron múltiples cepas de un mismo paciente, si existía una diferencia de al menos un mes entre las fechas de toma de muestra. La unidad de análisis fue la cepa de M. tuberculosis, que fue clasificada en uno de los cuatro grupos según su perfil de resistencia a H y a R: 1) sensible a H y R; 2) resistente a H; 3) resistente a R, y 4) resistente a H y R (TB-MDR). En todas las cepas aisladas se determinó la sensibilidad a las demás drogas de primera y segunda línea mencionadas previamente. Para la descripción de las características sociodemográficas, se consideró a los pacientes como unidades de estudio.
DETERMINACIÓN DE LA EFICACIA POTENCIAL
La eficacia potencial de cada esquema se definió de la siguiente manera:
● Para los grupos sensible a H y R, resistente a H y resistente a R: proporción de cepas sensibles a, por lo menos, tres o cuatro drogas incluidas en el esquema elaborado.
● Para el grupo resistente a H y R: proporción de cepas sensibles a, por lo menos, cuatro drogas incluidas en el esquema elaborado.
Otras variables evaluadas fueron edad en años, sexo del paciente, lugar de residencia (Lima/Callao y provincias) y antecedente de tratamiento (nunca tratados y antes tratados) Los datos no registrados en la base del INS fueron catalogados como datos ausentes en el análisis.
ELABORACIÓN DE REGÍMENES
Para cada grupo de cepas se elaboraron regímenes empleando los siguientes principios:
1. Incluir drogas que presentaran un porcentaje alto de cepas sensibles a esta
2. Incluir drogas que estén disponibles en Perú
3. Usar las siguientes recomendaciones de terapéutica de la OMS (11-13):
a. Uso progresivo de drogas anti-TB según clasificación jerárquica en cinco grupos: i) agentes orales; ii) agentes parenterales de segunda línea; iii) fluoroquinolonas; iv) agentes orales bacteriostáticos de segunda línea, y v) drogas del quinto grupo.
b. Para TB no-MDR incluir, por lo menos, tres drogas con cierta o casi cierta efectividad durante la fase intensiva del tratamiento.
c. Para TB MDR incluir, por lo menos, cuatro drogas con cierta o casi cierta efectividad durante la fase intensiva del tratamiento.
d. Considerar añadir más drogas en pacientes con enfermedad extensa.
SELECCIÓN DE LOS ESQUEMAS DE TRATAMIENTO PARA TUBERCULOSIS
Una vez elaborados los esquemas en base a estos principios, se determinó, para cada esquema el porcentaje de cepas de cada grupo que cumplía el criterio de eficacia potencial. Asimismo, se consideraron los costos de cada esquema y evitar la combinación de drogas que tengan toxicidad potenciada: Eto y PAS o Cs y PAS. Para la estimación de los costos de cada régimen se consideró: i) el precio del medicamento en Perú proporcionado por la Dirección General de Medicamentos, Insumos y Drogas del Ministerio de Salud (convertido a dólares americanos), y ii) la duración de las fases propuesta en este artículo siguiendo las recomendaciones de las guías de la OMS (11-13).
ANÁLISIS ESTADÍSTICO Y CONSIDERACIONES ÉTICAS
Se compararon los grupos mediante la prueba chi cuadrado para variables categóricas y ANOVA para variables continuas. Las pruebas de estadística se hicieron en Stata 10.0 (College Station, TX). La significancia estadística se estableció a un nivel de 0,05.
El protocolo del estudio fue aprobado por los comités de ética del INS y de la Universidad Peruana Cayetano Heredia.
RESULTADOS
POBLACIÓN Y AISLAMIENTOS
Del primero de enero de 2007 al 31 de diciembre de 2009, el INS recibió cepas de 12 216 pacientes con TB de todas las regiones del país para la determinación de susceptibilidad a drogas anti-TB. Se procesaron un total de 13 830 cepas de M. tuberculosis, de las cuales 12 311 cepas (89%) tuvieron pruebas de sensibilidad a cinco drogas de primera y seis de segunda línea y constituyeron la población de estudio. Estas cepas pertenecieron a 11 876 pacientes. Del total de cepas, 5249 (42,6%) fueron sensibles a H y R; 1823 (14,8%) fueron resistentes a H; 352 (2,9%) fueron resistentes a R, y 4887 (39,7%) fueron TB-MDR.
La edad promedio de los pacientes fue 33,7 ± 15,1 años (rango <1 - 96 años); 65% fueron de sexo masculino, y el 52% tuvieron entre 15 y 29 años. Los pacientes con TB-MDR fueron más jóvenes que los otros tres grupos con un promedio de 32,1 años (p<0,01); el 67% del total de casos de TB y el 82% de los casos de TB-MDR residía en Lima/Callao. El 36% de los pacientes con cepas sensibles a H y R y el 34% de los que tenían cepas resistentes a H fueron previamente tratados; esta proporción subió a 60% en pacientes con cepas resistentes a R y con cepas TB-MDR (Tabla 1).
SUSCEPTIBILIDAD A DROGAS
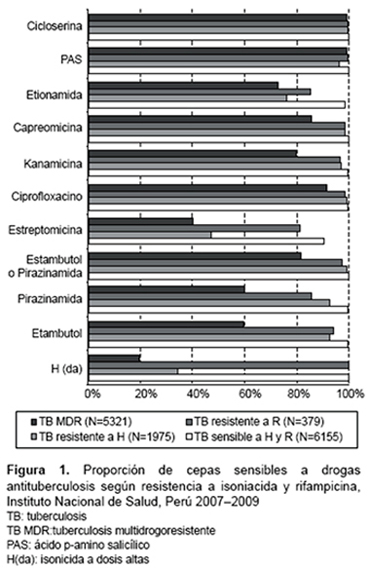
En la Figura 1 se presenta la proporción de cepas sensibles a drogas de primera y segunda línea de acuerdo a la clasificación según resistencia a H y R. En el grupo de cepas sensibles a H y R, más del 99% fue también sensible a E y Z. Esta proporción disminuyó a 93% en las cepas resistentes a H. En las cepas resistentes a R, el 94% fue sensible a etambutol y el 85% sensible a pirazinamida. En las cepas TB-MDR solo el 60% fue sensible a etambutol y el mismo valor se obtuvo para pirazinamida y las drogas de segunda línea con mayor sensibilidad fueron cicloserina, PAS y ciprofloxacina. En forma global, la droga con la menor sensibilidad entre las cepas evaluadas fue estreptomicina con 64%, seguida de etionamida con 84%.
ESQUEMAS DE TRATAMIENTO PARA TUBERCULOSIS ELABORADOS
En la Tabla 2 se presentan los esquemas elaborados para cada uno de los cuatro grupos de cepas y su respectivo valor de eficacia potencial. Los regímenes con mayor eficacia potencial fueron: para el grupo de cepas sensibles a H y R el 99,5% fueron sensibles a las tres drogas del régimen HRZ y el 99,1% fueron sensibles a las cuatro drogas del régimen HRZE. En el grupo de cepas resistentes a H el 98,9% fueron sensibles ≥ 3 drogas del régimen REZCfx y el 98,4% fueron sensibles a ≥ 4 drogas del régimen REZCfxCm.
Para el grupo de cepas resistentes a R el 96,8% fueron sensibles a ≥ 3 drogas del régimen HEZCfx y el 95,7% fueron sensibles a ≥ 4 drogas del régimen HEZCfxCm. En el grupo de cepas TB-MDR el 84,9% fue sensible a ≥ 4 drogas del régimen EZCfxCmEtoCs.
Los regímenes que contienen Km son entre dos a seis veces menos costosos que los regímenes que contienen Cm, pero conservan un similar valor de eficacia potencial, por lo que se optó por seleccionar a los regímenes con Km en lugar de Cm. En el grupo TB-MDR se prefirió seleccionar Eto o Cs antes de PAS por su limitado efecto bacteriostático y alta toxicidad gástrica. Así también, no se seleccionaron combinaciones entre Eto y PAS por su toxicidad gástrica aditiva. Los costos de los regímenes variaron entre 23 dólares para TB sensible a H y R a 2021 dólares para TB-MDR.
En la Tabla 3 se presenta la propuesta de tratamiento para TB basado en la evaluación inicial de la resistencia a H y R. Incluye los esquemas seleccionados, la propuesta de duración de cada una de sus fases de acuerdo con las recomendaciones internacionales vigentes y su costo total en dólares americanos.
DISCUSIÓN
A través de un proceso de elaboración de esquemas para TB utilizando el perfil de resistencia de más de 12 mil cepas de M. tuberculosis del INS en Perú y siguiendo las recomendaciones de terapia antituberculosis de la OMS, fue posible definir qué regímenes de tratamiento anti-TB tuvieron un número adecuado de drogas efectivas para cada uno de los cuatro posibles grupos que se obtienen basándose en la resistencia a H y R.
(Tabla 4) En Perú entre el 80 a 90% de los casos de TB son sensibles a H y R (16) y nuestro análisis muestra que casi todas estas cepas son sensibles asimismo a E y Z (99,5%); lo que significa una muy alta probabilidad de cura con el régimen HRZE. La alta susceptibilidad a etambutol en el grupo de cepas sensibles a H y R también se observó en el estudio de vigilancia nacional de la resistencia a drogas anti-TB del año 2006 (16). De 2169 cepas evaluadas en ese estudio, 1831 (84,4%) fueron sensibles a H y R; y de estas, 1830 (99,9%) fueron también sensibles a E.
A pesar de que el régimen HRZ alcanza una alta proporción de cepas sensibles a las tres drogas (99,5%) consideramos que, en condiciones programáticas, se debe proponer el menor número de esquemas y hacer recomendaciones simples para facilitar el trabajo del primer de nivel de atención. Por lo tanto, este régimen no lo recomendamos en condiciones de programa.
Para tratar la resistencia a H, la OMS propone usar el régimen REZ por 9 a 12 meses, siempre que se confirme la sensibilidad a R, E y Z. En nuestra base de datos, este régimen para las cepas resistentes a H logra una eficacia potencial (tres drogas activas) en el 87% de cepas, incrementándose a 98,9% con la adición de la ciprofloxacina y hasta 99,7% añadiendo ciprofloxacina y kanamicina. Por lo que proponemos añadir una fluoroquinolona (Fqx) (moxifloxacina o levofloxacina) en lugar de ciprofloxacina (23) desde un inicio y Km en casos con enfermedad pulmonar extensa o si la eficacia de algunas de las drogas del régimen es incierta (12).
Para tratar la TB resistente a R, la OMS propone el régimen HEZ más una fluoroquinolona con la sustitución de E o Z por un inyectable si hay resistencia a una de estas dos drogas. Los regímenes propuestos en este estudio son muy similares a los de la OMS (11). Algunos autores recomiendan usar la resistencia a R como un sustituto de diagnóstico de TB-MDR (9). Si se adopta esta decisión en Perú, se prescribiría regímenes para TB-MDR que no incluyen el beneficio de H y promueven el uso de medicamentos de segunda línea menos eficaces y con mayor toxicidad (24). Por lo que usar pruebas moleculares que detectan resistencia únicamente a rifampicina como Xpert MTB/RIF (9) debe ser mejor evaluado, más aún si se conoce que la resistencia primaria y secundaria a isoniacida no asociada a rifampicina (no MDR) en el Perú es de 6,3 y 6,7%, respectivamente (16).
Para el grupo TB-MDR, el régimen propuesto es EZLfxKmEtoCs, (Lfx=levofloxacino), que es empleado en el país como régimen estandarizado para TB-MDR. Sin embargo, para pacientes antes tratados o que viven en Lima y Callao, este núcleo debería reforzarse por una o dos drogas del cuarto o quinto grupo que no hayan sido previamente prescritas al paciente. Se debe evitar la combinación de Eto y PAS por su toxicidad gastrointestinal aditiva (26), y solo usar PAS cuando haya contraindicaciones de cicloserina (11).El primer régimen estandarizado empleado en Perú para TB-MDR fue EZCfxKmEto implementado en 1997. En nuestra base de datos la eficacia potencial de este régimen se logró en el 58,5% de cepas TB-MDR y la tasa de cura reportada con este régimen fue 48% (25).
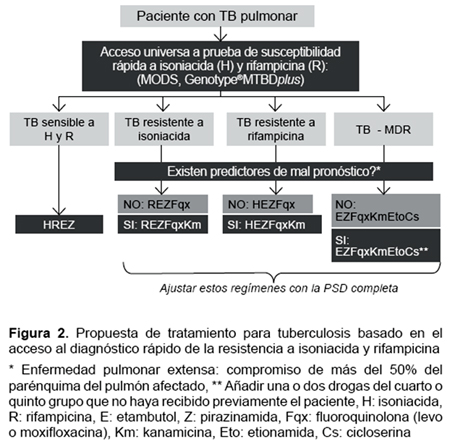
Considerando que el país viene adaptando la recomendación de implementar progresivamente el acceso universal de la sensibilidad rápida a H y R a nivel nacional, en la Figura 2 proponemos un algoritmo para guiar el tratamiento de la TB basado en los resultados de este estudio. Los casos sensibles a H y R no requieren PSD a otras drogas por la muy baja resistencia a Z y E (menor a 1%). En cambio, los regímenes iniciados para los grupos de TB resistente deben ser ajustados cuando se disponga el perfil de resistencia completo a drogas de primera y segunda línea por PSD convencionales.
Dentro de las limitaciones de este estudio podemos mencionar la falta de representatividad de las cepas, por tratarse de una evaluación de un solo laboratorio sin aplicación de un muestreo probabilístico. Sin embargo, la disposición de que toda cepa de TB resistente a H o R detectada en la red de laboratorios de salud pública del país se derive al INS para completar el estudio de susceptibilidad, puede indicar que la mayoría de cepas resistentes fueron realmente incluidas en el estudio.
Otra de las limitaciones ha sido basar la clasificación de las cepas en los resultados de la resistencia a H y R por pruebas convencionales y no pruebas rápidas, que hubiera reflejado mejor lo que se propone para el país. Consideramos además como limitante la poca reproducibilidad de las PSD, sobre todo de drogas de segunda línea evaluadas en este estudio (26). Sin embargo, la permanente participación del INS en rondas de evaluación externa de la calidad por laboratorios supranacionales de la OMS y la amplia experiencia obtenida por el personal hacen que sus resultados sean confiables.
Por último, consideramos que son necesarias investigaciones operacionales que evalúen la eficiencia de estas propuestas de tratamiento en condiciones programáticas. Concluimos que a través del análisis de registros de rutina disponibles en laboratorios que procesan un alto volumen de PSD bajo estándares de calidad y siguiendo las guías internacionales de terapia anti-TB, se ha logrado elaborar, seleccionar y recomendar regímenes con alta probabilidad de eficacia terapéutica basados en el perfil de resistencia a H y R. Recomendamos reproducir este tipo de investigación operacional en países en que el acceso universal a un diagnóstico rápido de TB-MDR antes de inicio de tratamiento esté siendo implementado.
Agradecimientos: AMT fue becario del Proyecto Internacional Clinical, Operational, and Health SErvices Research Training A ward (ICOHRTA), Perú (5U2RTW007368-04) y de la Embajada de Bélgica en Lima, Perú, durante la elaboración del presente estudio.
Contribuciones de autoría: AMT, CSR y FSD participaron en la concepción y diseño del estudio. AMT en la obtención de resultados. AMT, DAJM, VA y FSD en el análisis e interpretación de datos. AMT, DAJM y VA participaron en la redacción del artículo. Todos los autores realizaron la revisión crítica del artículo y aprobaron la versión final.
Conflicto de interés: los autores declaran no tener conflicto de interés y lo desarrollado en este artículo es un punto de vista personal y no de las instituciones a las que pertenecen los autores.
Fuente de financiamiento: Instituto Nacional de Salud
Referencias Bibliográficas
1. Stop TB Partnership. Global Plan to Stop TB, 2011-2015 . Geneva: World Health Organization; 2011.
2. Nathanson E, Nunn P, Uplekar M, Floyd K, Jaramillo E, Lönnroth K, et al. MDR tuberculosis--critical steps for prevention and control . N Engl J Med. 2010;363(11):1050-8.
3. World Health Organization. New laboratory diagnostic tools for tuberculosis control . Geneva: World Health Organization; 2008.
4. World Health Organization. Policy framework for implementing new tuberculosis diagnostics [Internet]. Geneva: World Health Organization; 2010 [citado el 12 de octubre del 2012]. Disponible en: http://www.who.int/tb/laboratory/whopolicy_framework_mar2011.pdf
5. World Health Organization. Noncommercial culture and drug-susceptibility testing methods for screening patients at risk for multidrug-resistant tuberculosis [Internet]. Geneva: World Health Organization; 2010 [citado el 12 de octubre del 2012]. Disponible en: http://www.who.int/tb/laboratory/whopolicy_noncommercialculture_and_dst_methods_mar2011.pdf
6. Moore DA, Evans CA, Gilman RH, Caviedes L, Coronel J, Vivar A, et al. Microscopic-observation drug-susceptibility assay for the diagnosis of TB . N Engl J Med. 2006;355(15):1539-50.
7. Solis LA, Shin SS, Han LL, Llanos F, Stowell MSloutsky A. Validation of a rapid method for detection of M. tuberculosis resistance to isoniazid and rifampin in Lima, Peru . Int J Tuberc Lung Dis. 2005;9(7):760–4.
8. Hillemann D, Rüsch-Gerdes S, Richter E. Evaluation of the Genotype MTBDRplus Assay for rifampicin and isoniazid susceptibility testing of Mycobacterium tuberculosis strains and in clinical specimens . J Clin Microbiol. 2007;45(8):2635-40.
9. Boehme CC, Nabeta P, Hillemann D, Nicol MP, Shenai S, Krapp F, et al. Rapid molecular detection of tuberculosis and rifampin resistance . N Engl J Med. 2010;363(11):1005-15.
10. World Health Organization. Molecular line probe assays for rapid screening of patients at risk of multidrug-resistant tuberculosis (MDR-TB). [Internet]. Geneva: World Health Organization; 2008 [citado el 12 de octubre del 2012]. Disponible en: http://www.who.int/tb/features_archive/policy_statement.pdf
11. World Health Organization. Treatment of tuberculosis: guidelines . 4th ed. Geneva: World Health Organization; 2010.
12. World Health Organization. Guidelines for the programmatic management of drug-resistant tuberculosis: emergency update 2008 . Geneva: World Health Organization; 2008.
13. World Health Organization. Guidelines for the programmatic management of drug-resistant tuberculosis . Geneva: World Health Organization; 2011.
14. World Health Organization. Multidrug and extensively drug-resistant TB (M/XDR-TB): 2010 global report on surveillance and response . Geneva: World Health Organization; 2010.
15. Organización Panamericana de la Salud. Tuberculosis en las Américas. Reporte Regional 2009 . Washington, DC: Organización Panamericana de la Salud; 2009
16. Asencios L, Quispe N, Mendoza-Ticona A, Leo E, Vásquez L, Jave O, et al. Vigilancia de la resistencia a medicamentos antituberculosos, Perú 2005 - 2006 . Rev Peru Med Exp Salud Publica. 2009;26(3):278-87.
17. Bonilla C. Situación de la tuberculosis en el Perú . Acta Med Per. 2008;25(3):163-170.
18. Kent PT, Kubica GP (eds). Public health mycobacteriology: a guide for the Level III Laboratory. Atlanta: Centers for Disease Control; 1985.
19. McClatchy JK, Tsang AY, Cernich MS. Use of pyrazinamidase activity on Mycobacterium tuberculosis as a rapid method for determination of pyrazinamide susceptibility . Antimicrob Agents Chemother. 1981;20(4):556-7.
20. Canetti G, Froman S, Grosset J, Hauduroy P, Langerova M, Mahler HT, et al. Mycobacteria: laboratory methods for testing drug sensitivity and resistance . Bull World Health Organ. 1963;29:565-78.
21. Laszlo A, Rahman M, Espinal M, Raviglione M; WHO/IUATLD Network of Supranational Reference Laboratories. Quality assurance programme for drug susceptibility testing of Mycobacterium tuberculosis in the WHO/IUATLD Supranational Reference Laboratory Network: five rounds of proficiency testing, 1994-1998 . Int J Tuberc Lung Dis. 2002;6(9):748-56.
22. Lienhardt C, Cook SV, Burgos M, Yorke-Edwars V, Rigouts L, Anyo G, et al. Efficacy and safety of a 4-drug fixed-dose combination regimen compared with separate drugs for treatment of pulmonary tuberculosis: the study C randomized controlled trial . JAMA. 2011;305(14):1415-23.
23. Ziganshina LE, Squire SB. Fluoroquinolones for treating tuberculosis . Cochrane Database Syst Rev. 2008;(1):CD004795.
24. Nathanson E, Gupta R, Huamani P, Leimani V, Pasechnikov AD, Tupasi TE, et al. Adverse events in the treatment of multidrug-resistant tuberculosis: results from the DOTS-Plus initiative . Int J Tuberc Lung Dis. 2004;8(11):1382-4.
25. Suarez PG, Floyd K, Portocarrero J, Alarcón E, Rapiti E, Ramos G, et al. Feasibility and cost-effectiveness of standardized second-line drug treatment for chronic tuberculosis patients: a national cohort study in Peru . Lancet. 2002;359(9322):1980-9.
26. World Health Organization. Policy guidance on drug-susceptibility testing (DST) of second-line antituberculosis drugs . Geneva: World Health Organization; 2008.
Correspondencia: Alberto Mendoza-Ticona.
Dirección: Av. Cayetano Heredia 451-301 Lima 11.
Teléfono: 4623185.
Correo electrónico: mendozalberto@outlook.com
Recibido: 17-12-12
Aprobado: 08-05-13