Reporte de Caso
Diarrea recurrente por Cystoisopora belli en pacientes con infección por VIH con TARGA
Recurrent diarrhea due to Cystoisopora belli in HIV/AIDS patients receiving HAART
Raúl Montalvo1,2,a, Eduardo Ticona3,a, Marcos Ñavincopa3,a, Yuri García3,a, Gonzalo Chávez3,a, Víctor Chávez3,a, Jorge Arévalo3,a, Jaime Soria3,a, Alina Huiza4,b.
1 Servicio de Enfermedades Infecciosas y Tropicales, Hospital Daniel Alcides Carrión. Huancayo, Perú.
2 Centro de Excelencia en Enfermedades Crónicas, Universidad Peruana Cayetano Heredia. Lima, Perú.
3 Servicio de Enfermedades Infecciosas y Tropicales, Hospital Nacional Dos de Mayo. Lima, Perú.
4 Instituto de Medicina Tropical “Daniel A. Carrión”, Universidad Nacional Mayor de San Marcos. Lima- Perú.
a Médico infectólogo
b Bióloga.
Resumen
La Cystoisospora belli, antes denominada Isospora belli, es el agente etiológico de la cystoisosporiasis, una infección oportunista que afecta a pacientes inmunodeprimidos, caracterizada por diarrea crónica y pérdida ponderal. La incidencia de diarrea crónica por este agente, en pacientes infectados por el VIH, ha disminuido considerablemente. Ello gracias al advenimiento de la terapia antirretroviral de gran actividad (TARGA), con la que se ha logrado mejorar la respuesta inmunológica del paciente y disminuir su carga viral. Se presentan seis casos de cystoisosporiasis recurrente y refractaria en pacientes con infección por VIH, en quienes se diagnosticó cystoisosporiasis pese a que previamente se encontraban recibiendo profilaxis con trimetropin/sulfametoxazol (TMP/SMX). Cinco de ellos evolucionaron de manera tórpida y fallecieron, a pesar de una buena respuesta al TARGA (adecuado incremento de CD4 y disminución de la carga viral hasta rangos indetectables), y de tratamiento con TMP/SMX por vía oral y otros medicamentos de segunda línea.
Palabras clave: Coccidioides; Infecciones por VIH; Diarrea; Terapia antirretroviral altamente activa (fuente: DeCS BIREME).
Abstract
The Cystoisospora belli, before denominated as Isospora belli, is the etiologic agent of cystoisosoporiasis, an opportunistic infection affecting immunocompromised patients, characterized by chronic diarrhea and weight loss. The incidence of chronic diarrhea for this agent, in HIV patients, has decreased considerably. This thanks to the advent of highly active antiretroviral therapy (HAART), which has improved the patient’s immune response and decrease viral load. We present six cases of cystoisosoporiasis recurrent and refractory to treatment in HIV patients, who was being treated with with trimethoprim / sulfamethoxazole (TMP / SMX) orally as a prophylaxis. Five of these patients passed away due to the infection, despite of the fact that they had a good response to HAART (adequate increase in CD4 and viral load undetectable) and they had been treated with second line drugs.
Key words: Coccidioides; HIV infection; Diarrhea; Antiretroviral therapy, highly active (source: MeSH NLM).
INTRODUCCIÓN
La Cystoisospora belli, antes denominada Isospora belli, es el agente etiológico de la cystoisosporiasis, una infección oportunista que afecta a pacientes inmunodeprimidos, caracterizada por diarrea acuosa persistente y pérdida ponderal. La infección se produce por la ingesta de alimentos o agua contaminada con oocystos esporulados, tras lo cual el parásito invade los enterocitos del yeyuno proximal para luego eliminarse con las heces (1).
En pacientes con infección por el virus de inmunodeficiencia humana (VIH), la presencia de diarrea crónica, es decir la persistencia de ella por más de 28 días, define el estadio SIDA de esta infección. Se ha descrito que el 28% de los pacientes en estadio SIDA presentan diarrea severa, definidas ellas como la presencia de seis o más deposiciones por día (2). En relación a los agentes etiológicos, un estudio nacional realizado en pacientes con diarrea crónica e infección por HIV, mostró a Cryptosporidium spp como el parásito encontrado con más frecuencia (22,8%), seguido por Cystoisospora (10,6%), Giardia (8,3%) y Strongyloides (6,9%) (3). No se puede dejar de mencionar que en estos pacientes existen otras causas de diarrea crónica, como el uso de antirretrovirales, principalmente ritonavir y nelfinavir; infecciones bacterianas, como la tuberculosis intestinal, y la presencia de enfermedades infiltrativas, como el linfoma o el sarcoma de Kaposi (4).
Desde la introducción de la terapia antirretroviral de gran actividad (TARGA), la prevalencia de la infecciones oportunistas ha disminuido dramáticamente; sin embargo, existen estudios que señalan que, a diferencia de la microsporidiosis y cryptosporidiosis, la prevalencia de Cystoisospora se ha incrementado de 0,4 por 1000 pacientes en la era pre-TARGA, a 4,4 por 1000 pacientes en la era TARGA (5).
La cystoisosporiosis recurrente se define como la identificación de este coccidio en más de dos oportunidades. Comúnmente cursa con pobre mejoría clínica y pobre respuesta a trimetropin/sulfametoxazol (TMP/SMX), fármaco considerado de elección. Otras opciones terapéuticas son pirimetamina, ciprofloxacino, albendazol, nitaxozanida, doxiciclina, y macrólidos como roxitromicina y espiramicina (6,7).
En los últimos 4 años (2008 a 2012) el Servicio de Enfermedades Infecciosas y Tropicales del Hospital Nacional Dos de Mayo atendió a 1600 pacientes con infección por VIH en TARGA, entre ellos se detectaron seis pacientes que cursaron con diarrea crónica recurrente por Cystoisospora belli, refractaria al tratamiento con TMP/SMX, los cuales son reportados a continuación.
REPORTE DE CASO
Se reportan seis pacientes, cinco de ellos de sexo masculino, con media de edad de 38 años (rango: 32-55),
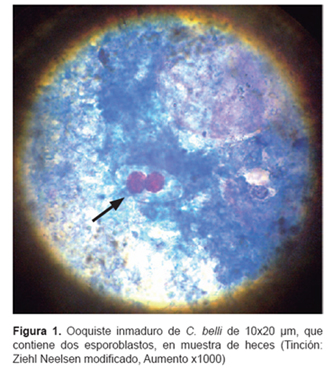
todos ellos con antecedente de infección por VIH, por lo que recibían de manera habitual profilaxis con TMP/SMX 160/800 mg/día por vía oral (media de tiempo de profilaxis fue 12,5 meses [rango: 8-21]). Quienes entre junio de 2008 a junio de 2012 cursaron con episodios diarreicos. El análisis parasitológico, empleando el método de tinción de ácido alcohol resistente (Ziehl Neelsen modificado), permitió visualizar los ooquistes de C. belli en un fondo contrastado de color azul (Figura 1). Tras la confirmación etiológica, se inició TARGA (Tabla 1) y tratamiento con TMP/SMX 320/1600mg bid por vía oral por 14 días. Luego del inicio de esta última se evidencio mejoría en los parámetros laboratoriales de respuesta inmunológica (aumento del recuento de CD4 y disminución de la carga viral hasta rangos indetectables); adicionalmente, en tres de los pacientes se evidenció eosinofilia persistente (Tabla 1). A pesar de ello, los pacientes continuaron con persistencia de cuadros diarreicos por C. belli con pobre mejoría clínica y múltiples hospitalizaciones (media: cuatro hospitalizaciones [rango: 3-6]). Como tratamiento de segunda línea se consideró al ciprofloxacino 400 mg bid por 14 días por vía endovenosa, nitaxozanida 500 mg tid por 10 días por vía oral, o pirimetamina 25mg cada 24 horas por 10 días por vía oral. A pesar de recibir tratamiento de elección y de segunda línea, cinco pacientes fallecieron por complicaciones relacionadas con diarrea crónica, tales como insuficiencia renal, sepsis o peritonitis bacteriana (Tabla 2).

DISCUSIÓN
Los casos presentados corresponden a una presentación inusual de cystoisosporiasis en pacientes con infección por VIH en TARGA, con CD4 promedio >200 células/mm3 y carga viral <40; quienes, además, se encontraban recibiendo profilaxis con TMP/SMX (para prevenir infecciones por Pneumocystis jirovecci, y que previene indirectamente el desarrollo de episodios de diarrea por C. belli y las recrudescencias de esta infección) y que a pesar de recibir tratamiento adecuado con TMP/SMX, recurrían en episodios de diarrea causados por este agente.
Aun cuando un recuento de linfocitos CD4 mayor a 200 células/mm3 es un factor protector para el desarrollo de infecciones oportunistas, en algunos casos la recurrencia de cystoisosporiasis no es dependiente de nivel de respuesta inmune celular restablecido. Al respecto, existen estudios donde el 21,4% de los pacientes con infección por C. belli presentaban Linfocitos CD4 mayor a 200 células/mm3 (8).
Se ha demostrado la presencia de tejidos quísticos conteniendo merozoitos de Cystoisospora belli en el sistema linfático, en la lámina propia de vasos paraaórticos, el mesentérico, el nódulo mediastinal, el hígado, la vesícula biliar y el bazo. Estos sitios extraintestinales pueden representar focos de reservorio de C. belli que pueden recolonizar el intestino y causar recrudescencia de la enfermedad clínica, que sumado a la pobre concentración tisular del TMP/SMX en estos tejidos hacen que estos casos sean difíciles de controlar (9,10). Al respecto, se puede añadir que los esporozoitos de C. belli pueden sobrevivir y multiplicarse dentro de los macrófagos; por lo que estas células puede hospedar formas quísticas unizoicas de este coccidio en sitios extraintestinales para luego retornar al intestino delgado y reiniciar el proceso patogénico (11).
Las concentraciones plasmáticas máximas de TMP/SMX
se alcanzan entre 1 a 4 horas después de la administración oral (1-2 µg/mL de TMP y 40-60 µg/mL de SMX); sin embargo, la atrofia vellosa y la mala absorción producto de la infección por C. belli, puede condicionar concentraciones subterapéuticas de TMP/SMX en plasma, bilis y tejidos extraintestinales. En contraste, la administración intravenosa alcanza concentraciones superiores (6-9 µg/mL de TMP y 70-105 µg/mL de SMX), con la ventaja adicional que se distribuye rápidamente en varios tejidos (renal, hepático y esplénico) y líquidos (pleural, peritoneal, sinovial, humor vítreo, saliva y líquido prostático) (12). Respecto a ello, en Alemania se reportó a un paciente inmunocompetente con diagnóstico de cystoisosporiosis recurrente y colangitis por C. belli, con eosinofilia persistente a pesar de 2 años de profilaxis con TMP/SMX, recibió nitazoxanida a la cual no presentó respuesta, posteriormente recibió TMP/SMX endovenoso por 14 días, tras lo cual cursó con mejoría clínica franca al partir del tercer día (13).
Los factores relacionados a la heterogeneidad de los diferentes genotipos cumple un papel muy importante en la variabilidad clínica, geográfica y la resistencia a drogas anticoccidiales, esta variabilidad genética se demuestra en los diferentes perfiles de restricción encontrados al usar las endonucleasas MboII y Rsal en pacientes con cystoisosporiasis extraintestinal, en los cuales se ha encontrado los polimorfismos en el gen 18S rDNA de C. belli (8).
La identificación de diferentes genotipos CB11 y Cb11b de Cystoisospora encontrados en un paciente con infección extraintestinal y recurrente, sugiere la posibilidad de la existencia de infecciones mixtas de C. belli, con diferentes genotipos con capacidad de invadir y multiplicarse en sitios extraintestinales con posterior recurrencia (10).
Entonces, la cystoisosporiasis recurrente, sin respuesta a TMP/SMX, puede ser explicada por los siguientes mecanismos: la resistencia a TMP/SMX, mediada por polimorfismo genético; la reinfección a partir de foco endógeno, y la pobre concentración de TMP/SMX en los quistes tisulares extraintestinales. Donde el polimorfismo genético sumado a la reactivación de focos endógenos extraintestinales de Cystoisospora, que no fue erradicado durante la terapia oral con TMP/SMX por la pobre concentración de este en los quistes tisulares unizoicos, facilita el desarrollo de reservorios del parásito que pueden llegar a recolonizar el tracto intestinal con posterior recurrencia del cuadro diarreico (14).
De otro lado, existen casos similares de diarrea crónica en pacientes con VIH que, a pesar de resultados negativos en el estudio parasitológico de heces, han respondido al tratamiento empírico de C. belli, haciéndonos presumir que la cystoisosporiasis crónica era la causa probable en estos casos, por lo que el tratamiento empírico inicial puede ser necesario en áreas donde la biopsia duodenal y colonoscopía no está disponible (15).
Nuestro estudio enfatiza la tórpida evolución de pacientes inmunocomprometidos que presentan cuadros de diarreas recurrentes debidas a C. belli, sin respuesta a TMP/SMX por vía oral. Ello despierta la necesidad de buscar opciones terapéuticas eficaces, que detengan el curso clínico de esta infección. En la literatura biomédica se han señalado opciones potencialmente útiles, tales como el uso de pirimetamina, la combinación de esta con nitaxozanida, o el uso endovenoso de ciprofloxacino (aun cuando en los por nosotros reportados, no se evidenció mejoría clínica con esta fluoroquinolona. Por otro lado, considerando la pobre absorción por vía oral en estos pacientes, la administración endovenosa de TMP/SMX (alternativa actualmente disponible en Perú) ha demostrado en otros casos ser eficiente, logrando una adecuada respuesta clínica. Por ello, es prioritario realizar estudios acerca de los parámetros farmacocinéticos, farmacodinámicos y de resistencia del TMP/SMMX en pacientes con cystoisosporiasis, determinando las concentraciones tisulares en los órganos que probablemente sirvan de foco endógeno extraintestinal, con el fin de verificar la dosis y duración de tratamiento antibiótico.
Contribuciones de autoría: RM, YG, MÑ, ET, GC, VC, JA y JS participaron en el diseño del estudio, supervisión de la recolección de muestras y seguimiento de los pacientes. RM y ET participaron en análisis e interpretación de datos. RM escribió el borrador del artículo, AH realizo el procesamiento y lectura de las muestras. Todos los autores revisaron críticamente el manuscrito y aprobaron la versión a publicar.
Fuentes de financiamiento: autofinanciado.
Conflictos de interés: los autores declaran no tener conflictos de interés en la publicación de este artículo.
Referencias Bibliográficas
1. Goodgame RW. Understanding intestinal spore-forming protozoa: cryptosporidia, microsporidia, isospora, and cyclospora . Ann Intern Med. 1996;124(4):429-41.
2. Bern C, Kawai V, Vargas D, Rabke-Verani J, Williamson J, Chavez-Valdez R, et al. The epidemiology of intestinal microsporidiosis in patients with HIV/AIDS in Lima, Peru. J Infect Dis. 2005;191(10):1658-64.
3. García C, Rodríguez E, Do N, López de Castilla D, Terashima A, Gotuzzo E. Parasitosis intestinal en el paciente con infección VIH-SIDA . Rev Gastroenterol Peru. 2006;26(1):21-4.
4. Reijers MH, Weigel HM, Hart AA, Ten Kate RW, Mulder JW, Reiss P, et al. Toxicity and drug exposure in a quadruple drug regimen in HIV-1 infected patients participating in the ADAM study . AIDS. 2000;14(1):59-67.
5. Lagrange-Xélot M, Porcher R, Sarfati C, de Castro N, Carel O, Magnier JD, et al . Isosporiasis in patients with HIV infection in the highly active antiretroviral therapy era in France. HIV Med. 2008;9(2):126-30.
6. Malik S, Samantaray JC, Bagga A, Das A. Refractory isosporiasis . Indian J Pediatr. 2005;72(5):437-9.
7. Frenkel JK, Silva MB de O, Saldanha JC, de Silva-Vergara ML, Correia D, Barata CH, et al. Presença extra-intestinal de cistos unizóicos de Isospora belli em paciente com SIDA. Relato de caso . Rev Soc Bras Med Trop. 2003;36(3):409-12.
8. De Oliveira-Silva MB, de Oliveira LR, Resende JCP, Peghini BC, Ramirez LE, Lages-Silva E, et al. Seasonal profile and level of CD4+ lymphocytes in the occurrence of cryptosporidiosis and cystoisosporidiosis in HIV/AIDS patients in the Triângulo Mineiro region, Brazil. Rev Soc Bras Med Trop. 2007;40(5):512-5.
9. Lindsay DS, Dubey JP, Toivio-Kinnucan MA, Michiels JF, Blagburn BL . Examination of extraintestinal tissue cysts of Isospora belli. J Parasitol. 1997;83(4):620-5.
10. Jongwutiwes S, Sampatanukul P, Putaporntip C. Recurrent isosporiasis over a decade in an immunocompetent host successfully treated with pyrimethamine . Scand J Infect Dis. 2002;34(11):859-62.
11. Resende DV, Lages-Silva E, Assis DC, Prata A, Oliveira-Silva MB. Experimental infection of murine and human macrophages with Cystoisospora belli. Acta Trop. 2009;111(2):177-80.
12. Suthar AB, Granich R, Mermin J, Van Rie A. Effect of cotrimoxazole on mortality in HIV-infected adults on antiretroviral therapy: a systematic review and meta-analysis. Bull World Health Organ. 2012;90(2):128C-138C.
13. Bialek R, Overkamp D, Rettig I, Knobloch J. Case report: Nitazoxanide treatment failure in chronic isosporiasis . Am J Trop Med Hyg. 2001;65(2):94-5.
14. Resende DV, Pedrosa AL, Correia D, Cabrine-Santos M, Lages-Silva E, Meira WSF, et al. Polymorphisms in the 18S rDNA gene of Cystoisospora belli and clinical features of cystoisosporosis in HIV-infected patients . Parasitol Res. 2011;108(3):679-85.
15. Boyles TH, Black J, Meintjes G, Mendelson M. Failure to eradicate Isospora belli diarrhoea despite immune reconstitution in adults with HIV--a case series. PLoS ONE. 2012;7(8):e42844.
Correspondencia: Raúl Montalvo Otivo
Dirección: Av. Daniel A. Carrión 1556, Huancayo, Perú.
Teléfono: 992406768
Correo electrónico: otivo3@hotmail.com
Recibido: 03-12-12
Aprobado: 20-02-13