ORIGINAL BREVE
Evaluación de parámetros inflamatorios locales y sistémicos de quemadura periférica en un modelo animal
Assessment of local and systemic inflammatory parameters of peripheral burn in an animal model
Wilmary Torres1,a, Liseth Mendoza1,a, Hember Vicci1,a, Antonio Eblen-Zajjur2,b,c, María Navarro1,a,d
1 Unidad de
Investigación de Lípidos y Lipoproteínas, Facultad de Ciencias de la Salud,
Universidad de Carabobo. Maracay, Venezuela.
2 Centro de Biofísica y Neurociencia, Facultad de Ciencias de la
Salud, Universidad de Carabobo. Valencia, Venezuela.
a Licenciado en Bioanálisis, b médico cirujano, c
doctor en Neurofisiología, d doctor en Bioquímica.
RESUMEN
Evaluar el volumen de edema y el recuento leucocitario, plaquetario y de fibrinógenos de quemadura periférica en un modelo animal. Se introdujo en agua a 60 °C y durante 60 s, la pata posterior izquierda de Rattus rovergicus (grupo experimental) o a temperatura ambiente (grupo control). Se realizó el análisis antes y después de la quemadura inducida (a las 4, 8, 12 y 24 h). El volumen del edema se determinó por fotografía ortogonal, los leucocitos y el recuento plaquetario, en un equipo automatizado, y el fibrinógeno por el método gravimétrico. El valor máximo del edema se obtuvo a las 4 h, y de leucocitos a las 24 h. El recuento plaquetario no varió a los diferentes intervalos de tiempo posinflamación. El fibrinógeno se incrementó a las 4 h y 24 h. Este modelo animal induce inflamación sistémica caracterizada por leucocitosis, nivel elevado de fibrinógeno y edema localizado en la zona de inducción.
Palabras clave: Quemadura; Edema; Leucocitos; Plaquetas; Fibrinógeno (fuente: DeCS BIREME).
ABSTRACT
To evaluate the edema volume and leukocyte, platelet, and fibrinogen count of peripheral burn in an animal model. The back left leg of Rattus norvegicus (experimental group) was placed in water at 60 °C for 60 seconds or at room temperature (control group). An analysis was carried out before and after the induced burn (at 4, 8, 12, and 24 h). The edema volume was determined by an orthogonal photo, the leukocyte and platelet counts were determined using automated equipment, and the fibrinogen count was determined using the gravimetric method. The maximum value of the edema was recorded at 4 h and leukocytes at 24 h. The platelet count did not vary at different post-edema time intervals. The fibrinogen level increased at 4 h and 24 h. In this animal model we induced systemic inflammation characterized by leukocytosis and elevated fibrinogen levels, combined with edema located at the induction area.
Key words: Burn; Edema; Leukocytes; Platelets; Fibrinogen (source: MeSH NLM).
INTRODUCCIÓN
La inflamación constituye un proceso defensivo multifactorial ante el daño de cualquier etiología causado a células y tejidos vascularizados (1). Este mecanismo puede ir desde una respuesta local, que tiende a circunscribirse en la zona afectada, generando rubor, calor, edema, dolor y pérdida de la función; hasta una respuesta generalizada conocida como respuesta de fase aguda, caracterizada por fiebre, leucocitosis, liberación de corticoides y la producción hepática de proteínas que actúan como marcadores de inflamación activa como el fibrinógeno, la proteína C reactiva, entre otras (2,3).
Los parámetros antes mencionados han sido evaluados experimentalmente en animales, con la finalidad de conocer mejor el mecanismo fisiopatológico que ocurre en el proceso inflamatorio (4,5). El modelo animal más usado es el de inducir inflamación en la pata de ratas al inyectar localmente carragenina, un polisacárido sulfatado que produce una respuesta edematogénica, acompañada por migración de células, una marcada respuesta nocifensiva y la producción de mediadores inflamatorios como histamina, protaglandinas, cininas, óxido nítrico y citocinas (4,5). El modelo experimental de inflamación inducida por carragenina, dista mucho de las situaciones clínicas presentes con frecuencia en el humano, como es el caso de las quemaduras, las cuales son lesiones de tejidos de origen térmico por exposición a llamas, superficies calientes y líquidos, frío extremo, productos químicos, radiación, o la fricción (6,7). De acuerdo a la Organización Mundial de la Salud (8), cada año alrededor de 300.000 muertes en el mundo se deben a quemaduras, las cuales inducen numerosas disfunciones de órganos que resultan en altos niveles de morbilidad, discapacidad y mortalidad (9).
Las alteraciones moleculares, celulares y fisiopatológicas presentes en una lesión por quemadura no han sido completamente aclaradas. En tal sentido, existe la necesidad de un modelo animal que mimetice adecuadamente estos estados patológicos para obtener una comprensión completa de los mecanismos que se pueden presentar. Quizás el factor más crítico de la relevancia clínica es el método utilizado para inducir quemaduras en animales de experimentación (10). Las técnicas que se han utilizado para generar superficies de quemaduras en modelos animales experimentales incluyen el contacto directo con un metal calentado (7), con electricidad o con agua caliente (10).
Entre los modelos antes mencionados, el modelo de agua caliente ha alcanzado un uso generalizado y es considerado por algunos expertos como el estándar para los modelos animales de quemaduras (10). Además, las quemaduras causadas por líquidos calientes son la causa más frecuente de quemaduras en niños y ancianos (11).
En el modelo animal de quemadura inducido en ratas, al sumergir una pata en agua a 60°C, se ha descrito la expresión de proteínas de diversos pesos moleculares en la asta dorsal medular, así como el efecto de los antiinflamatorios no esteroideos sobre estas (12). Sin embargo, se desconoce el curso temporal de parámetros hematológicos como el recuento de leucocitos y plaquetas, así como de biomarcadores inflamatorios participantes en el proceso de coagulación, como el fibrinógeno, en este modelo de inflamación animal, este conocimiento permitiría evaluar el efecto de nuevos medicamentos antiinflamatorios y/o el efecto de los factores de coagulación sobre este proceso patológico.
EL ESTUDIO
ANIMALES
Se emplearon ratas (Rattus norvegicus) adultos machos de la cepa Sprague Dawley (350-400 g); fueron mantenidas en condiciones de temperatura controlada (24-27 °C) con ciclos de luz y oscuridad de 12 h cada uno, con alimento y agua ad libitum. Dichos ejemplares fueron provistos por el Bioterio Central de la Facultad de Ciencias de la Salud de la Universidad de Carabobo, Venezuela. Todos los experimentos se realizaron entre las 08.00 y las 12.00 h para reducir las variaciones circadianas de los parámetros estudiados (13).
INDUCCIÓN DE LA QUEMADURA
Los animales fueron divididos en dos grupos (control y experimental) de seis animales cada uno, con características similares entre ellos (peso y edad). Las ratas fueron anestesiadas con tiopental de sodio (60 mg/kg) por vía intraperitoneal (i.p.); posteriormente, se les suministró por vía subcutánea 0,25 mg de atropina, para disminuir las secreciones respiratorias.
Una vez verificado el nivel de anestesia profundo (ausencia de reflejos corneal, y de retirada de la cola y pata ante estímulo doloroso), se introdujo la pata posterior izquierda de las ratas del grupo control en agua a temperatura ambiente durante 60 s. Similar procedimiento fue realizado en el grupo experimental, pero en agua a 60 °C siguiendo los procedimientos previamente descritos (14).
Los animales se dejaron reposando sobre una manta eléctrica con control por retroalimentación que mantiene la temperatura colorrectal del animal en 37 °C hasta que pase el efecto del barbitúrico.
CUANTIFICACIÓN DEL EDEMA
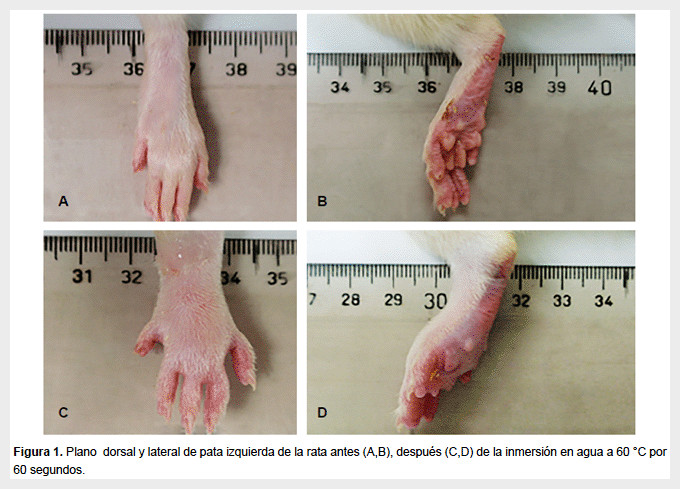
El área de inflamación de la pata del animal se midió de manera secuencial antes y luego de cuatro, ocho, doce y veinticuatro horas de la quemadura, mediante fotografía digital ortogonal (planos dorso-plantar y lateral de la pata estimulada) (Figura 1). Las fotografías en formato bitmap (.bmp) se procesaron con el programa ImageTools (INH, 2010) con la herramienta de medición de áreas a través de los contornos de la imagen de la pata. El área total inflamada se determinó mediante la suma de las superficies de la pata en ambos planos expresada como pixeles2, se calibró mediante una superficie de área conocida en el mismo campo fotográfico para su conversión a mm2. La intensidad del edema se calculó como porcentaje (%) de incremento de la superficie de la pata inducida por la quemadura en cada intervalo de tiempo. Las superficies de las patas de las ratas sin inflamación se consideraron como 100%.

DETERMINACIÓN DE PARÁMETROS INFLAMATORIOS SISTÉMICOS
Se tomaron muestras de sangre por punción cardíaca antes y luego de cuatro, ocho, doce y veinticuatro horas de la quemadura. Para ello, las ratas fueron anestesiadas previamente con tiopental de sodio (60 mg/kg, i.p.). Parte de la sangre obtenida se mezcló con citrato de sodio al 3,2% p/v en una proporción 1:9 (citrato:sangre), en la cual se realizó el conteo de glóbulos blancos y plaquetas mediante un equipo automatizado (Mindray® BC-2300). Del resto de la muestra se obtuvo plasma por centrifugación a 1500 g durante 15 min (centrifuga Centra-CL2) para la determinación de la concentración de fibrinógeno por el método gravimétrico (15).
ANÁLISIS ESTADÍSTICO
Las medidas de resumen se expresaron en función de la mediana y los percentiles 25-75. La comparación entre los grupos estudiados se realizó a través de la prueba no paramétrica U de Mann-Whitney y de Friedman para múltiples grupos y posthoc test con pareo por Wilcoxon.
Los resultados se consideraron estadísticamente significativos para un p<0,05. El análisis se realizó con el programa estadístico PAST v3.14.
ASPECTOS ÉTICOS
El manejo de los animales se realizó siguiendo los lineamientos establecidos por la Guide for the care and use or laboratory animals del National Institute of Health (16) y laley venezolana para la Protección de la Fauna Doméstica Libre y en Cautiverio (17).
RESULTADOS
VOLUMEN DEL EDEMA INDUCIDO POR QUEMADURA
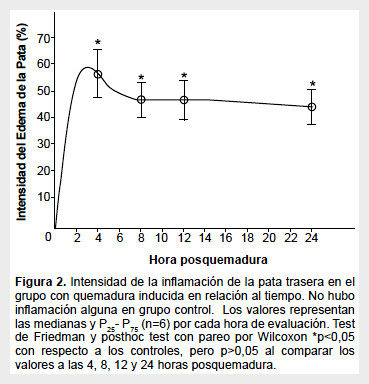
La inmersión de la pata de la rata en agua a 60 °C indujo un eritema inicial notable a partir de los cinco segundos de inmersión, el cual fue seguido a los pocos minutos con edema in crescendo, cuya intensidad fue significativamente mayor al del grupo control desde la primera determinación a las cuatro horas (p<0,05) (Figura 2). Una vez generada la máxima intensidad del edema a las cuatro horas posquemadura, este se mantuvo en valores similares a las ocho, doce y veinticuatro horas posquemadura (p>0,05), lo cual se ajusta a un desarrollo temporal de carácter logarítmico con saturación a las cuatro horas. Los valores de las patas de los animales del grupo control no mostraron ningún cambio a lo largo de las horas de evaluación.
CONTEO DE GLÓBULOS BLANCOS Y PLAQUETAS ASOCIADOS A LA REACCIÓN INFLAMATORIA
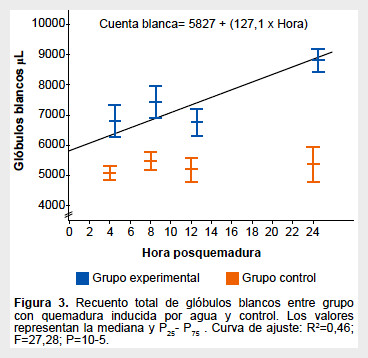
En el grupo control se obtuvo un recuento de leucocitos de 5,3x103/µL (4,5-5,8 x103/µL). El recuento total de glóbulos blancos se incrementó significativamente y en forma progresiva a las cuatro, ocho, doce y veinticuatro horas posquemadura, mostrando un valor máximo a las 24 h posquemadura de 8,72 x103/µL (8,0-9,9x103/ µL) lo cual significó un 67,48% (p<0,05) de incremento en comparación a los valores obtenidos en el grupo de ratas controles. En la Figura 3 se presenta la curva de mejor ajuste y la ecuación que define el incremento de la cuenta de glóbulos blancos con el tiempo posquemadura.
El recuento plaquetario en las ratas controles fue de 835x103/µL (754-952,103/µL). Este valor no se modificó estadísticamente en los animales con inflamación, al compararlos tanto con sus valores prequemadura o con los valores de los animales sin quemadura.
CONCENTRACIÓN PLASMÁTICA DE FIBRINÓGENO POSQUEMADURA PERIFÉRICA
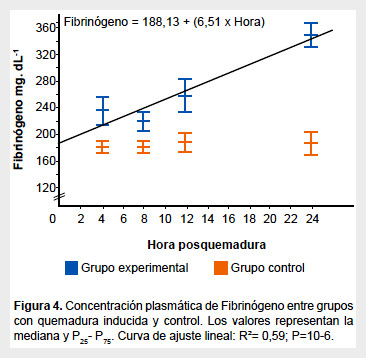
En el grupo de ratas sin inflamación la concentración plasmática de fibrinógeno obtenida en este estudio fue 183 mg/dL (150-219 mg/dL; IC 95%), la cual se incrementó a las cuatro horas (p<0,05) y a las veinticuatro horas (p<0,0001) posquemadura. No hubo diferencias significativas a las ocho y doce horas posteriores a la quemadura entre los valores de ambos grupos (Figura 4).
DISCUSIÓN
En el presente estudio se evaluó por primera vez el curso temporal de la cuenta de glóbulos blancos y plaquetas, así como la concentración de fibrinógeno plasmático en ratas con inflamación inducida por quemadura de una pata al sumergirla en agua a 60 °C, modelo de lesión similar a la presentada con frecuencia en el humano.
El edema posquemadura alcanzó su valor máximo a las cuatro horas, y se mantuvo hasta las veinticuatro horas, resultado que concuerda con los valores reportados para el modelo de inflamación inducido por carragenina (4,5). Luego de alcanzada la máxima intensidad del edema a las cuatro horas posquemadura, es probable que no se incrementara aun más debido al efecto de contención ejercido por la fascia plantar, situación que también se presenta en los humanos, en quienes se presenta una hipertensión compartimental en el miembro quemado (18).
Este hecho resalta la similitud del modelo experimental animal usado en el presente estudio con el proceso inflamatorio por quemadura visto en clínica humana.
Si bien el edema alcanzó su máxima intensidad a las 4 horas para luego mantenerse constante hasta las 24 horas de evaluación. La liberación de aminas vasoactivas como la histamina y la serotonina y de las citocinas pro-inflamatorias como el factor de necrosis tumoral–alfa (FNT-α), interleucina-1 (IL-1) e IL-6 producidas por la degranulación de mastocitos (3) o de las plaquetas, conllevan a incrementar la permeabilidad vascular favoreciendo la formación del edema (1).
La quemadura no solo produjo una respuesta local (edema), sino también una respuesta sistémica, expresada por leucocitosis e hiperfibrinogenemia. La leucocitosis mantuvo un incremento constante y lineal a partir de las cuatro horas, alcanzando su máximo valor a las 24 h. Estos resultados contrastan con los reportados en el modelo de inflamación inducido por carragenina (4) en el cual solo se observó leucocitosis transitoria a las 12 h posinyección, y valores similares al grupo control a las 8, 24, 36 y 48 h. Asimismo, Cicala et al. (5) reportaron la ausencia de variación en el conteo de leucocitos en el modelo inflamatorio inducido por carragenina a las tres y veinticuatro horas posteriores a su inyección. Estos datos siguieren que el impacto sistémico, y especialmente hematológico, de la inflamación inducida por la quemadura, es mayor que el inducido por la inyección de carragenina, y se aproximaría mejor a la situación clínica observada en los pacientes con quemaduras (19). Es importante resaltar que este es el primer hallazgo de leucocitosis asociada a la respuesta inflamatoria inducido por este tipo de quemadura.
Por otra parte, los valores obtenidos en el conteo de plaquetas en este estudio contribuyen en la definición de los valores de referencia de este parámetro hematológico en ratas, resultados que coinciden con otros trabajos en donde se estudiaron las mismas cepas de ratas y se utilizó la punción cardíaca como medio de sangramiento (5).
La ausencia de cambios en el conteo de plaquetas durante la inflamación inducida por quemadura sugiere que las plaquetas participarían en este proceso, no con cambios en su número, sino en sus funciones (adhesividad y/o agregabilidad) como ha sido sugerido en el modelo inducido por carragenina (5), por lo que estudios futuros deberían evaluar dichas funciones.
El incremento del fibrinógeno plasmático asociado a la quemadura corresponde a un elemento de la compleja respuesta a una gran variedad de lesiones con el objetivo de restaurar la homeostasis. El fibrinógeno (20) es considerado no solo un componente de la coagulación, sino también un marcador proporcional en su concentración plasmática a la intensidad del proceso inflamatorio (19,20). En el presente estudio se observó un incremento progresivo de la concentración de fibrinógeno con la evolución en horas posterior a la quemadura. Esto apoya la noción de que el fibrinógeno constituye un marcador inflamatorio al punto que, mediante la curva de ajuste reportada, es posible estimar el tiempo en horas de evolución del proceso inflamatorio y viceversa. La causa de la hiperfibrinogenemia progresiva durante la inflamación, probablemente se deba al incremento en la síntesis y secreción de citocinas proinflamatorias en el sitio de la lesión como el FNT-α, IL-1 e IL-6 que inducen una mayor secreción hepática de esta proteína de fase aguda (20).
Los resultados del presente estudio proveen nuevas evidencias en donde el modelo animal de quemadura inducida en agua a 60 °C por 60 s, incita una respuesta sistémica caracterizada por leucocitosis e hiperfibrinogenemia aunado al efecto edematogénico local.
Contribución de autoría: WT, LM participaron en la recolección y obtención de resultados, por su parte HV, AEZ y MN colaboraron en el análisis y redacción del artículo.
Financiamiento: autofinanciado.
Agradecimiento: los animales de experimentación fueron aportados por el Bioterio Central de la Facultad de Ciencias de la Salud, de la Universidad de Carabobo, Valencia-Venezuela.
Conflictos de interés: los autores declaran la ausencia de conflictos de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. Moilanen E. Two Faces of Inflammation: an immunopharmacological view. Basic Clin Pharmacol Toxicol. 2014;114(1):2–6. doi: 10.1111/bcpt.12180.
2. Robb CT, Regan KH, Dorward DA, Rossi AG. Key mechanisms governing resolution of lung inflammation. Semin Immunopathol. 2016;38(4):425–448. doi: 10.1007/s00281-016-0560-6.
3. Christoffersen BØ, Jensen SJ, Ludvigsen TP, Nilsson SK, Grossi AB, Heegaard PM. Age- and sex-associated effects on acute-phase proteins in Göttingen minipigs. Comp Med. 2015; 65(4):333-41.
4. Vazquez E, Navarro M, Salazar Y, Crespo G, Bruges G, Osori C, et al. Systemic changes following carrageenan-induced paw inflammation in rats. Inflamm Res. 2015;64(5):333-42. doi: 10.1007/s00011-015-0814-0.
5. Cicala C, Morello S, Alfieri A, Vellecco V, Marzocco S, Autore G. Haemostatic imbalance following carrageenan-induced rat paw oedema.Eur J Pharmac. 2007; 577(1-3):156-61.
6. Eddouks M, Chattopadhyay D, Zeggwagh NA. Animal models as tools to investigate antidiabetic and anti-inflammatory plants. Evid Based Complement Alternat Med. 2012;2012: 142087. doi: 10.1155/2012/142087.
7. Tavares Pereira Ddos S, Lima-Ribeiro MH, de Pontes-Filho NT, Carneiro-Leao AM, Correia MT. Development of animal model for studying deep second-degree thermal burns. J Biomed Biotechnol. 2012;2012:460841. doi: 10.1155/2012/460841.
8. Branski LK, Al-Mousawi A, Rivero H, Jeschke MG, Sanford AP, Herndon DN. Emerging infections in burns. Surg Infect (Larchmt). 2009;10(5):389–97. doi: 10.1089/sur.2009.024.
9. Williams FN, Herndon DN, Hawkins HK, Lee JO, Cox RA, Kulp GA, Finnerty CC, Chinkes DL, Jeschke MG. The leading causes of death after burn injury in a single pediatric burn center. Crit Care. 2009;13(6):R183. doi: 10.1186/cc8170.
10. Abdullahi A, Amini-Nik S, Jeschke MG. Animal models in burn research. Cell Mol Life Sci. 2014;71(17):3241-55. doi: 10.1007/s00018-014-1612-5.
11. Clouatre E, Pinto R, Banfield J, Jeschke MG. Incidence of hot tap water scalds after the introduction of regulations in Ontario. J Burn Care Res. 2013;34(2):243-8. doi: 10.1097/BCR.0b013e3182789057.
12. Bosco R, Eblen-Zajjur A. Sobreexpresión de proteínas y canales de sodio voltaje-dependientes Nav1.3 en el asta dorsal medular de ratas, posterior a una inflamación periférica aguda. VITAE. 2011; Enero-Marzo, (49).
13. Eblen-Zajjur A, Marín R, Vanegas H, Proverbio F, Proverbio T. Diurnal changes in ouabain-sensitive Na+, K+-ATPase activity in the rat spinal dorsal horn. Neurochem J. 2015;9(4):266-70. doi: 0.1134/S181971241504008X.
14. Bosco-Bruno R, Barrios E, Eblen Zajjur A. Efecto de la indometacina sobre la expresión de proteínas y del canal de sodio NaV1.3 en el asta dorsal medular de ratas, inducidos por una inflamación periférica aguda. VITAE. 2012;49:1-11.
15. Ratnoff OD, Menzie C. A new method for the determination of fibrinogen in small samples of plasma. J Lab Clin Med.1951;37(2):316–20.
16. National Institute of Health. Guide for the care and use of laboratory animals [internet]. Washington: National Academy Press; 2011 [citado el 10 de enero de 2016] Disponible en: https://grants.nih.gov/grants/olaw/Guide-for-the-Care-and-use-of-laboratory-animals.pdf.
17. Gaceta Oficial de la República Bolivariana de Venezuela. Ley para la Protección de la Fauna Doméstica Libre y en Cautiverio. Año CXXXVII, Mes III, Número 39.338. Caracas, Venezuela (4 de enero de 2010).
18. White CE, Renz EM. Advances in surgical care: management of severe burn injury.Critical Care Med. 2008;36(7):S318-24. doi: 10.1097/CCM.0b013e31817e2d64.
19. Bauzá G, Miller G, Kaseje N, Wang Z, Sherburne A, Agarwal S, Burke PA. Injury-induced changes in liver specific transcription factors HNF-1α AND HNF-4α.J Surg Res. 2012;175(2): 298-304. doi: 10.1016/j.jss.2011.04.062.
20. Vicci H, Navarro M, Eblen-Zajjur A. Trombina más allá de la coagulación. VITAE. 2015;63:1-13.
Correspondencia:
María del Pilar Navarro.
Dirección: Final Av. Leonardo Ruíz Pineda.
Facultad de Ciencias de la Salud, Universidad de Carabobo, La Morita, Estado
de Aragua, Venezuela.
Teléfono: (+58) 4149451552
Correo electrónico:
sapianma2712@gmail.com
Recibido: 14/02/2016
Aprobado: 24/08/2016