REPORTE DE CASOS
No todo es zika: toxoplasmosis congénita, ¿aún prevalente en Colombia?
Not everything is zika: congenital toxoplasmosis, still prevalent in Colombia?
Jorge L. Alvarado-Socarras1,2,3,a, Keyla Meneses-Silvera4,b, Andrea Carolina Zarate-Vergara4,b, Carlos Guerrero-Gomez5,c, Alfonso J. Rodriguez-Morales2,3,6,d
1
Unidad de Neonatología, Departamento de Pediatría, Fundación Cardiovascular
de Colombia. Floridablanca, Santander, Colombia.
2 Organización Latinoamericana para el Fomento de la
Investigación en Salud (OLFIS). Bucaramanga, Santander, Colombia.
3 Red Colombiana de Colaboración en Zika y otros Arbovirus
(RECOLZIKA). Pereira, Risaralda, Colombia.
4 Universidad de Santander. Bucaramanga, Santander, Colombia.
5 Departamento de Radiología, Fundación Cardiovascular de
Colombia. Floridablanca, Santander, Colombia.
6 Grupo de Investigación Salud Pública e Infección, Facultad de
Ciencias de la Salud, Universidad Tecnológica de Pereira. Pereira,
Risaralda, Colombia.
a Médico pediatra neonatólogo; b médico residente de
cuidado intensivo pediátrico; c médico radiólogo; d
médico tropicalista e investigador senior.
RESUMEN
La toxoplasmosis congénita continúa siendo un problema de salud pública. Aun existiendo guías plenamente divulgadas y conocidas, se observa poca implementación de las mismas y falta de adecuada interpretación de pruebas serológicas en gestantes Esto puede generar falta de captación y tratamiento en embarazadas con primoinfección por Toxoplasma gondii. Reportamos una serie de casos, con compromiso neurológico y sistémico (dificultad respiratoria, hepatoesplenomegalia, enterocolitis, calcificaciones cerebrales, trombocitopenia, corioretinis, ascitis, choque). Si bien el virus de Zika causó epidemia en 2015-2016 en Brasil, Colombia y otros países, toxoplasmosis es un diagnóstico diferencial aún prevalente en estos países, con secuelas graves, discapacidad neurológica y riesgo de daño ocular, incluso tardío. Adicionalmente, existen algunas variedades de cepas de T. gondii con comportamiento más agresivo en Latinoamérica, lo cual empeora la presentación de los casos, incluyendo además mayor riesgo de muerte.
Palabras clave: toxoplasmosis; toxoplasmosis congénita; toxoplasmosis cerebral; virus Zika; Colombia (fuente: DeCS BIREME).
ABSTRACT
Congenital toxoplasmosis continues to be a public health threat. Even existing guidelines, publicly known, its implementation and lack of appropriate interpretation of serological tests in pregnancy is often observed. This leds to failure in opportunities for positive and known interventions to decrease the fetal risk due to Toxoplasma gondii infection. We reported herein a case series, with variable neurological and systemic compromise (respiratory distress, hepatosplenomegaly, enterocolitis, brain calcifications, thrombocytopenia, ascites, shock), even fatal, calling for awareness about the fact that despite the Zika epidemics in 2015-2016 in Brazil, Colombia and other countries, precisely toxoplasmosis, is a differential diagnosis still prevalent in these territories, that can leds to severe consequences, with neurological disability and risk of ocular damage, even lately. Additionally, with varieties of T. gondii with more aggressive patterns in Latin America, which make worse those cases, including also a higher risk of death.
Key Words: toxoplasmosis; congenital toxoplasmosis; cerebral toxoplasmosis; Zika virus; Colombia (source: MeSH NLM).
INTRODUCCIÓN
La toxoplasmosis congénita continúa (TC) siendo una de las infecciones de transmisión vertical prevalente integra el complejo TORCH (toxoplasmosis, rubéola, citomegalovirus, herpes simplex). La primoinfección adquirida gestacionalmente, puede desencadenar pérdida fetal o compromiso neonatal severo y secuelas neurológicas. Puede prevenirse realizando tamizaje y adecuada interpretación durante el control prenatal (1). A diferencia de la mayoría de patógenos TORCH, virales, Toxoplasma gondii es un parásito, globalmente distribuido, pero con prevalencias y patrones de presentación clínica variables, siendo considerado más agresivo en países de Latinoamérica que en Europa (1,2).
Desde 2015 hay que adicionarle el problema del virus Zika (3,4), agente con características clínicas relevantes para considerarse también infección congénita, además compartiendo similitudes con la toxoplasmosis (4,5). La microcefalia y calcificaciones asociadas a ambas dificultan el diagnóstico diferencial en infecciones perinatal. Consecuentemente, la evaluación integral del complejo TORCH debe ser condición sine qua non, que permita intervenir ante daños potenciales de esta nueva infección, pero también en TC (5,6).
Por ende, presentamos cinco casos de TC, con compromiso neurológico y presentación variable, a pesar de algunos con tamizaje serológico prenatal, ninguno con opción de tratamiento, posiblemente por falla inicial en la interpretación serológica y pobre control prenatal. Uno de ellos interpretado inicialmente como Zika.
REPORTE DE CASOS
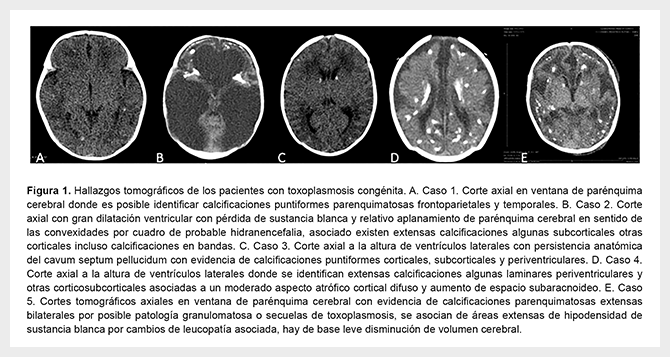
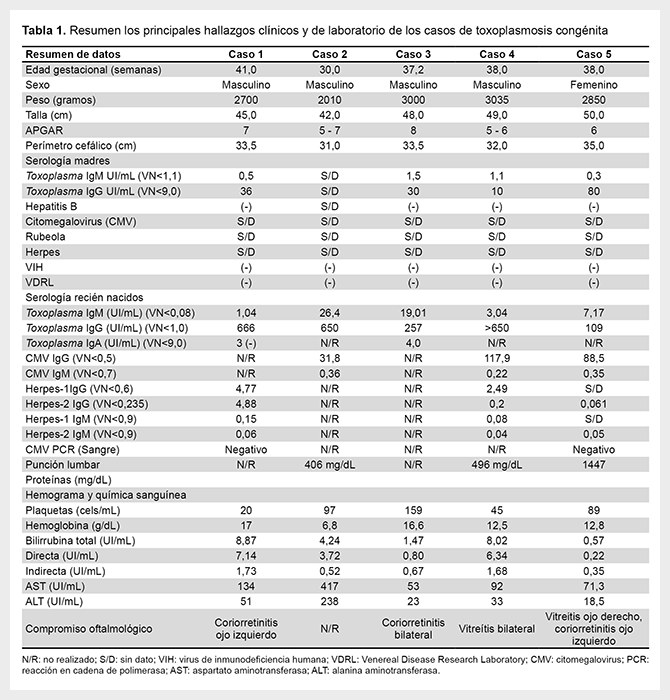
Caso 1. Recién nacido (RN) a término, fruto de madre de 28 años, con antecedente obstétrico de tres gestaciones, un aborto, un embarazo ectópico y un parto por cesárea por podálico. Presentó dificultad respiratoria por lo cual es referido para manejo. A su ingreso, con hepatoesplenomegalia y hemograma inicial con trombocitopenia severa (20 000 cels/mL). Control prenatal regular e IgG Toxoplasma positiva e IgM negativa. Se inicia estudios, incluyendo serología TORCH, encontrando IgM para Toxoplasma e IgA positivas. Se repiten serología a la madre, con IgG para Toxoplasma de 200 UI/mL e IgM 6,46 (VR>0,6) (Tabla 1). Se hace diagnóstico de TC y se amplían estudios con tomografía axial computarizada (TAC) de cráneo (Figura 1A) y evaluación oftalmológica. Estudio de líquido cefalorraquídeo (LCR), no se realizó.
Caso 2. Prematuro, 30 semanas, producto de madre de 18 años, con antecedente obstétrico de una gestación y un parto, que nace por vía vaginal y podálica, con APGAR de 5/10 (1") y 8/10 (5"). Desde primer día de vida, trombocitopenia, signos clínicos de enterocolitis, requiriendo manejo antibiótico de amplio espectro precozmente por deterioro clínico. LCR con proteinorraquia (sin datos de sitios de remisión). Madre residente en zona endémica de zika. Dada la persistencia de trombocitopenia y prematurez realizan ecografía transfontanelar mostrando dilatación de ventrículos laterales, por ello se considera posible infección por virus Zika. Presentó calcificaciones cerebrales e hidrocefalia (Figura 1B). Examen oftalmológico encuentra hallazgos de coriorretinitis. Los valores de IgG para Toxoplasma en la madre eran elevados, por lo cual se considera TC. Se remite a los 56 días para manejo interdisciplinario. A su ingreso, con ventilación mecánica prolongada, exámenes de ingreso mostraron anemia importante, PCR negativa, elevación de transaminasa y bilirrubinas. Resultados de Toxoplasma IgG e IgM positivos (Tabla 1), confirmando TC. Se realizó TAC de cráneo que muestra hidrocefalia extrema con escaso parénquima en lóbulos frontales y múltiples calcificaciones en lóbulos temporales. Ante ello, se considera escaso beneficio de intervenciones mayores y se limita esfuerzo terapéutico.
Caso 3. RN a término, de madre de 22 años, con antecedente obstétrico de tres gestaciones, tres cesáreas, con escasos controles prenatales obtenido por cesárea. Buena adaptación neonatal, pero presenta tempranamente cianosis perioral, asociado a dificultad respiratoria, por lo cual remiten, sospechando cardiopatía. Al ingreso, ecocardiograma normal. Al examen físico, ictericia generalizada sin hepatoesplenomegalia. La madre con IgG e IgM para Toxoplasma positivas, sin intervenciones prenatales (Tabla 1). Ante sospecha clínica, se realiza TAC de cráneo, encontrando múltiples calcificaciones parenquimatosas corticales y subcorticales frontoparietales temporales y occipitales, además de áreas de hipodensidad de sustancia blanca periventricular, relacionado con posible etiología vascular (Figura 1C). Valoración por oftalmología, reporta alteraciones.
Caso 4. RN a término, producto de madre de 25 años, con antecedente obstétrico de tres gestaciones, un aborto y dos cesáreas, quien realiza controles del embarazo, TORCH negativo, excepto Toxoplasma IgG positivo e IgM negativo 3 meses antes del parto. Parto por cesárea, indicada por ruptura de membranas y líquido de aspecto meconial, con un APGAR por historia clínica de 5/10 (1") y 6/10 (5"). Presenta dificultad respiratoria de inicio temprano (cianosis, taquipnea y retracciones subcostales), requiriendo soporte ventilatorio. Al ingreso, paciente ventilado y aceptable estado ácido-base. Al examen físico hepatoesplenomegalia severa más petequias generalizadas. Presenta trombocitopenia (45.000 cels/mL) (Tabla 1). Ecografía abdominal con hepatoesplenomegalia y ultrasonografía cerebral con hemorragia grado I de la matriz germinal izquierda y calcificaciones bilaterales. Se realiza TAC cerebral con múltiples calcificaciones supratentoriales (Figura 1D). Valoración por oftalmología pediátrica, con vitreítis bilateral. LCR evidencia franca proteinorraquia sin pleocitosis.
Caso 5. Neonato de 4 días de vida remitido por hipertensión pulmonar. Producto de madre de 22 años, secundigestante, embarazo a término y cesárea. Líquido amniótico meconiado y neonato no vigoroso, requiriendo reanimación avanzada. Presenta choque asociado a hipertensión pulmonar severa. En el control prenatal, IgG para Toxoplasma positiva e IgM negativa (último trimestre). Eco cerebral inicial con múltiples focos hiperecogénicos distribuidos en el parénquima cerebral, sugestivos de sangrado. Se observa alteración al Doppler vascular. Presenta choque, hepatoesplenomegalia y ascitis. En la serología para TORCH presenta IgG e IgM para Toxoplasma positivas. La TAC de cráneo muestra múltiples calcificaciones (Figura 1E). Estudio de LCR evidencia proteinorraquia y su evaluación oftalmológica coriorretinitis. Todos los datos de laboratorios, incluyendo serologías maternas y reportes clínicos, paraclínicos del neonato, se resumen en la Tabla 1.

DISCUSIÓN
La toxoplasmosis congénita es una condición de presentación clínica variable (1,2). Ocurre durante la primoinfección en el embarazo menos frecuente es la reactivación durante el mismo en pacientes inmunodeprimidos. La mayoría de los casos son asintomáticos. En los casos sintomáticos puede presentar signos clínicos similares a otras infecciones de transmisión vertical. La transmisibilidad y la presentación clínica depende de la etapa del embarazo en la cual se adquiere la infección. Cuanto más precoz los síntomas serán más severos, asociándose a alteraciones neurológicas, oculares y sistémicas graves (2). Sin embargo, hay excepciones como es la infección cercana a la concepción (<3 meses), infección crónica materna por especies más virulentas e inmunosupresión, con exacerbación durante la gestación (ej. madres VIH+). Adicionalmente, puede haber infección gestacional tardía y gran compromiso fetal debido a infección por especies atípicas y más virulentas (1,2).
La expresión clínica orienta al diagnóstico de TC, sin embargo, muchos neonatos son asintomáticos, los cuales pueden desarrollar complicaciones durante su vida, principalmente pérdida de la visión (hasta 95%). Otras complicaciones pueden aparecer, como hidrocefalia, coriorretinitis, retardo mental, pérdida auditiva entre otras (6). Por todo ello, es un problema de salud pública complejo, no resuelto, por lo expresado en nuestros casos y que complica aun más con la llegada del virus Zika a Latinoamérica (3,4). Este, desvió la atención durante 2015-2016. Siendo causante de infección congénita y compromiso neurológico grave similar a toxoplasmosis, ha tenido mayor impacto en Brasil y Colombia, países con una carga importante de toxoplasmosis. En Colombia, se estima una letalidad cercana al 20% (1,2). Infortunadamente durante la epidemia de zika, donde se investigó y asoció a este con microcefalia y otras alteraciones neurológicas, no fue explorado el estado serológico para Toxoplasma en muchos casos, condición que clínicamente es similar a zika (microcefalia y calcificaciones cerebrales) (5-7).
Por ello, deben existir medidas para prevenir esta infección perinatal. El riesgo debe evaluarse con serologías en embarazadas con adecuada interpretación de estas (8,9). Existe tratamiento para las gestantes que disminuyen significativamente la trasmisión. Con datos de trasmisión materno-fetal de hasta 60% en madres no tratadas y 25-30% en las tamizadas y tratadas durante su gestación (10). La efectividad es dependiente del tiempo de inicio de la seroconversión. Las seronegativas son objetivo de los programas de tamizaje. Si el inicio del tratamiento es <4 semanas de la seroconversión, el tratamiento será más efectivo. De ahí que las guías nacionales colombianas recomiendan realizar tamizaje mensualmente con IgM para Toxoplasma a todas las mujeres seronegativas durante su embarazo (Recomendación B). Además, debe señalarse que es necesario el control de calidad de las pruebas para garantizar la detección de la seroconversión (11). Ello es recomendado en regiones de alto riesgo (7-11).
Es importante determinar IgG e Ig M de forma simultánea y analizar cuidadosamente, para poder determinar si la condición es aguda o pasada. La interpretación de estas pruebas no siempre resulta sencilla, como pudo ocurrir en los casos presentados (12). En ocasiones, es necesario realizar pruebas de avidez para Toxoplasma, para orientar si es aguda o previa la infección (13). Es importante también mencionar que el tratamiento en las embarazadas puede darse con espiramicina y para la infección fetal con sulfadiazina y ácido folínico. En recién nacidos idealmente el diagnóstico inmunológico y especialmente molecular, disponible hoy en día en muchos centros de referencia, ayuda a confirmar o descartar la infección. Es importante realizar la curva con IgG e IgM en los asintomáticos a fin de descartar la infección o iniciar tratamiento.
Finalmente, los hallazgos tomográficos pueden tener diferentes patrones de presentación y estar relacionados con el tipo de parásito responsable de la infección, asociado a la respuesta inflamatoria (5,8). Lo anterior, relacionado a otras situaciones clínicas como es el compromiso ocular (2,14). Podemos concluir, que la TC sigue siendo relevante, con impacto social y clínico (15).
Posiblemente con subdiagnósticos y que aún puede tener pobres controles prenatales, disminuyendo la oportunidad de intervención prenatal.
Contribuciones de los autores: JLAS, KMS y ACZV fueron los médicos pediatras que atiendieron a los pacientes. JLAS y AJRM participaron en la concepción del artículo, interpretación, análisis y su redacción. JLAS realizó la recolección, resumen de los datos. CGG apoyó con el diagnóstico imagenológico de los casos y posteriormente participaron en la revisión crítica del artículo. AJRM hizo una revisión crítica y mejoras a la primera versión del manuscrito. Todos los autores aprobaron la versión final sometida.
Conflictos de interés: los autores declaran no tener conflictos de interés en la publicación de este artículo.
Fuentes de financiamiento: autofinanciado.
REFERENCIAS BIBLIOGRÁFICAS
1. Moncada PA, Montoya JG. Toxoplasmosis in the fetus and newborn: an update on prevalence, diagnosis and treatment. Expert Rev Anti Infect Ther. 2012;10(7):815-28.
2. Gómez Marin JE. First Colombian mul ticentric newborn screening for congenital toxoplasmosis. PLoS Negl Trop Dis. 2011;5(5):e1195.
3. Rodriguez-Morales AJ. Zika: the new arbovirus threat for Latin America. J Infect Dev Ctries. 2015;9(6):684-5.
4. Rodriguez-Morales AJ. Zika and micro cephaly in Latin America: An emerging threat for pregnant travelers?. Travel Med Infect Dis. 2016;14(1):5-6.
5. Alvarado-Socarras JL , Rodriguez-Morales AJ. Etiological agents of microcephaly: implications for diagnosis during the current Zika virus epidemic. Ultrasound Obstet Gynecol.2016;47(4):525-6.
6. Singh S. Congenital toxoplasmosis: Clinical features, outcomes, treatment, and prevention. Trop Parasitol. 2016;6(2):113–22.
7. Brasil P, Pereira JP Jr, Moreira ME, Ribeiro Nogueira RM, Damasceno L, Wakimoto M, et al. Zika Virus Infection in Pregnant Women in Rio de Janeiro. N Engl J Med. 2016;375(24):2321-34.
8. Rodriguez-Morales AJ. Neuroimaging findings of Zika virus infection: beyond the brain CT scans. Jpn J Radiol. 2017;35(2):86.
9. Rodriguez-Morales AJ. Zika virus, coinfections and placenta. Am J Reprod Immunol. 2017 Feb;77(2):e12624.
10. Remington J, Mcleod R. Toxoplasmosis. In: Infectious Disease of the Fetus and Newborn Infant. Remington J, Klein JO, Wilson CB, Nizet V, Maldonado J (Eds). WB Elsevier Saunders Company, PA, USA, 918–1041, 2011.
11. Ministerio de Salud y Protección Social (Colombia). Guía de Práctica Clínica. Ministerio de Salud y Protección Social, 2016 [Citado el 2 de enero de 2017] Disponible en: https://www.minsalud.gov.co/sites/rid/.../Guía.completa.Embarazo. Parto.2013.
12. Hampton MM. Congenital Toxo plasmosis: A Review. Neonatal Netw. 2015;34(5):274-8.
13. Baquero-Artigao F, del Castillo Martín F, Fuentes Corripio I, Goncé Mellgren A, Fortuny Guasch C, de la Calle Fernández-Miranda M, et al. Guía de la Sociedad Española de Infectología Pediátrica para el Diagnóstico y Tratamiento de la Toxoplasmosis Congénita. An Pediatr (Barc). 2013;79(2):116.e1-16.
14. Hutson SL, Wheeler KM, McLone D, Frim D, Penn R, Swisher CN, et al. Pat terns of Hydrocephalus Caused by Con-genital Toxoplasma gondii Infection Associate with Parasite Genetics. Clin Infect Dis. 2015;61(12):1831-4.
15. Alvarado-Socorras JL, Diaz-Quijano FA, Rodríguez-Morales AJ. Diagnóstico diferencial de dengue y chikungunya en pacientes pediátricos. Biomédica. 2016; 36(Suppl 2):211-2.
Correspondencia.
Alfonso J. Rodríguez Morales.
Dirección: Departamento de Medicina Comunitaria, Piso 3, Programa de
Medicina,
Facultad de Ciencias de la Salud, Universidad Tecnológica de Pereira, La
Julita, Pereira, Risaralda, Colombia.
Teléfono: +57-300-884-74-48.
Correo Electrónico:
arodriguezm@utp.edu.co
Recibido:
17/02/2017
Aprobado: 19/04/2017
En línea: 28/06/2017