
ARTÍCULO ORIGINAL
Patología del trasplante cardiaco en el Perú: experiencia con 61 casos en un centro de referencia nacional
Pathology of heart transplantation in Peru: experience with 61 cases in a national reference center
Cristian Aguilar1,a, Walter Alarco2,b, Franz Soplopuco3,c, Julio Morón3,c, Miguel Lescano2,b, Jorge Morales4,d, David Galvez2,b
1
Laboratorio de Anatomía Patológica, Instituto Nacional Cardiovascular. Lima,
Perú.
2
Departamento de Cardiología, Instituto Nacional Cardiovascular. Lima, Perú.
3
Departamento de Cirugía Cardiovascular, Instituto Nacional Cardiovascular.
Lima, Perú.
4
Departamento de Cardiología Pediátrica, Instituto Nacional Cardiovascular.
Lima, Perú.
a Médico anatomopatólogo;
b Médico cardiólogo; c Médico cirujano cardiovascular;
d Médico cardiólogo pediatra.
RESUMEN
Objetivos. Describir las características histopatológicas de los explantes cardiacos y las biopsias endomiocárdicas postrasplante realizadas en un centro de referencia nacional del Perú. Materiales y métodos. Estudio de una serie de casos de pacientes sometidos a trasplante cardiaco entre marzo de 2010 y febrero de 2018. Resultados. Los 61 pacientes trasplantados, tuvieron un promedio de edad de 40,1 (rango: 9-66 años). Cinco casos (8,2%) diagnosticados inicialmente como miocardiopatía dilatada fueron reclasificados después del estudio histopatológico. Las tres primeras causas de enfermedad primaria previa al trasplante fueron: miocardiopatía dilatada idiopática (50,8%), cardiopatía isquémica (16,4%), y cardiopatía valvular (6,6%). El seguimiento promedio fue de 2,8 años. La tasa de supervivencia después del trasplante fue del 85,1% al año y del 82,8% a los cinco años. El rechazo celular agudo moderado/severo ocurrió en 12 pacientes (21,1%) y el rechazo mediado por anticuerpos ocurrió en tres pacientes (5,3%). Conclusiones. La evaluación histopatológica rutinaria del explante cardiaco es esencial para confirmar la etiología de la insuficiencia cardíaca, especialmente en los casos diagnosticados clínicamente como miocardiopatía dilatada. Asimismo, el seguimiento rutinario mediante biopsias endomiocárdicas muestra que el rechazo celular agudo continúa siendo una complicación frecuente durante el primer año de trasplante, y que el rechazo mediado por anticuerpos tiene una baja frecuencia en nuestra población.
Palabras claves: Trasplante cardiaco; Cardiomiopatía dilatada; Biopsia; Rechazo de injerto (fuente: DeCS BIREME).
ABSTRACT
Objetive. To describe the histopathological characteristics of explanted hearts and post-transplant biopsy specimens at a national reference center in Peru. Materials and Methods. A case series study of patients who underwent heart transplantation between March 2010 and February 2018. Results. Sixty-one (61) transplanted patients with a mean age of 40.1 years (range: 9-66 years). Five cases (8.2%) initially diagnosed as dilated cardiomyopathy were reclassified after the histopathological study. The three leading causes of primary disease after transplantation were: idiopathic dilated cardiomyopathy (50.8%), ischemic cardiomyopathy (16.4%), and valvular cardiomyopathy (6.6%). The mean follow-up was 2.8 years. The post-transplant survival rate was 85.1% at 1 year and 82.8% at 5 years. Moderate/severe acute cellular rejection occurred in 12 patients (21.1%) and antibody-mediated rejection occurred in 3 patients (5.3%). Conclusions. Routine histopathological evaluation of the explanted heart is essential to confirm the etiology of heart failure, especially in cases clinically diagnosed as dilated cardiomyopathy. In addition, routine follow-up through endomyocardial biopsies shows that acute cellular rejection is still a frequent complication after a heart transplant, especially within the first year, and that antibody-mediated rejection has a low incidence in our population.
Keywords: Heart transplantation; Cardiomyopathies; Biopsy; Graft rejection (source: MeSH NLM).
INTRODUCCIÓN
El trasplante cardiaco (TC) constituye el tratamiento de elección para muchos pacientes con insuficiencia cardiaca avanzada refractaria al tratamiento convencional (1). Aunque las primeras experiencias no lograron buenos resultados, la introducción de la ciclosporina en la década de los 80 convirtió al TC en una alternativa terapéutica confiable para el manejo de muchos pacientes con cardiopatías en situación terminal (2).
Actualmente, se estima que cada año cerca de 5000 pacientes reciben un TC alrededor del mundo con una sobrevida promedio de diez años postrasplante (3). En Perú, el primer TC fue realizado en1972 por el Dr. Marino Molina en el Hospital Nacional Edgardo Rebagliati Martins; sin embargo, la sobrevida postrasplante sólo alcanzó las 72 horas (4). Casi dos décadas después, en 1991 el Dr. Carlos Alcántara realizó el primer TC exitoso en nuestro país (4). Desde el inicio del primer programa nacional de TC en 1993, la Seguridad Social del Perú (EsSalud) ha reportado 97 TC, de los cuales 61 (62,8%) fueron realizados en el Instituto Nacional Cardiovascular «Carlos Alberto Peschiera Carrillo» (INCOR).
La mayoría de programas de TC en Latinoamérica se iniciaron hace más tres décadas (5-7). Sin embargo, a la fecha no existen reportes en forma sistematizada sobre la experiencia clínico-patológica de los principales programas en la región.
En tal sentido, el objetivo del presente estudio fue describir las características histopatológicas de los explantes cardiacos y las biopsias endomiocárdicas postrasplante realizadas en un centro de referencia nacional del Perú.

MATERIALES Y MÉTODOS
En este estudio descriptivo, de series de casos, se incluyeron a todos los pacientes con insuficiencia cardiaca avanzada trasplantados en el INCOR, entre marzo de 2010 y febrero de 2018. El INCOR se localiza en la ciudad de Lima y desde inicios del 2010 es responsable de brindar prestaciones de salud altamente especializadas a la población asegurada de EsSalud, siendo la máxima instancia resolutiva en el campo cardiovascular de la seguridad social peruana.
EVALUACIÓN DE LOS EXPLANTES CARDIACOS
Después de pesar los explantes cardiacos, las arterias coronarias fueron cuidadosamente disecadas y exploradas. Aunque algunos corazones fueron abiertos por cortes parasagitales (explantes con cardiopatia congénita), en la gran mayoría de casos se realizaron cortes transversales paralelos al surco auriculoventricular. Después de fotografiar los cortes resultantes, se registraron las dimensiones de las paredes y las cavidades cardiacas (Figura 1).
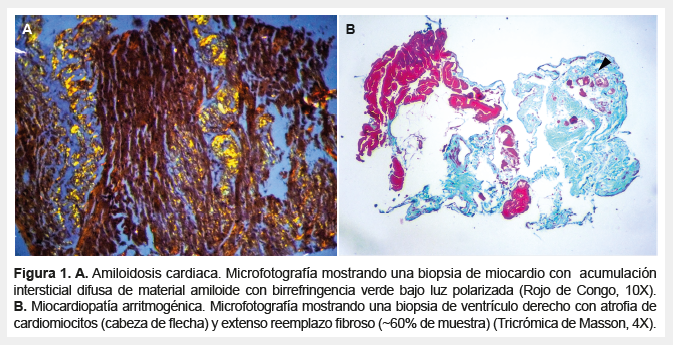
Luego de fijar el tejido en formaldehido al 10%, se realizaron al menos diez cortes histológicos desde secciones representativas de cada corazón. En todos los casos se prepararon rutinariamente láminas coloreadas con hematoxilina-eosina (H-E) y tricrómica de Masson. Las coloraciones especiales para evaluar depósito de amiloide y hierro, fueron realizadas según necesidad.
EVALUACIÓN DE RECHAZO EN LAS BIOPSIAS ENDOMIOCÁRDICAS
El protocolo de biopsia endomiocárdica (BEM) del ventrículo derecho practicadas rutinariamente durante el seguimiento de los pacientes trasplantados en el INCOR, se basa en las recomendaciones de la Sociedad Internacional de Trasplante Cardiaco y Pulmonar (ISHLT) (8) con ligeras modificaciones: una biopsia temprana durante el primer mes, luego una biopsia programada al segundo, tercero, sexto y duodécimo mes. Más allá de las BEM programadas dentro del primer año, los pacientes fueron sometidos a BEM adicionales durante cada episodio clínico sospechoso de rechazo. Considerando la incidencia temporal del rechazo agudo, después del primer año, las biopsias fueron realizadas solo a necesidad.
Para la evaluación histológica de los fragmentos de miocardio obtenidos en las biopsias (cuatro a seis en promedio) se prepararon dos láminas con cortes a diferentes niveles desde un único bloque de parafina (Figura 2). Ambas láminas fueron coloreadas rutinariamente con H-E. Los estudios de inmunohistoquímica con C4d (BSB 6394, BioSB, Santa Barbara, CA, USA) o CD68 (BSB 2712, BioSB, Santa Barbara, CA, USA) fueron solicitados a necesidad en base a los hallazgos morfológicos y las características clínicas del paciente. La evaluación del rechazo celular agudo (RCA) y el diagnóstico de rechazo mediado por anticuerpos (RMA) se realizaron en concordancia con los criterios de clasificación de la ISHLT del 2005 (9) y del 2013 (8), respectivamente.
ANÁLISIS ESTADÍSTICO
Se resumen las variables usando porcentajes y medias. La sobrevida media se definió como el tiempo transcurrido desde el trasplante hasta la muerte o el último seguimiento postrasplante, y se analizó utilizando la curva de Kaplan-Meier. El análisis estadístico fue realizado utilizando el software estadístico SPSS versión 19.0 (SPSS Inc., Chicago, IL, USA).
CONSIDERACIONES ÉTICAS
El estudio fue aprobado por el Comité de Ética en Investigación del Instituto Nacional Cardiovascular «Carlos Alberto Peschiera Carrillo», Lima-Perú.
RESULTADOS
CARACTERÍSTICAS DE LOS PACIENTES
Durante el periodo de estudio, 61 pacientes con insuficiencia cardiaca avanzada fueron trasplantados en el INCOR. Fue 40,1 años (rango: 9 a 66) y el 67,2% fueron hombres. Cinco trasplantes (8,2%) se realizaron en niños, un paciente fue sometido a trasplante doble (corazón-riñón), y 40 pacientes (65,6%) fueron sometidos a un trasplante de emergencia.
El 26,3% requirió algún tipo de asistencia circulatoria mecánica como puente al TC: implante de balón intraaórtico en el 18,1% de los casos y un dispositivo de asistencia ventricular de corta duración tipo CentriMag en el 8,2%. La anastomosis bicaval fue utilizada para el trasplante ortotópico en el 98,4% de los pacientes. Más allá de las evaluaciones periódicas de la función cardiaca mediante ecocardiografía y cateterismo cardiaco, cuatro pacientes fueron sometidos a una BEM pretrasplante. Cabe precisar que, dos pacientes fueron excluidos de la lista de espera por presentar amiloidosis de cadenas ligeras, un paciente con miocardiopatia arritmogénica falleció en lista de espera, y un paciente con hallazgos inespecíficos en la biopsia fue trasplantado satisfactoriamente (Figura 3).
HALLAZGOS HISTOLÓGICOS EN LOS EXPLANTES CARDIACOS
El peso promedio de los corazones explantados en los pacientes adultos fue 494 g (rango: 280-936), mientras que en los pacientes pediátricos fue 328 g (rango: 196-540). Cinco casos (8,2%) diagnosticados clínicamente como miocardiopatía dilatada fueron reclasificados como miocardiopatía hipertrófica en fase dilatada, cardiopatía isquémica, miocarditis linfocítica (un caso por cada patología) y miocarditis por hipersensibilidad (dos casos). Las enfermedades primarias previas al trasplante fueron: la miocardiopatía dilatada idiopática (50,8%), la cardiopatía isquémica (16,4%), la cardiopatía valvular (6,6%), la cardiopatía congénita (4,9%), la miocardiopatía hipertrófica (4,9%), la miocardiopatía por adriamicina (4,9%), la miocarditis (4,9%), miocardiopatía arritmogénica del ventrículo derecho (3,3%) y la no compactación del ventrículo izquierdo (3,3%). No se encontraron casos de miocardiopatía chagásica en nuestra serie.

La miocardiopatía dilatada idiopática representó el subgrupo más numeroso (50,8%), la mayoría de los pacientes fueron hombres (87,5%) con una edad media de 38,2 años. Entre los 31 explantes con miocardiopatía dilatada, el 12,9% presentaban cambios morfológicos mínimos, el 9,7% una leve hipertrabeculación regional del ventrículo izquierdo a predominio apical, y el 6,5% con escaso reemplazo adiposo en la pared del ventrículo derecho sin evidencia de fibrosis o infiltrado inflamatorio. Aunque nueve explantes mostraron escaso infiltrado inflamatorio crónico, solo dos casos con cicatrices subepicárdicas sobre la pared posterior del ventrículo izquierdo fueron sugestivos de corresponder a una miocarditis reparada/curada.
EVALUACIÓN DE RECHAZO EN LAS BEMS DE LOS PACIENTES TRASPLANTADOS
Durante el periodo de estudio, 191 BEM adecuadas fueron practicadas en 57 pacientes trasplantados (entre una a ocho biopsias por paciente). A diferencia de otras instituciones, todos los procedimientos en nuestro centro fueron realizados por acceso venoso femoral derecho bajo guía fluoroscópica. Asimismo, 12 pacientes (21,1%) presentaron al menos un episodio de RCA moderado o severo (>2R) (Figura 4), la gran mayoría (75%) dentro del primer año de seguimiento. Solo tres casos ocurrieron más allá del primer año de seguimiento. El RCA leve (grado 1R) se presentó en 34 episodios. Los once episodios de RCA moderado (grado 2R) y los cuatro episodios de RCA severo (grado 3R) fueron tratados con timoglobulina y pulsos de esteroides. La gran mayoría de biopsias (142) fueron clasificadas como grado 0R.
El RMA se identificó en tres pacientes (5,3%) (Figura 4), dos de ellos dentro del primer mes de seguimiento y un paciente después de los 35 meses postrasplante. Los casos de presentación temprana mostraron cambios histológicos asociados al depósito difuso de C4d en las paredes de los capilares y a la presencia de macrófagos intravasculares (pRMA2). En el caso de presentación tardía sólo fue posible demostrar la presencia de macrófagos intravasculares aislados en la biopsia (pRMA1 H+). Todos los casos de RMA fueron tratados con rituximab y plasmaféresis. Durante el seguimiento, tres pacientes (5,3%) presentaron RCA leve o moderado asociado al depósito difuso de C4d, todos estos casos recibieron pulsos de esteroides, rituximab y plasmaféresis.
Más allá de los cambios histológicos asociados con el proceso de rechazo, en nuestra serie también fue posible identificar otras alteraciones histológicas en el corazón trasplantado. Diez pacientes (17,5%) presentaron efecto Quilty, ocho de tipo A (endocárdico) (Figura 5A), y uno de tipo B (intramiocárdico) (Figura 5B). Cinco pacientes (8,8%) mostraron hallazgos histológicos compatibles con injuria isquémica temprana en el periodo perioperatorio. Dos pacientes (3,5%) mostraron injuria isquémica tardía después del primer mes de seguimiento. Los cambios isquémicos en los casos con material disponible se confirmaron mediante el depósito de C4d en el citoplasma de los cardiomiocitos (Figura 5C). La presencia de calcificación distrófica sólo se identificó en el subendocárdico de un paciente (1,8%) sometido a trasplante corazón-riñón (Figura 5D).
PRONÓSTICO
El tiempo medio de seguimiento fue de 2,8 años. La tasa de sobrevida fue del 85,1% en el primer año y 82,8% en el quinto año (Figura 6). Trece pacientes fallecieron durante el periodo de estudio, diez de ellos (76,9%) dentro del primer año postrasplante. En el primer mes del TC, un paciente falleció por falla cardiaca derecha aguda y un paciente por disfunción primaria del injerto. Después del primer mes y hasta el primer año de seguimiento, las infecciones bacterianas (seis pacientes) y el rechazo agudo (dos pacientes), representaron las principales causas de muerte. Luego del primer año, tres pacientes murieron súbitamente fuera del INCOR por causas desconocidas.
DISCUSIÓN
Desde el primer TC realizado por Christian Barnard en diciembre del 1967, se han reportado más de 120 000 trasplantes en el registro de la ISHLT (3). Aunque los reportes de Norteamérica y Europa constituyen más del 90% de los datos del registro internacional, se estima que alrededor del 25% a 33% de los TC practicados anualmente no son enviados al registro de la ISHLT (3,10). Según un reporte reciente, hasta el 2016 se han registrado alrededor de 9000 pacientes trasplantados en Sudamérica (11). Con más de 4500 casos reportados hasta la fecha y alrededor de 350 trasplantes por año (11,12), Brasil es el país con el mayor número de TC realizados en la región. El Perú con una de las tasas de donación más bajas en Sudamérica (2,4 donantes por millón de habitantes) (11), ha reportado 97 TC desde 1993. Esta cifra confirma que la tasa de TC en nuestro país está aún muy por debajo de las reportadas en países desarrollados (3). Al igual que en otros países de Latinoamérica, diversos factores como las creencias religiosas, la estructura legal y una pésima cultura de donación pueden explicar esta marcada diferencia (13).

El TC constituye una de las pocas alternativas de tratamiento para muchos pacientes con estadios avanzados de insuficiencia cardiaca (1). Sin embargo, esta modalidad de tratamiento puede no ser tan beneficiosa en ciertas patologías (tales como la sarcoidosis, la miocarditis de células gigantes o la amiloidosis de cadenas ligeras), por la probabilidad de recurrencia de la patología primaria en el injerto (14). Diversos estudios muestran que algunos de estos pacientes presentan una menor sobrevida debido a la recurrencia en el injerto o a la progresión de la enfermedad en otros órganos (14,15). Aunque el número de BEM pretrasplante practicadas en nuestra serie fue limitado, la selección adecuada de los pacientes permitió identificar dos casos con amiloidosis de cadenas ligeras y un caso con miocardiopatía arritmogénica. Al igual que una serie anterior (14), nuestros hallazgos sugieren que en el contexto clínico adecuado la BEM pretrasplante puede ser una herramienta útil para identificar patologías con tendencia a la recurrencia.
En concordancia con los datos del registro de la ISHLT(3), la miocardiopatía dilatada idiopática (50,8% de casos) representa la causa principal de TC en nuestra serie. Considerando que esta condición representa un diagnóstico patológico de exclusión, frecuentemente se requiere el descarte de otras entidades asociadas, tales como el abuso de alcohol, el estado periparto y la miocarditis (16). Reportes previos han demostrado que después de realizar el análisis histopatológico, hasta el 37,5% de los pacientes trasplantados por miocardiopatia dilatada pueden presentar un diagnóstico final diferente del diagnóstico clínico inicial (17). Estudios realizados en la década del noventa, muestran que la discrepancia diagnóstica ocurría con mayor frecuencia entre los pacientes con cardiopatía isquémica (18,19). Sin embargo, tras la introducción de nuevas técnicas de diagnóstico por imagen, series más recientes indican que la miocarditis, la sarcoidosis, y la miocardiopatia arritmogénica, presentan con mayor frecuencia un diagnóstico clínico erróneo (14,17,20-22).
La evaluación histopatológica rutinaria de los explantes cardiacos en el INCOR, nos permitió confirmar el diagnóstico clínico previo, y en una minoría de casos obtener un diagnóstico etiológico más preciso de la insuficiencia cardiaca. El diagnóstico clínico incorrecto se realizó en el 8,2% de los casos; no obstante, si sólo consideramos los casos diagnosticados clínicamente como miocardiopatía dilatada (36 pacientes) la discrepancia se incrementa hasta el 13,9%. Nuestros hallazgos son comparables con los porcentajes de discrepancia clínico-patológica reportados en otras series (8 a 17%) (14,18-22). Al igual que en reportes previos, en nuestra serie la mayor discrepancia ocurrió entre el subgrupo de pacientes con miocarditis (14). Estos hallazgos son preocupantes porque los pacientes mal diagnosticados podrían ser erróneamente tratados durante el seguimiento, o inadecuadamente estratificados dentro las categorías de prioridad en la lista de espera de los diversos programas de trasplante (22).
A pesar de la permanente búsqueda de métodos diagnósticos no invasivos durante las cuatro últimas décadas, con una sensibilidad superior al 90% la BEM continúa siendo el gold standard para el seguimiento del rechazo (23). El rechazo del injerto cardiaco se puede clasificar por el tipo de respuesta inmune, el tejido diana, y el tiempo de presentación (24). El RCA es una respuesta inmune dirigida primariamente al cardiomiocito, tiende a ocurrir dentro de los primeros seis a doce meses del trasplante, y se caracteriza histológicamente por la presencia de infiltrado inflamatorio linfocítico en el miocardio (9,23). En la práctica clínica, la extensión del infiltrado inflamatorio en el miocardio define el grado de RCA, y frecuentemente determina la necesidad de tratamiento. Los avances en inmunosupresión han permitido reducir la incidencia de RCA desde un 30% en la década pasada, hasta un 25% en la actualidad (3). En nuestra serie, el 21,1% de pacientes experimentaron RCA moderado/ severo (>2R) que justificó el inicio de tratamiento, la gran mayoría de ellos (75,0%) dentro del primer año postrasplante. A diferencia del registro de la ISHLT, las tasas de RCA en los reportes latinoamericanos son extremadamente variables (19% - 57%) (13,25), probablemente por el uso de diferentes criterios diagnósticos y por variaciones temporales en los protocolos de biopsia (7,13,25-28).
A diferencia del RCA, el RMA se debe al depósito de inmunocomplejos en la pared de pequeños vasos sanguíneos del miocardio, y ocurre usualmente en ausencia de infiltrado inflamatorio (24,29). El diagnóstico de esta entidad es complejo, y requiere de la coincidencia de un conjunto articulado de alteraciones histológicas, serológicas y clínicas (8). Considerando que las alteraciones histológicas del RMA no siempre están presentes en los pacientes (29), frecuentemente se necesita evaluar el depósito de C4d en la pared de los capilares del miocardio (8,29). Clínicamente, el RMA suele ocurrir precozmente dentro del primer mes de trasplante, incrementa el riesgo de desarrollar enfermedad vascular del injerto (EVI) y se asocia con una baja sobrevida del injerto (29). Generalmente se diagnostica en individuos jóvenes alosensibilizados expuestos a transfusiones, gestaciones o dispositivos de asistencia ventricular (29). En nuestro estudio solo tres pacientes fueron diagnosticados con RMA. Aunque esta frecuencia es similar a algunas series latinoamericanas (4,5%) (7) y asiáticas (6%) (21), parece ser significativamente menor a las cifras publicadas en series estadounidenses (10% a 15%) (29).
Tradicionalmente se ha considerado que los episodios de RMA ocurren precozmente después del trasplante (29). Sin embargo, evidencia reciente sugiere que el reporte de la aparición tardía de esta condición más allá del año postrasplante, se está incrementado durante los últimos años, especialmente entre los pacientes con pobre adherencia al tratamiento (3032). Huasin et al. han demostrado recientemente que hasta el 65% de los episodios de RMA pueden ocurrir después del primer año de seguimiento (31). Asimismo, en comparación con la expresión temprana de C4d, la expresión tardía de este anticuerpo en la pared de los capilares del miocardio se asocia con un mayor riesgo de mortalidad (31,32). En nuestra serie el único episodio tardío de RMA (35 meses postrasplante) se caracterizó por la presencia aislada de macrófagos intravasculares y el depósito focal de C4d (pRMA1 H+). A pesar de haberse descrito como una condición con pobre respuesta al tratamiento convencional (33), el episodio tardío de RMA en nuestra serie fue controlado satisfactoriamente con la terapia habitual (agentes biológicos y plasmaféresis). En concordancia con reportes previos (31,32), nuestro hallazgo sugiere que la ausencia de alteraciones histológicas durante la presentación tardía del RMA, justificaría la monitorización de los anticuerpos circulantes, así como, el uso rutinario de C4d incluso más allá del primer año de seguimiento.
En las últimas décadas, los avances en las técnicas quirúrgicas, así como en el seguimiento posoperatorio, han permitido mejorar notablemente la sobrevida del paciente con TC. Actualmente, la tasa de sobrevida en el registro internacional alcanza el 80% al primer año y casi el 70% a los cinco años postrasplante (3). En nuestro centro la sobrevida se aproxima a 85,1% en el primer año y alcanza el 82,8% en el quinto año. Aunque nuestra experiencia aún es limitada, el análisis de la supervivencia es comparable con los datos reportados por el registro internacional (3). Literatura previa ha demostrado que la distribución de las causas de muerte varía según el intervalo postrasplante que se considere (3). Según los datos de la ISHLT durante el primer mes de seguimiento, hasta el 45% de las muertes se deben a la falla primaria del injerto (3). En nuestra población, la disfunción primaria del injerto fue responsable del 50% de las muertes dentro de los primeros 30 días de trasplante. En concordancia con el registro internacional, las muertes asociadas a infecciones nosocomiales, así como las ocasionadas por el rechazo agudo, durante el primer año de seguimiento fueron las más frecuentes en nuestra población (3).
Entre las limitaciones del estudio resaltan su naturaleza retrospectiva y el corto periodo de seguimiento en relación con la aparición temporal de potenciales complicaciones asociadas al trasplante cardíaco. Son necesarios estudios prospectivos con un mayor número de pacientes para confirmar nuestros hallazgos.
Nuestros resultados muestran que la evaluación histopatológica rutinaria de los explantes cardiacos es esencial para confirmar el diagnóstico etiológico de la insuficiencia cardiaca, principalmente en los casos con diagnóstico clínico de miocardiopatía dilatada. Asimismo, el seguimiento rutinario de los pacientes trasplantados mediante biopsias endomiocárdicas permite demostrar que a pesar de la mejora continua del tratamiento inmunosupresor el RCA todavía es un fenómeno frecuente durante el primer año de trasplante.
Agradecimientos: Los autores desean agradecer al tecnólogo médico Reynaldo Artica, del Laboratorio de Anatomía Patológica del INCOR, por su apoyo en la realización de este estudio.
Contribuciones de los autores: CA y WA conceptualizaron y diseñaron el artículo. CA, WA, FS y JM recolectaron los datos. CA y WA realizaron la interpretación de los datos. Todos los autores participaron en la redacción del artículo. ML, JM y DG realizaron la revisión crítica del artículo. Todos los autores aprobaron la versión final del artículo.
Fuentes de financiamiento: Autofinanciado.
Conflicto de intereses: Los autores declaran no tener conflictos de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. Alraies MC, Eckman P. Adult heart transplant: indications and outcomes. J Thorac Dis. 2014;6(8):1120-8.
2. Burke M, Potena L. Cardiac Transplantation and the contribution of pathology. En: Leone O, Angelini A, Bruneval P, Potena L. editores. The pathology of cardiac transplantation: A clinical and pathological perspective. Switzerland: Springer; 2016. p. 3-10.
3. Lund LH, Khush KK, Cherikh WS, Goldfarb S, Kucheryavaya AY, Levvey BJ, et al. The Registry of the International Society for Heart and Lung Transplantation: Thirty-fourth Adult Heart Transplantation Report-2017; Focus Theme: Allograft ischemic time. J Heart Lung Transplant. 2017;36(10):1037-46.
4. Piazza A, Deza L, Wagner P. Trasplante de órganos en el Perú. Anales de la Academia Nacional de Medicina. 2006:12-9.
5. González-Vílchez F, Gómez-Bueno M, Almenar-Bonet L, Crespo-Leiro MG, Arizón Del Prado JM, Delgado-Jiménez J, et al. Spanish Heart Transplant Registry. 28th Official Report of the Spanish Society of Cardiology Working Group on Heart Failure (1984-2016). Rev Esp Cardiol. 2017;70(12):1098-1109.
6. Bocchi EA, Fiorelli A. The Brazilian experience with heart transplantation: a multicenter report. J Heart Lung Transplant. 2001;20(6):637-45.
7. Favaloro R, Peradejordi M, Bertolotti A, Diez M, Favaloro L, Gomez C, et al. Results of heart transplantation: 16 years’ experience in a center in Argentina. Transplant Proc. 2010;42(1):321-3.
8. Berry GJ, Burke MM, Andersen C, Bruneval P, Fedrigo M, Fishbein MC, et al. The 2013 International Society for Heart and Lung Transplantation Working Formulation for the standardization of nomenclature in the pathologic diagnosis of antibody-mediated rejection in heart transplantation. J Heart Lung Transplant. 2013;32(12):1147-62.
9. Stewart S, Winters GL, Fishbein MC, Tazelaar HD, Kobashigawa J, Abrams J, et al. Revision of the 1990 working formulation for the standardization of nomenclature in the diagnosis of heart rejection. J Heart Lung Transplant. 2005;24(11):1710-20.
10. Krittayaphong R, Ariyachaipanich A. Heart Transplant in Asia. Heart Fail Clin. 2015;11(4):563-72.
11. Duro V, Santiago-Delpin E, Tanús R. Latin America Transplantation Registry Report 2015-2016 [Internet]. San Juan: Sociedad deTrasplante de América Latina y el Caribe; 2017 [citado el 10 de octubre de 2017]. Disponible en: http://www.stalyc.net/registros/file/74-latin-america-transplantation-registry-report-2015-2016.html.
12. Mejia JA. The evolution of heart transplantation in Latin America: The ISHLT knows no boundaries [Internet]. The International Society for Heart and Lung Transplantation; 2017 [citado el 10 de octubre de 2017]. Disponible en: www.ishlt.org/ContentDocuments/2017JunLinks_EdCorner.html. 2017;9(2).
12. Villavicencio M, Rossel V, Larrea R, Peralta JP, Larrain E, Sung Lim J, et al. Experiencia clínica con 53 trasplantes cardiacos consecutivos. Rev Med Chile. 2013;141(12):1499-1505.
13. Luk A, Metawee M, Ahn E, Gustafsson F, Ross H, Butany J. Do clinical diagnoses correlate with pathological diagnoses in cardiac transplant patients? The importance of endomyocardial biopsy. Can J Cardiol. 2009; 25(2):e48-54.
14. Sousa M, Monohan G, Rajagopalan N, Grigorian A, Guglin M. Heart transplantation in cardiac amyloidosis. Heart Fail Rev. 2017;22(3):317-327.
15. Zhang M, Tavora F, Huebner T, Heath J, Burke A. Allograft pathology in patients transplanted for idiopathic dilated cardiomyopathy. Am J Surg Pathol. 2012;36(3):389-95.
17. Lü FY, Song LF, Liu L, Zhao H, Wang HY, Li L, et al. Clinicopathologic analysis of dilated heart in cardiac transplant recipients. Zhonghua Bing Li Xue Za Zhi. 2007;36(12):796-800.
18. Bortman G, Sellanes M, Odell DS, Ring WS, Olivari MT. Discrepancy between pre- and post-transplant diagnosis of end-stage dilated cardiomyopathy. Am J Cardiol. 1994;74(9):921-4.
19. Angelini A, Boffa GM, Livi U, Barchitta A, Casarotto D, Thiene G. Discordance between pre and post cardiac transplant diagnosis: implications for pre- and postoperative decision making. Cardiovasc Pathol. 1999;8(1):17-23.
20. Roberts WC, Roberts CC, Ko JM, Filardo G, Capehart JE, Hall SA. Morphologic features of the recipient heart in patients having cardiac transplantation and analysis of the congruence or incongruence between the clinical and morphologic diagnoses. Medicine. 2014;93(5):211-35.
21. Ishibashi-Ueda H, Ikeda Y, Matsuyama TA, Ohta-Ogo K, Sato T, Seguchi O, et al. The pathological implications of heart transplantation: experience with 50 cases in a single center. Pathol Int. 2014;64(9):423-31.
22. Raeisi-Giglou P, Rodriguez ER, Blackstone EH, Tan CD, Hsich EM. Verification of heart Disease: Implications for a new Heart Transplantation Allocation System. JACC Heart Fail. 2017;5(12):904-913.
23. Tazelaar HD, Edwards WD. Pathology of cardiac transplantation: recipient hearts (chronic heart failure) and donor hearts (acute and chronic rejection). Mayo Clin Proc. 1992;67(7):685-96.
24. Burke AP, Tavora FR. Acute cellular rejection. En: Burke AP, Aubry MC, Maleszewski JJ, Alexiev BA, Tavora FR. editores. Practical thoracic pathology: Diseases of the lung, heart and thymus. Philadelphia: Wolters Kluwer; 2017.
25. Paez G, Melgarejo I. Mobimortalidad, función ventricular e incidencia del rechazo celular en el trasplante cardiaco en la clínica Abood Shaio [Internet]. Bogotá: Universidad del Rosario; 2011 [citado el 10 de octubre de 2017]. Disponible en: http://repository.urosario.edu.co/bitstre am/10336/2987/1/79284865-2012.pdf.
26. Ceruti B, Chiesa P, Tambasco J, Anzibar R, Gutierrez C, Barboza S, et al. Trasplante cardiaco: Experiencia de 15 años del Instituto de Cardiologia Infantil. Rev Urug Cardiol. 2012;27:273-285.
27. Herrera E, Molina J, Ortega O, Chavarría U, Martínez H, Elizondo L, et al. Trasplante cardiaco en Monterrey, Nuevo León. Rev Invest Clín. 2011;63(1):91-95.
28. Chih S, Chruscinski A, Ross HJ, Tinckam K, Butany J, Rao V. Antibody-mediated rejection: an evolving entity in heart transplantation. J Transplant. 2012;2012:210210.
29. Hammond ME, Kfoury AG. Antibody-mediated rejection in the cardiac allograft: diagnosis, treatment and future considerations. Curr Opin Cardiol. 2017;32(3):326-335.
30. Potena L, Manfredini V, Leone O. Cardiac graft failure/dysfunction: Clinical issues and role of endomyocardial biopsy. En: Leone O, Angelini A, Bruneval P, Potena L. editores. The pathology of cardiac transplantation: A clinical and pathological perspective. Switzerland: Springer; 2016.
31. Husain AN, Mirza KM, Fedson SE. Routine C4d immunohistochemistry in cardiac allografts: Long-term outcomes. J Heart Lung Transplant. 2017;36(12):1329-1335.
32. Loupy A, Cazes A, Guillemain R, Amrein C, Hedjoudje A, Tible M, et al. Very late heart transplant rejection is associated with microvascular injury, complement deposition and progression to cardiac allograft vasculopathy. Am J Transplant. 2011;11(7):1478-87.
33. Gupta G, Abu Jawdeh BG, Racusen LC, Bhasin B, Arend LJ, Trollinger B, et al. Late antibody-mediated rejection in renal allografts: outcome after conventional and novel therapies. Transplantation. 2014;97(12):1240-6.
Correspondencia:
Cristian Aguilar Carranza
Teléfono: (+511) 4111560, Anexo 5820
Dirección: Laboratorio de Patología, Instituto Nacional
Cardiovascular «Carlos Alberto Peschiera Carrillo». Coronel Zegarra 417, Jesús
María, Lima, Perú.
Correo electrónico:
dr.cris85@yahoo.com
Recibido: 04/12/2017
Aprobado: 16/05/2018
En línea: 02/07/2018