
ORIGINAL BREVE
Concentración de malondialdehido en sujetos que residen a gran altitud: estudio exploratorio
Concentration of malondialdehyde in subjects living at high altitudes: exploratory study
Ingrid Gaby Melgarejo Pomar1,2,a, Elfride Balanza Erquicia1,2,b, Lizeth Torrez Colmena1,2,c, Sergio Quisberth Barrera3,d, Pilar Leina Suzaño Vargas3,b
1
Instituto Boliviano de Biología de Altura (IBBA). La Paz, Bolivia.
2 Facultad de Medicina. Universidad Mayor de San Andrés. La Paz,
Bolivia.
3 Facultad de Bioquímica. Universidad Mayor de San Andrés La Paz,
Bolivia.
a Médico neumólogo; b licenciada en Bioquímica; c
cirujano general; d licenciado en Bioquímica, magíster en
Ciencias Biológicas y Biomédicas
RESUMEN
El objetivo fue investigar el comportamiento del malondialdehido (MDA), biomarcador de estrés oxidativo, a grandes altitudes (3500–4200 m de altitud). Se realizó un estudio exploratorio en 91 sujetos de las ciudades de La Paz y El Alto seleccionados a través de una encuesta y examen clínico; la determinación de MDA se realizó con una técnica colorimétrica. Las medidas de tendencia central, dispersión y porcentajes se usaron para la descripción de datos, la prueba de Mann Whitney y Kruscal Wallis para explorar diferencias entre varones y mujeres, grupo etario y altitud. La mediana de concentración de MDA fue de 4,1 µmol/L (RIC 2,4–5,4), la mayor concentración se encontró en mayores de 40 años. El valor de la media encontrada es mayor que los referidos para el nivel del mar y supone la influencia de la hipoxia sobre los valores del MDA, sin embargo, no se encontraron diferencias entre sexo y grupos etarios.
Palabras clave: Estrés oxidativo; Malondialdehido; Enfermedad de la altura; Hipoxia; Bolivia (fuente: DeCS BIREME).
ABSTRACT
The objective of
this study was to determine the levels of malondialdehyde (MDA), an
oxidative stress biomarker, in individuals living at high altitudes
(3500–4200 m). This exploratory study evaluated 91 subjects from La Paz and
El Alto using a questionnaire and clinical examination. MDA levels were
measured using a colorimetric technique. Measures of central tendency,
dispersion, and percentages were used to describe data, and the Mann-Whitney
test and Kruskal-Wallis test were used to assess differences between the
sexes, age groups, and altitudes. The median concentration of MDA was 4.1
μmol/L (RIC 2.4–5.4) and the highest concentration of MDA was found in
individuals older than 40 years.
The average MDA levels were higher than those found at sea level, a result
we believe is due to the effect of hypoxia. However, there were no
differences in the MDA levels between the sexes or age groups.
Key words: Oxidative stress; Malondialdehyde; Altitude sickness; Hypoxia; Bolivia (source: MeSH NLM).
INTRODUCCIÓN
La célula requiere de oxígeno para hacer efectiva su actividad aeróbica, como producto del metabolismo celular se generan radicales libres (RL) (1). Los RL derivados del oxígeno son moléculas inestables y altamente reactivas (2,3,4). Los RL producidos por la propia célula y los diferentes orgánulos celulares participan de diferentes funciones celulares como la diferenciación, proliferación, limitación del crecimiento y apoptosis celular, así como en la defensa del organismo contra microorganismos patógenos, los más importantes son el radical superóxido (O2 - ), radical hidroxilo (OH), radical peróxido (ROO) y el peróxido de hidrógeno (H2 O2 ).
Los RL, también son generados exógenamente y provienen de la radiación ionizante, uso de pesticidas, conservantes, y de la contaminación del medioambiente (3). Se entiende por estrés oxidativo al proceso de desequilibrio oxidante antioxidante en el que la cantidad de RL generados endógena y exógenamente sobrepasan la capacidad de los sistemas antioxidantes, causando daños estructurales en diferentes macromoléculas, lípidos, proteínas y sobre el ácido desoxirribonucleico (ADN) (2,3,4).
La interacción de los radicales libres con los lípidos séricos y tisulares se denomina peroxidación lipídica, proceso que da lugar a varios metabolitos de degradación, uno de ellos el malondialdehido (MDA), único aldehido medible, por lo que es ampliamente usado como biomarcador de estrés oxidativo (4-8).
Se conoce que la hipoxia genera RL y que induce al estrés oxidativo, este es un importante factor de riesgo para enfermedades descritas como propias de la desadaptación a la hipoxia hipobárica (6,9,10), por lo que nos propusimos como objetivo investigar el comportamiento del MDA como biomarcador de estrés oxidativo en residentes de ciudades de gran altura.

EL ESTUDIO
DISEÑO Y POBLACIÓN DE ESTUDIO
Se realizó un estudio exploratorio, en dos ciudades de Bolivia, La Paz ubicada a 3600 m de altitud y El Alto ubicada a 4200 m de altitud.
SELECCIÓN DE PARTICIPANTES
Los participantes se escogieron mediante una encuesta de selección que incluyó preguntas orientadas a conocer si existía algún hábito o exposición que aumente el estrés oxidativo, como antecedentes de tabaquismo, alcoholismo, drogadicción, exposición al monóxido de carbono o exposición al humo de leña.
Se incluyeron en el estudio a aquellas personas residentes y nativas de las ciudades de altura, se excluyeron sujetos con antecedentes o evidencia de enfermedades en la esfera cardiorrespiratoria, metabólica, renal, pancreática o hepática, también se excluyeron sujetos con sobrepeso y obesidad y aquellos que refirieron ocupaciones tales como la construcción, fabriles y otros que tuvieran que ver con la inhalación de tóxicos ambientales, así como jóvenes que practicaban deporte extremo, mujeres embarazadas y otras situaciones que aumenten la defensa antioxidante como consumo de vitaminas, antioxidantes y ejercicio cotidiano.
PROCEDIMIENTO
Se realizó una invitación a participar del estudio usando trípticos informativos y afiches de comunicación repartidos por miembros del equipo de investigación entre la población de las ciudades de La Paz y El Alto. Los participantes fueron evaluados con la encuesta de selección y si cumplían con los criterios de inclusión fueron invitados a participar en el estudio.
La evaluación se realizó en las instalaciones del Instituto Boliviano de Biología de Altura (IBBA) donde se registró una historia clínica breve y se realizó un examen físico completo y especializado, además se tomó una muestra sanguínea (3 mL) en el laboratorio de Biología Molecular del IBBA, en condiciones de reposo y ayuno de 12 h como mínimo.
MEDICIONES
Se realizaron las mediciones de talla y peso con una balanza mecánica de pie con tallímetro modelo 2391 DETECTO/USA previamente calibrada (precisión: 100 g para el peso y 0,5 cm para la talla).
La determinación de la concentración de MDA se realizó a través de los métodos de Ohkawa y Asakawa modificados, basados en la reacción del MDA con el ácido 2- tiobarbitúrico (TBA) observándose una aducto MDA– TBA cromógeno, medido a través de espectrofotometría en suero sanguíneo (2,6,8,11,12).
Para la lectura de la concentración de MDA se utilizó un espectrofotómetro UV visible Evolution 60S Termofisher Scientific USA, en condiciones óptimas de laboratorio. Los valores de MDA fueron expresados en µmol/L.
ANÁLISIS ESTADÍSTICOS
Las variables categóricas fueron presentadas como frecuencias y porcentajes, y las cuantitativas a través de la mediana y rango intercuartílico, previa determinación de la normalidad de la curva de MDA con la prueba de Kolmogorov Smirnov. Se utilizó la prueba de Mann Whitney y Kruskal Wallis para explorar diferencias entre las concentraciones de MDA, según sexo, grupo etario y altitud de las ciudades. Se aceptó un valor de p<0,05 como significativo. El paquete estadístico utilizado para el análisis fue SPSS versión 18.
CONSIDERACIONES ÉTICAS
El estudio es parte del trabajo de investigación titulado "Estrés oxidativo por uso de leña y exposición al monóxido carbono–repercusión cardiorrespiratoria en mujeres nativas y residentes de altura" (12), cuyo protocolo de estudio fue aprobado por el Comité de Ética en Investigación de la Universidad Mayor de San Andrés y que fue financiado para su ejecución con recursos de impuestos a los hidrocarburos (IDH). El consentimiento informado fue firmado por los adultos mayores de 18 años y en caso de los menores de edad, se solicitó el consentimiento de los padres o tutores. Todos los participantes fueron informados sobre los resultados e implicaciones de los valores de MDA encontrados.
RESULTADOS
La invitación a participar en el estudio fue respondida por 160 personas, 59 varones y 101 mujeres; luego de la encuesta que selección y del examen clínico se seleccionaron 91 sujetos.
Los rangos de edad de los participantes se encontraban entre 14 a 55 años, 28 (30,7%) participantes fueron varones y 63 (69,3%) fueron mujeres. La mayoría de las mujeres se dedican a las labores de la casa, los jóvenes son estudiantes de colegio o de universidad y los adultos cumplen actividades de oficina. La media de la edad de los participantes fue de 31,49 ± 11,13 para mujeres y de 30,57 ± 10,15 para varones. Los participantes en su mayoría eran adultos de entre 21 y 40 años.
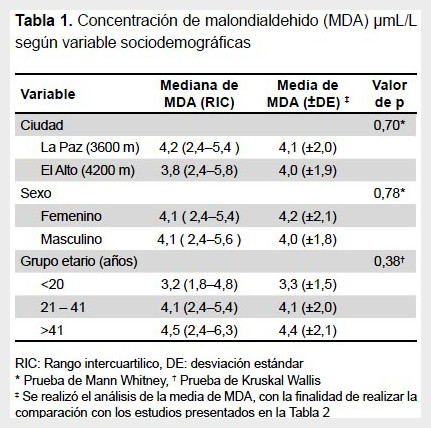
El valor de la mediana de MDA fue de 4,2 µmol/L para el grupo de ciudad de La Paz y de 3,8 µmol/L para el grupo de la ciudad de El Alto. No se observaron diferencias significativas en la mediana del valor de MDA de acuerdo a la altura, sexo y grupo etario. Asimismo, para realizar la comparación con estudios similares, se halló la media y desviación estándar de los valores de MDA según sexo, grupo etario y altitud (Tabla 1).
DISCUSIÓN
El MDA, producto final de la lipoperoxidación, es utilizado ampliamente como biomarcador de estrés oxidativo, en cuyo metabolismo forma malodialdehido acetaldehído (MAA), que finalmente se une a los grupos aminos de las proteínas, comportándose como proteína inmunogénica o autoanticuerpo que activa mecanismos fisiopatológicos de la ateroesclerosis, la diabetes mellitus, la preeclamsia, la enfermedad de Parkinson y la enfermedad de Alzheimer (13-17).
Está definido que en un ambiente de hipoxia hipobárica, se generan mayor cantidad de RL, asimismo, se ha evidenciado el papel del estrés oxidativo en el debut de enfermedades denominadas propias de la altura, sean estas de presentación aguda o crónica, como el mal agudo de montaña y el mal crónico de montaña entre otras, asimismo, el estrés oxidativo cumple un papel importante en la génesis de enfermedades como la hipertensión arterial sistémica, la hipertensión pulmonar, la enfermedad renal, la fibrosis pulmonar, el asma, y la esclerosis lateral amiotrófica (13-16).
Existen estudios que muestran valores promedio de este biomarcador para población sana nativa del nivel del mar, existiendo un vació en cuanto a los valores para población nativa y residente de altura, motivación para realizar este estudio.
Al comparar los valores promedio reportados a nivel del mar, con los valores promedio encontrados en nuestro estudio, observamos que en la altura los promedios son mayores, aspecto que nos sugiere ratificar la teoría de que la hipoxia genera y aumenta RL.
De la misma forma, los resultados que obtuvimos revelan un leve aumento de los valores a medida que aumenta la edad, aunque la diferencia no es significativa, nos permite concordar con la hipótesis de que a medida que el ser humano envejece aumentan los RL y estos se acumulan en células y tejidos, proceso acompañado de una disminución en la eficacia de los sistemas antioxidante (6).
Se advierte que los valores de MDA disponibles en la literatura son muy variables y difieren según el autor. Uno de los más importantes, realizado por Yagi, muestra un valor de 3,14 ± 0,31 µmol/L en sujetos de entre 31 a 40 años, el mismo autor observó que los valores se incrementan en enfermedades que afectan los órganos diana como el hígado y el páncreas (17,18). Estepa et al. establecen un valor máximo de 2,35 ±1,35 µmol/L en individuos de una edad promedio de 34 años ±13 años (2). Hoving et al. refieren valores medios de 1,30 ± 0,23 de MDA para una población de 24 individuos sanos en el mismo rango de edad (19). Los tres estudios fueron realizados en un número menor de sujetos que el nuestro y no muestran los valores en relación al género, tampoco las diferencias por grupos de edad (Tabla 2).
La variabilidad de los valores de MDA, reportados en diferentes estudios podría deberse a factores como: la diferente función de los sistemas antioxidantes de cada individuo, la edad, el tipo de alimentación, los grupos étnicos, los hábitos.
Otros estudios, como los Diaz et al. y Bermúdez Pirela et al. refieren también valores de MDA bajos comparados con nuestros hallazgos (20,21). Díaz et al. muestran valores diferenciados para varones y mujeres y son igualmente menores al encontrado en nuestro estudio (20). Nuestros resultados revelan una diferencia no significativa entre los valores de sujetos que viven en la ciudad de El Alto y los que viven en La Paz, aspecto que podría deberse a la menor cantidad de sujetos estudiados de la ciudad de El Alto (Tabla 2).
Las limitaciones del estudio están enfocadas a los pocos recursos económicos, que no permitieron realizar un estudio metodológico de valores de referencia en un número de sujetos representativo de la población. Existen también los sesgos de selección, ya que no se pudo realizar exámenes bioquímicos de rutina, ni exámenes como la determinación de enzimas antioxidantes o pruebas de gabinete como el electrocardiograma y la radiografía de tórax, que corroboren el estado de salud de los participantes, por lo que no se pudo determinar que los participantes estaban sanos.
En conclusión, si bien no encontramos una gran dispersión de los datos, nuestro estudio pone a disposición de los investigadores clínicos y personal médico un valor de MDA diferente a los reportados en múltiples estudios realizados en el llano, permitiendo hipotetizar que el valor de MDA, considerado como normal, sería más elevado en la altura por la mayor generación de RL determinados por la hipoxia hipobárica.
Contribuciones de los autores: IGMP y EBE participaron en la generación y diseño del estudio, el análisis y la interpretación de los datos y la redacción de los borradores. LTC participo en el análisis e interpretación de los datos. SQB participó realizando importantes aportes intelectuales en el contenido del artículo. PLSV participo en el reclutamiento de los sujetos de investigación y aportes en el análisis de datos. Todos revisaron y aprobaron la versión final.
Fuentes de financiamiento: el estudio fue financiado por la Universidad Mayor de San Andrés, de recursos provenientes de los impuestos directos de hidrocarburo, obtenidos a través de concurso.
Conflictos de interés: los autores declaran no tener conflicto de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. Mayor R. Estrés Oxidativo y Sistema de Defensa Antioxidante. Rev Inst Med Trop. 2010; 5(2):1-15.
2. Estepa V, Ródenas S, Martín MC. Op timización de un método para la determinación de la peorxidación lipídica en suero humano. Anal Real Acad Farm. 2001;67(3): 1-16.
3. Domej W, Oettl K, Renner W. Oxidative stress and free radicals en COPD – implications and relevance for treatment. Int J Chron Obstruct Pulmon Dis. 2014;9:1207-24. doi: 10.2147/COPD. S51226.
4. Gonzales GF. Hemoglobina y Testosterona: Importancia en la aclimatación y adaptación a la altura. Rev Peru Med Exp Salud Publica. 2011;28(1):92-100.
5. Herrera EA, Farías JG, González-Candia A, Short SE, Carrasco-Pozo C, Castillo RL. Ω3 Supplementation and intermittent hypobaric hypoxia induce cardioprotection enhancing antioxidant mechanisms in adult rats. Mar Drugs. 2015;13(2):838-60. doi: 10.3390/md13020838.
6. Gutierrez J, Garcia L, Chima MC, Súastegui S, Rivera ME, Cruz L. Determinación de la concentración de malondialdehido y la actividad de enzimas antioxidantes en eritrocitos. Rev Mex Patol Clin. 2009;56(4);223-34.
7. Suzaño P. Estandarización de Métodos Espectrofotométricos para la Determinación de malondialdehido y carboxihemoglobina en Estrés Oxidativo. [Tesis de grado]. La Paz: Instituto Boliviano de Biología de Altura. Facultad de Bioquímica, Universidad Mayor de San Andrés; 2014. Disponible en: http://repositorio.umsa.bo/bitstream/handle/123456789/5687/T-770.pdf?sequence=1&isAllowed=y.
8. Debevec T, Millet G, Pialoux V. Hypoxia Induced Oxidative Stress Modulation with Physical Activity. Front Physiol. 2017;8:84. doi: 10.3389/fphys.2017.00084.
9. Peñaloza D, Arías Stella J. Corazón y circulación pulmonar en grandes alturas: nativos normales y mal de montaña crónico. Rev Peru Cardiol. 2011;37(1):38-56.
10. Torrez CA, Perales MI, Zuñiga H, Carranza E. Niveles de Malondialdehido y catalasa en tejidos de cobayos nativos de la altura. Ciencia e Investigación. 2004;7(8) 28-34.
11. Zelzer S, Oberreither R, Bernecker C, Stelzer I, Truschning-Wilders M, Fauler G. Measurement of total and free malondialdehyde by gas chromatography mass spectrometry comparison with high performance liquid chromatography methology. Free Radic Res. 2013;47(8):651-6. doi: 10.3109/10715762.2013.812205.
12. Melgarejo IG. Balanza EE. Estres oxidativo por uso de lena y exposicion al monóxido de carbono-repercusion cardiorespiratoria en mujeres nativas y residentes de altura: Financiamiento Recursos del Impuesto Directo a los Hidrocarburos IDH 2011-2012. Informe Técnico Final IDH. La Paz: Facultad de Medicina, Universidad Mayor de San Andres (UMSA); 2014. Disponible en: http://bibliotecas.umsa.bo/cgi-bin/koha/opac-detail.pl?biblionumber=235602.
13. Dale Isabella, Rossi R, Colombo R, Giustarini D, Milzani A. Biomarkers of Oxidative Damage in Human Disease. Clin Chem. 2006;52(4):601-23.
14. Ayala A, Muñoz MF, Argüelles S. Lipid Peroxidation: Production , Metabolism, and Signaling Mechanisms of Malondialdehyde and 4- Hydroxy-2-Nonenal. Oxid Med Cell Longev. 2014;2014:360438. doi: 10.1155/2014/360438.
15. Moreto F, de Oliveira E, Manda R, Burini RC. The Higher Plasma Malondialdehyde Concentrations Are Determined by Metabolic Syndrome- Related Glucolipotoxicity. Oxid Med Cell Longev. 2014;2014:505368. doi: 10.1155/2014/505368.
16. Ogura S, Shimosawa T. Oxidative stress and organ damages. Curr Hypertens Rep. 2014;16(8):452. doi: 10.1007/s11906014-0452-x.
17. Yagi K. Lipid peroxides and reated radicals in clinical medicine. Adv Exp Med Biol. 1994;366:1-15.
18. Yagi K. Lipid Peroxides in Hepatic, Gastrointestinal, and Pancreatic Diseases. In: Armstrong D. Free Radicals in Diagnostic Medicine. Advances in Experimental Medicine and Biology. Springer. Boston: MA; 1994.165-169.
19. Hoving EB, Laing C, Rutgers HM, Teggeler M, van Doormaal JJ, Muskiet FA. Optimized determination of malondialdehyde in plasma lipid extracts using 1,3-diethyl-2-thiobarbituric acid: influence of detection method and relations with lip ids and fatty acids in plasma from healthy adults. Clin Chim Acta. 1992;208(12):63-76.
20. Diaz J, Serrano E, Acosta F, Carbonell LF. Reference Intervals for Four Biochemistry Analytes in Plasma for Evaluating Oxidative Stress and Lipid Peroxidation in Human Plasma.Clin Chem. 1998;44(10):2215-7.
21. Bermúdez Pirela VJ, Bracho V, Bermúdez Arias FA, Medina Reyes MT, Núñez Pacheco M, Amell De Díaz A, et al. Comportamiento del malondialdehido y el óxido nítrico séricos en pacientes con infarto de miocardio. Rev Esp Cardiol. 2000;53(4):502-6.
Correspondencia: Ingrid Gaby Melgarejo Pomar.
Dirección: Instituto Boliviano de Biología de Altura (IBBA). Zona
Miraflores Complejo Hospitalario de Miraflores, Calle Claudio Sanjinés. La
Paz, Bolivia.
Teléfono: (591) 22242059
Correo electrónico:
ingridmeldany@gmail.com
Recibido:
18/04/2017
Aprobado: 22/11/2017
En línea: 07/12/2017