Artículo Original
Prevalencia de la infección por el virus de hepatitis B en niños menores de 5 años de comunidades indígenas de la Amazonía peruana posterior a intervenciones mediante inmunización
Prevalence of hepatitis B infection in children under 5 years old on indigenous communities of the peruvian Amazonia after immunization interventions
César Cabezas-Sánchez 1,3,a, Omar Trujillo-Villarroel2,b, Carol Zavaleta-Cortijo2,c, Dante Culqui-Lévano2,b , Magna Suarez-Jara1,d, Neptalí Cueva-Maza2,c, Shirley Monzon2,c
1 Centro Nacional de Salud Pública, Instituto Nacional de Salud. Lima, Perú.
2 Centro Nacional de Salud Intercultural, Instituto Nacional de Salud. Lima, Perú
3 Instituto de Medicina Tropical “Daniel A. Carrión”, Universidad Nacional Mayor de San Marcos. Lima, Perú.
a Médico infectólogo; b médico epidemiólogo; c médico cirujano; d biólogo
RESUMEN
Objetivos. Determinar la prevalencia de infección y de sobreprotección para virus hepatitis B (HVB) en niños indígenas residentes en tres cuencas de la Amazonía peruana. Materiales y métodos. Se realizó un estudio transversal analítico en tres cuencas hidrográficas (ríos Pastaza, Morona y Bajo Urubamba), donde habitan seis pueblos indígenas: shapra, candoshi, machiguengas, yine, ashaninka y nanti. Se incluyeron niños menores de 5 años. Se aplicó una encuesta y revisión del carné de vacunación, y se obtuvo una muestra de suero que se procesó con la técnica de ELISA para detectar HBsAg, anti-HBc total y anti-HBs, definiendo “niños seroprotegidos” si fueron reactivos al anti-HBs y no reactivos al anti-HBc. Resultados. Se incluyó un total de 742 niños menores de 5 años residentes en seis comunidades indígenas, donde 380 (51,2%) eran varones y 169 (22,9%) de un año a menos. Sobre la vacunación contra HVB registrado por carné, solo 434 (58,5%) había recibido tres dosis; 208 (38,8%) recibieron la primera dosis en las primeras 24 h. No se detectaron casos con HBsAg. El 88,8% de los niños había seroconvertido, con variaciones según la población indígena entre 67 a 100% de seroconversión. Conclusiones. No se detectaron casos de infección crónica para HVB en la población evaluada. La cobertura de la vacunación mediante revisión del carné es baja en contraste el promedio de seroconversión que es alto.
Palabras clave: Hepatitis B; Inmunización; Niño; Población indígena; Seroprevalencia; Comunidades indígenas (fuente: DeCS BIREME).
ABSTRACT
Objectives. To determine the prevalence of hepatitis B virus (HVB) infection and seroprotection in indigenous children living in three draining basins of the Peruvian Amazon. Materials and methods. A cross sectional study was conducted in three draining basins (Pastaza, Morona and Lower Urubamba rivers), home to six indigenous populations: shapra, candoshi, machiguenga, yine, ashaninka and nanti. Children under 5 years were included. A survey and review of the vaccination card was applied, and a serum sample was processed with ELISA for HBsAg, total anti-HBc and anti-HBs was obtained, defining “seroprotected children” if they were reactive to anti-HBs and non-reactive to anti-HBc. Results. A total of 742 children under 5 years old residents in six indigenous communities were included in the study. 380 (51.2%) were male and 169 (22.9%) one year old or younger. Regarding recorded HVB vaccination on the card, only 434 (58.5%) had received three doses; 208 (38.8%) received the first dose within 24 hours. No cases were detected with HBsAg. 88.8% of children had seroconverted, varying between 67-100% across the populations. Conclusions. No cases of chronic HBV infection were detected. The vaccination coverage by card revision is low, contrasting with high seroconversion rates.
Key words: Hepatitis B; Immunization; Child; Indigenous population; Seroprevalence; Indigenous population (source: MeSH NLM).
INTRODUCCIÓN
La hepatitis viral B (HVB) produce enfermedad aguda y crónica, y es de distribución mundial. La Organización Mundial de Salud calcula que cada año, alrededor de 600 000 personas mueren a consecuencia de la HVB, a pesar de ser una enfermedad prevenible de forma eficaz y segura (1). En Latinoamérica, la prevalencia de infección por HVB, en general, es baja o intermedia (2), sin embargo, en algunas áreas de la Amazonía de Perú y Brasil, es considerada de alta endemicidad y persiste como un gran problema de salud pública (3).
La infección por HVB afecta sobre todo a minorías étnicas, así, por ejemplo, en los yuki de Bolivia, los xavánte de Brazil y los yukpa de Venezuela, se reportan prevalencias de antiHBc de 74, 60 y 62% respectivamente (4-5). En Perú, un estudio realizado en el año 1996, que incluyó pobladores indígenas de 12 cuencas amazónicas, encontró que la prevalencia de antiHBc en niños de 0 a 5 años fue aproximadamente del 40% y que el 9,4% eran portadores de HBsAg (6). Pueblos como los candoshi o shapra, ubicados en la Amazonía peruana, incluso han estado en peligro de extinción debido a la infección por HVB (7).
Además, en escenarios de endemicidad intermedia (2 a 7%) o elevada (8% a más), el riesgo de padecer infección crónica tiene una relación inversa con la edad en que ocurre la primoinfección, siendo mucho mayor si se adquiere el virus en el periodo perinatal, con un riesgo de 80 a 90% de cronicidad, mientras que en la edad adulta la probabilidad es menor al 5%, y son los niños el principal grupo de riesgo para adquirir esta infección (8) . Por ello, la medida más efectiva para prevenir la infección por HVB, tanto en su forma aguda como crónica, es la vacunación infantil. Esta debe comenzar lo más pronto posible, preferentemente dentro de las primeras 24 h de vida para maximizar el efecto protector y evitar la transmisión perinatal (9).
Al conocerse la importancia de la vacunación y la vulnerabilidad de los pueblos indígenas para la HVB, en el Perú, desde 1996, se incorporó la vacuna contra la HVB en el programa ampliado de inmunizaciones (PAI) para niños menores de un año residentes de áreas de intermedia y alta endemicidad y, desde el año 2003, se universalizó la vacuna para menores de un año en todo el ámbito nacional (10). En particular, en los pueblos candoshi y shapra se contó con la participación del Fondo de las Naciones Unidas para la Infancia (UNICEF), y otras entidades internacionales que, en coordinación con el Ministerio de Salud del Perú (MINSA) y las autoridades locales, permitieron el ingreso de personal de salud que realizó las vacunaciones (7).
Es de esperar que la vacunación sea altamente eficaz en controlar la infección por HVB, sin embargo, dadas las condiciones de difícil acceso geográfico, dificultades para acceder a los servicios de salud y prácticas culturales de las poblaciones indígenas amazónicas, es pertinente conocer cuál es el estado de los diferentes marcadores para HVB en estas poblaciones, en comparación con determinaciones anteriores, así como reconocer qué factores se asocian tanto a la infección como a los niveles de sobreprotección. Por ello, el objetivo de este estudio fue evaluar la prevalencia de infección y de seroprotección para HVB en niños indígenas ubicados en tres cuencas hidrográficas (ríos Pastaza, Morona y Bajo Urubamba) de la Amazonía peruana, y explorar algunos factores que pueden estar relacionados a estas determinaciones.
MATERIALES Y MÉTODOS
DISEÑO Y POBLACIÓN
Se realizó un estudio observacional transversal y analítico en tres cuencas hidrográficas de la Amazonía peruana: Pastaza y Morona en la región Loreto, y Bajo Urubamba en la región Cusco (Figura 1). Las tienen un clima cálido, húmedo y lluvioso con una temperatura que oscila entre 22 y 32 ºC en gran parte del año.

En la zona del Pastaza y Morona habitan los pueblos candoshi y shapra. Se trata de comunidades relativamente aisladas, la única forma de acceso es fluvial y, dependiendo de la época del año, hay comunidades a las que es muy difícil llegar; se dedican principalmente a la pesca, caza y cultivo de algunas plantas como yuca y maíz (7). La zona del Bajo Urubamba es habitada principalmente por el pueblo indígena machiguenga, además de los yine, asháninka y nanti. Esta área se caracteriza por albergar las más importantes reservas de gas del Perú, por ello, a pesar de su difícil acceso geográfico, mantiene un constante contacto con ciudades urbanizadas.
En estas zonas se han seguido las estrategias de vacunación del programa nacional ampliado de inmunizaciones (hoy Estrategia Sanitaria Nacional de Inmunizaciones del MINSA). Por ser consideradas áreas de alta endemicidad se ha promovido la vacunación para HVB a los recién nacidos dentro de las primeras 24 h de vida y completar, al menos, tres dosis de vacunas. Adicionalmente, en la zona norte (cuenca Pastaza y Morona), por considerarse población en riesgo de desaparecer por su escaso número de habitantes y las altas tasas de hepatitis B y D registradas, se reforzaron las actividades de vacunación con el apoyo de la UNICEF, mediante el proyecto denominado “Atención integral de la emergencia por hepatitis b en los pueblos candoshi y shapra” por lo que se implementaron servicios de salud con medios de transporte, congeladoras, entrenamiento a promotores y atención a las gestantes (11).
MUESTREO Y TRABAJO DE CAMPO
La población total fue estimada a partir de la información del censo nacional del año 2007, y de los censos locales que realiza el MINSA. La población total menor de 5 años fue de 131 en Morona, 272 en Pastaza y 1189 en Bajo Urubamba. Para el cálculo muestral se utilizó el programa estadístico Epidat 3.1. Se consideró los siguientes parámetros: la prevalencia esperada en Morona y Pastaza de 27% y en Bajo Urubamba del 50%, con una precisión del 4% y un nivel de confianza del 95%. La muestra estimada fue de 103 para Morona; 173 para Pastaza, y 399 para Bajo Urubamba, por lo que se precisó incluir 675 niños. La muestra de niños procedía de 34 comunidades indígenas ubicadas a lo largo del río Pastaza, 11 en el río Morona y 32 en la cuenca del río Bajo Urubamba. Para cada comunidad se asignó un total de muestra proporcional a la población total respectiva. El muestreo fue sistemático con arranque aleatorio, utilizando una constante calculada entre el total de niños menores de cinco años en la comunidad y el número de muestra requerida.
Los criterios de inclusión fueron: ser niño menor de cinco años al momento de la visita, vacunado o no, y ser indígena por auto-reconocimiento del padre o la madre. Los criterios de exclusión fueron: tener enfermedades crónicas reportadas por el padre/madre; desnutrición severa, y no tener el consentimiento informado de los padres o del representante de la comunidad (jefe, apu o curaca).
Cada niño fue evaluado por el personal de campo que incluía un médico o una enfermera entrenada, un encuestador y un técnico de laboratorio. De cada niño se obtuvo una muestra de sangre (5 mL). Los sueros fueron separados en cada comunidad y almacenados en termos con bloques de hielo hasta, máximo, una semana, luego fueron congeladas a -20 ºC y enviadas a Lima al Laboratorio de Hepatitis del Centro Nacional de Salud Pública (CNSP) del Instituto Nacional de Salud (INS) del Perú. Las actividades en la cuenca del Bajo Urubamba se realizaron entre julio y septiembre del año 2008, y en las cuencas Morona y Pastaza, entre agosto y octubre del mismo año.
Así mismo se completó un cuestionario referido a datos demográficos y el esquema de vacunación para HVB que fue verificado con el carné de vacunación, si no se pudo verificar el estado de la vacunación se consideró como estado de inmunización desconocido. También se exploraron algunos factores asociados conocidos o probables para infección por hepatitis B (estilos de vida, mordedura de murciélago, entre otras), y sobre el hábito de alimentar a los niños pequeños con alimentos procesados con la boca y con bebidas como el masato, bebida hecha a base de yuca que usa la saliva para fermentación. Una vez finalizado el proceso de recolección de datos, se realizó el control de calidad de las muestras y fichas a nivel de microrred, red y a nivel central.
PRUEBAS DE LABORATORIO
Las muestras se procesaron primero para detectar anticuerpos totales contra el antígeno core del HVB (anti-HBc total), a aquellas muestras reactivas se les hizo ELISA para la detección del antígeno de superficie de HVB (HBsAg), a las no reactivas se les hizo ELISA para la detección y cuantificación de anticuerpos contra el antígeno de superficie de la hepatitis B (anti-HBs). Se usaron los siguientes kits comerciales Hepanostika anti HBc Uni-Form (Biomerieux), Hepanostika HBsAg Ultra (Biomerieux) y Bioelisa anti-HBs (Biokit), respectivamente.
Para establecer la seroprevalencia de infección se utilizó el resultado del anti-HBc total; se definió como “niños seroprotegidos”, a todos aquellos con resultado anti-HBc total no reactivo y anti-HBs reactivo definido por un título mayor o igual a 10 mUI/mL, los que tuvieron títulos menores a ese valor se definieron como indeterminados.
ANÁLISIS ESTADÍSTICO
Para el análisis epidemiológico se procedió a separar por pueblo indígena y a calcular la seroprevalencia de infección por HVB y la prevalencia de seroprotección contra HVB. Se realizó el análisis univariado y bivariado para buscar asociaciones entre los factores encontrados y la prevalencia de infección, empleando la prueba de chi cuadrado, se consideró como significativos los valores p<0,05. Los cálculos fueron realizados en el programa estadístico Stata 12.1
ASPECTOS ÉTICOS
El estudio fue aprobado por el comité de ética del INS; adicionalmente, se realizaron reuniones de consulta con los líderes indígenas a nivel nacional, regional y local. Se respetó la voluntad de los líderes de cada comunidad para el ingreso o no a cada comunidad. Todas las actividades de ingreso a la zona de estudio fueron coordinadas previamente por un antropólogo de campo quien se encargó de las autorizaciones y permisos con las organizaciones indígenas de la zona.
RESULTADOS
CARACTERÍSTICAS GENERALES DE LA POBLACIÓN
Se incluyeron 742 niños, cubriendo el tamaño de muestra calculado. Los participantes provenían de seis pueblos indígenas distribuidos de la siguiente manera: 208 de la cuenca del Pastaza, todos del pueblo indígena candoshi; en la cuenca del Morona 136, todos shapras, y 398 niños provenientes de la cuenca del Bajo Urubamba, 243 (79,1%) machiguenga, 63 (8,5%) yine, 48 (6,5%) asháninka y 44 (5,9%) nanti.
Del total, 380 (51,2%) niños fueron de sexo masculino y 169 (22,8%) tuvieron un año o menos. Solo 131 (18,7%) nacieron en algún establecimiento de salud. La frecuencia de alimentar a los niños pequeños con alimentos procesados con la boca fue mayor al 90% entre los candoshi, shapra y nantis (Tabla 1).
Respecto a la vacunación, 434 (58,5%) cuentan con registro de tres dosis para HVB en su carné de vacunación, y en 154 (20,7%) no se pudo precisar pues no contaban con el carné de vacunación. Entre los candoshi y shapra el cumplimiento de tres dosis fue superior al 75% mientras que en los nantis esta cifra fue del 0%. En 208 (38,8%) de los niños, la primera dosis recibida fue dentro de las primeras 24 h; los menores provenientes del pueblo yine tenían los porcentajes más bajos de cobertura inmediata, con un 24%.
PREVALENCIA DE MARCADORES PARA HVB
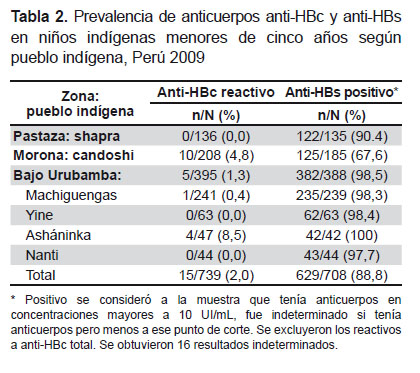
No se detectaron casos de HBsAg en ninguno de los niños evaluados. Tres muestras se hemolizaron durante el transporte. Entre los 739 niños restantes, en 15 se encontró el marcador anti-HBc, por lo que la prevalencia de infección pasada fue de 2,0% (IC 95%, 1,0-3,0), mientras que la presencia de anticuerpos anti-HBs que representa inmunidad contra el HVB, fue de 88,8% (IC 95%: 86,5-91,2). La distribución de los marcadores anti-HBc y anti-HBs entre los niños de los diferentes pueblos indígenas se observa en la Tabla 2.
La seroconversión no fue homogénea según el número de dosis recibidas. En total, el 85,3% que recibió tres dosis había seroconvertido; el 96,6% que recibió dos dosis; el 90,9% que recibió solo una dosis y entre aquellos en quienes no se pudo verificar el número de dosis recibidas, el 92,7% había seroconvertido. Estas prevalencias de seroconversión no fueron homogéneas entre las poblaciones evaluadas, registrando casos de 100% de seroconversión a cualquier dosis en los niños asháninka y nanti (Tabla 3).
FACTORES ASOCIADOS A anti-HBc REACTIVO
Los quince niños reactivos tuvieron el antecedente de haber recibido tres dosis de vacunas, pero solo dos habían cumplido con recibir la primera dosis dentro de las veinticuatro horas de nacidos. Ningún factor evaluado estuvo estadísticamente asociado a una mayor probabilidad de presentar anti-HBc reactivo.
DISCUSIÓN
La infección por HVB ha puesto en riesgo de extinción a varias poblaciones indígenas amazónicas, tal como ha sucedido en los pueblos de los candoshi y shapra, pueblos donde la vacunación para prevenir la HVB ha sido priorizada (9). A nivel mundial se han realizado campañas similares en áreas de alta endemicidad con logros importantes en cortos periodos, como en Taiwán, que en 15 años han reducido la prevalencia de HBsAg de un 10% en 1984 a un 1% en 1999 (12); o en Afragola al sur de Italia, donde redujeron de 13% en 1978 a 1% en 2006 (13). En las poblaciones estudiadas, solo en 1996 se describió un escenario de alta endemicidad con un 9,4% de portadores de HBsAg, mientras que en este estudio no se encontraron casos de portadores del HBsAg, y aunque es posible que existan casos agudos de infección por HVB, la proporción es mucho menor al escenario anteriormente descrito y demuestra el éxito de las intervenciones realizadas (6).
En contraste con este escenario, la cobertura obtenida a través de la revisión del carné de vacunación contra HVB es baja, más de un 15% de niños no habría recibido ninguna dosis, y menos del 60% ha recibido las tres dosis. Un problema frecuente cuando se emplea esta metodología es la pérdida del carné de vacunación en las familias, particularmente en zonas rurales; por lo que una alternativa es la determinación de marcadores serológicos. En este caso, anticuerpos anti-HBs, que nos da una idea más cercana a la protección contra la infección, dado que se consideran valores por encima de 10 UI/Ml; esto explicaría esta aparente discordancia entre las coberturas vistas mediante los carné frente a la real presencia de anticuerpos protectores. Un hallazgo similar se encontró en un estudio de seroprotección contra sarampión, rubéola y hepatitis B en niños en el Perú, por lo que la cobertura de vacunación podría estar subregistrada, según la metodología utilizada para su evaluación (14).
En todo caso, la cobertura registrada para el HVB es menor a la descrita para Lima, que ha superado desde el año 2004 el 80% y para 2006 superaba el 95% (12), en el mundo, la cobertura global se estima en 79% (15), y existen países donde la cobertura supera el 90%, en especial en menores de 1 año (16). En cambio, la baja cobertura que describimos es similar a la reportada en otras poblaciones indígenas o migrantes, como en México, donde debido a factores como la escolaridad materna, el acceso a los servicios de salud o el elevado número de niños en el hogar, condicionaron que la cobertura sea menor del 50% (17). En otros contextos rurales peruanos, donde el programa ampliado de inmunizaciones ha tenido una mayor vigilancia, el porcentaje de niños menores de 1 año con las tres dosis ha llegado al 98% (18).
La seroconversión es alta, con un promedio del 89%. Esto se da de forma independiente del número de dosis recibidas según el carné de vacunación. Ello contrasta con otros estudios, donde se indica la necesidad de las tres dosis para que la seroconversión sea superior al 90% (19). En ese sentido, se ha recomendado que la primera dosis sea recibida en el primer mes, pues el porcentaje de seroconversión será mayor (18). En este estudio, en las zonas de Pastaza y Morona, el 65% recibió su primera dosis en las primeras 24 h, lo que puede explicar el alto porcentaje de seroconversión. Además, en los menores que han recibido solamente dos dosis, el alto porcentaje de seroconversión es consistente con otros estudios donde indican que la protección con dos dosis en comparación con tres dosis puede ser similar tanto en vacunas habitualmente utilizadas (20) como en otras en la que utilizan inmunoestimuladores (21). También se puede explicar que en los niños que han recibido una o dos dosis, el hecho de vivir en contacto con portadores crónicos de HBsAg en las familias (adultos) podrían tener un efecto similar a un booster de vacuna, dado que esta es compuesta por HBsAg.
El estudio tiene limitaciones. No se realizó un diseño para cada pueblo indígena en particular, o buscando establecer asociaciones específicas con los factores de riesgo, por lo que el poder estadístico es pequeño en algunos casos y en otros, los intervalos de confianza son amplios. Ello puede dar la impresión, por ejemplo, que exista una mayor seroconversión en aquellos que recibieron una dosis sobre los que recibieron dos dosis, sin embargo, los intervalos de confianza se superponen lo que nos indicaría que no existen diferencias reales y solo se debió a un aspecto estadístico.
En conclusión, no se detectaron casos de infección crónica para HVB en la población evaluada. Se ha identificado una baja cobertura de vacunación contra HVB en las poblaciones indígenas, cuando se evalúa mediante el carné de vacunación, lo cual contrasta con los niveles de seroprotección, no encontrándose portadores crónicos en este estudio en comparación con los niveles del año 1996, debiéndose esta variación a las intervenciones mediante vacunación sucedidas entre ambas evaluaciones.
Contribuciones de autoría: todos los autores participaron en la concepción de la investigación, la redacción del manuscrito y la aprobación de su versión final. CCS y OMT obtuvieron el financiamiento y realizaron el análisis de datos.
Fuente de financiamiento: fondo Instituto Nacional de Salud, Centro Nacional de Salud Pública y Centro Nacional de Salud Intercultural.
Conflictos de interés: los autores declaran no tener conflictos de interés.
Referencias Bibliográficas
1. Organización Mundial de la Salud. Hepatitis B [Internet]. Ginebra: OMS; 2012 [citado el 25 de noviembre del 2013]. Disponible en: https://www.google.com.pe/search?q=oms&rlz=1C1LENP_esPE514PE514&oq=oms&aqs=chrome..69i57j69i59j0l4.847j0j8&sourceid=chrome&es_sm=93&ie=UTF-8
2. Tanaka J. Hepatitis B epidemiology in Latin America. Vaccine. 2000 Feb 18;18 Suppl 1:S17-9.
3. Idrovo V, Suárez CY, Álvarez P. Epidemiología e historia natural de la hepatitis B. Rev Col Gastroenterol. 2009;24:4s-12s.
4. Blitz-Dorfman L, Monsalve F, Atencio R, Porto L, Monzon M, Favorov MO, et al. Serological survey of markers of infection with viral hepatitis among the Yukpa Amerindians from western Venezuela. Ann Trop Med Parasitol. 1996 Dec;90(6):655-7
5. León P, Venegas E, Bengoechea L, Rojas E, López JA, Elola C, et al. Prevalencia de las infecciones por virus de las hepatitis B, C, D y E en Bolivia. Rev Panam Salud Pública. 1999 Mar;5(3):144-51.
6. Cabezas C, Suárez M, Romero G, Carrillo C, García M, Reátegui J, et al. Hiperendemicidad de Hepatitis viral B y Delta en pueblos indìgenas de la Amazonía Peruana. Rev Peru Med Exp Salud Publica. 2006;23(2):114-22.
7. Fondo de las Naciones Unidas para la Infancia. Kandozi y Shapra frente a la hepatitis B. El retorno de lo visible. Lima: UNICEF; 2005.
8. Minnick MF, Wilson ZR, Smitherman LS, Samuels DS. gyrA mutations in ciprofloxacin-resistant Bartonella bacilliformis strains obtained in vitro. Antimicrob Agents Chemother. 2003 Jan;47(1):383-6.
9. Rots NY, Wijmenga-Monsuur AJ, Luytjes W, Kaaijk P, de Graaf TW, van der Zeijst BA, et al. Hepatitis B vaccination strategies tailored to different endemicity levels: some considerations. Vaccine. 2010 Jan 22;28(4):893-900. doi: 10.1016/j.vaccine.2009.10.125.
10. Perú, Ministerio de Salud. La hepatitis B en el Perú [Internet]. Lima: MINSA; c2014 [citado el 25 de noviembre del 2013]. Disponible en: http://www.minsa.gob.pe/redtupacamaru/hepatitisb/informacion/hepatistisb_peru.html
11. Fondo de las Naciones Unidas para la Infancia. Informe 2010 Perú. Lima: UNICEF; 2010.
12. Ni YH, Chang MH, Huang LM, Chen HL, Hsu HY, Chiu TY, et al. Hepatitis B virus infection in children and adolescents in a hyperendemic area: 15 years after mass hepatitis B vaccination. Ann Intern Med. 2001 Nov 6;135(9):796-800.
13. Da Villa G, Romano L, Sepe A, Iorio R, Paribello N, Zappa A, et al. Impact of hepatitis B vaccination in a highly endemic area of south Italy and long-term duration of anti-HBs antibody in two cohorts of vaccinated individuals. Vaccine. 2007 Apr 20;25(16):3133-6.
14. Fiestas Solórzano V, Gonzáles Noriega M, Fiestas F, Cabezudo E, Suárez M, Suárez V. Evaluación de la seroprotección contra sarampión, rubéola y hepatitis B en niños menores de cinco años del Perú, 2011. Rev Peru Med Exp Salud Publica. 2012 Oct-Dec;29(4):437-43.
15. Organización Mundial de la Salud. Cobertura vacunal: Hepatitis B. Ginebra: OMS; 2013 [citado el 12 de diciembre de 2013]. Disponible en: http://www.who.int/mediacentre/factsheets/fs378/es/
16. Vildozola H. Vacunación contra Hepatitis B: veinte años Después. Rev Gastroenterol Peru. 2007 Ene-Mar;27(1):47-56.
17. Bárcenas-López RM, Curiel-Reyes R, Caballero-Hoyos R, Villaseñor Sierra A. Baja cobertura de vacunación en niños y niñas migrantes indígenas. Salud Publica Mex. 2012 Jul-Aug;54(4):361-2.
18. Cabezas C, Ramos F, Vega M, Suárez M, Romero G, Carrillo C, et al. Impacto del programa de vacunación contra hepatitis víral B (HVB) íntegrado al programa amplíado de ínmunizacíones (PAI) en Huanta (Perú) 1994 - 1997. Rev Gastroenterol Peru. 2000 Jul-Sep;20(3):201-12.
19. Zunino E. Epidemiología de la hepatitis B en Chile y esquemas de vacunación en Latinoamérica. Rev Chil Infectol. 2002;19(3):140-55.
20. Van der Sande MA, Mendy M, Waight P, Doherty C, McConkey SJ, Hall AJ, et al. Similar long-term vaccine efficacy of two versus three doses of HBV vaccine in early life. Vaccine. 2007 Feb 9;25(8):1509-12.
21. Halperin SA, McNeil S, Langley JM, Smith B, MacKinnon-Cameron D, McCall-Sani R, et al. Safety and immunogenicity of different two-dose regimens of an investigational hepatitis B vaccine (hepatitis B surface antigen co-administered with an immunostimulatory phosphorothioate oligodeoxyribonucleotide) in healthy young adults. Vaccine. 2012 Aug 3;30(36):5445-8. doi: 10.1016/j.vaccine.2012.05.074
Correspondencia:: Omar Trujillo Villarroel
Dirección: Av. Defensores del Morro 2268 – Chorrillos - Limaa
Correo electrónico: otrujillo@ins.gob.pe
Recibido: 03-03-14
Aprobado: 23-04-14