REPORTE DE CASO
Infección diseminada por Bacilo Calmette-Guérin en un lactante con inmunodeficiencia: reporte de caso
Disseminated infection by Bacillus Calmette-Guerin in an immunodeficient infant: case report
Consuelo Apagüeño-Ruiz1,a, Johanna Peceros-Escalante1,b, Reynaldo Pomar-Morante1,b, Betty Véliz-Lazo1,c, Rosalía Ballona-Chambergo1,b
1 Instituto Nacional de Salud del Niño, Breña, Lima, Perú.
a Médico residente en Dermatología Pediátrica; b médico especialista en Dermatología Pediátrica; c médico especialista en Anatomía Patológica.
RESUMEN
La vacuna Bacillus Calmette-Guerin (BCG) que se administra a los recién nacidos de países con alta incidencia de tuberculosis puede ocasionar reacciones locales hasta infección diseminada en pacientes inmunocomprometidos. Reportamos el caso de un lactante varón de seis meses con antecedente de haber recibido vacuna BCG al nacer, y presentar cuadros infecciosos a repetición, nódulos violáceos blandos en tronco y extremidades con presencia de bacilos ácido alcohol resistentes (BARR) en la histopatología y en cultivo de piel; el estudio molecular reportó la presencia de Micobacterium bovis BCG. En la tomografía se observó opacidades intersticiales en pulmones y en el lavado gástrico se identificó BAAR. El estudio genético del paciente y de la madre reveló la presencia de mutación en el gen IL2RG confirmando el diagnóstico de inmunodeficiencia combinada severa, recibe tratamiento con inmunoglubolina humana y esquema antituberculosis con isoniacida, rifampicina y etambutol. Presentamos el caso por la implicancia en el pronóstico de vida de estos pacientes y por la necesidad de un diagnóstico preciso y oportuno.
Palabras claves: Vacuna BCG; Inmunodeficiencia combinada severa; Tuberculosis cutánea; Mycobacterium bovis (fuente: DeCS BIREME).
ABSTRACT
The Bacillus Calmette-Guerin (BCG) vaccine given to newborns in countries with a high incidence of tuberculosis may cause local reactions up to disseminated infection in immunocompromised patients. We report the case of a six-month-old male infant with a history of having received the BCG vaccine at birth, and presenting repeated infectious, soft violet nodules in the trunk and extremities with the presence of acid-alcohol-resistant bacilli (BAAR) in histopathology and skin culture; the molecular study reported the presence of Mycobacterium bovis BCG. In the tomography, interstitial opacities were observed in the lungs and in the gastric lavage BAAR was identified. The genetic study of the patient and the mother revealed the presence of a mutation in the IL2RG gene confirming the diagnosis of severe combined immunodeficiency. Received treatment with human immunoglobulin and anti-tuberculosis scheme with isoniazid, rifampicin, and ethambutol. We present the case because of the implication in the life prognosis of these patients and because of the need for an accurate and timely diagnosis.
Keywords: BCG vaccine; Severe combined immunodeficiency; Cutaneous tuberculosis; Mycobacterium bovis (source: MeSH NLM).
INTRODUCCIÓN
La tuberculosis (TB) se encuentra entre las diez principales causas de muerte en el mundo, 1,7 mil millones de personas tienen enfermedad latente, 10 millones desarrollan enfermedad activa y 1,3 millones fallecen (1). En los países con alta incidencia de TB, la Organización Mundial de la Salud recomienda la aplicación de la vacuna de Bacillus Calmette-Guerin (BCG) a todos los recién nacidos con la finalidad de prevenir formas severas de TB (miliar y meningitis) (2). El Perú es un país con una alta incidencia de TB (116 casos por 100 000 habitantes), razón por la cual, está indicada la vacuna (1,3).
La vacuna BCG tiene una alta cobertura mundial (90%), contiene bacterias vivas atenuadas derivadas de una cepa de Micobacterium bovis, puede ocasionar efectos secundarios como reacciones locales hasta infección diseminada en pacientes inmunocomprometidos por inmunodeficiencias primarias (IDP) o por infección por VIH (1,2). La incidencia de efectos adversos tras la vacunación se estima de 2 a 34 casos por millón de vacunados (2). Las IDP son desórdenes genéticos que predisponen a los individuos a infecciones severas, y su prevalencia varía de 83 743 a 6 000 000 de casos (4). La inmunodeficiencia combinada severa (SCID, siglas en inglés Severe combined immunodeficiency) es la IDP más grave (5).
En Perú no existen reportes sobre esta complicación. Presentamos el caso de un lactante varón de seis meses, con inmunodeficiencia combinada severa, que recibió vacuna BCG al nacer y que presentó infección diseminada por este bacilo con compromiso cutáneo y respiratorio.
REPORTE DEL CASO
Lactante varón de seis meses de edad, natural y procedente de Lima, producto de tercera gestación con más de seis controles prenatales hospitalarios, sin intercurrencias durante el embarazo. Parto eutócico a término, alta conjunta al tercer día, lactancia materna exclusiva hasta los tres meses, mixta a los cuatro y ablactancia a los cinco meses; inmunizaciones hasta los cuatro meses. Presentó disentería a los tres meses tratado con amikacina por tres días, faringitis a los cuatro meses tratado con amoxicilina por siete días, infección urinaria a los cinco meses tratado con cefalexina por siete días. Padre y madre de 32 años sanos, primer hermano materno fallecido a los cuatro meses por neumonía, y un hermano de dos años con parálisis cerebral infantil. Vivienda de material noble con servicios completos, su madre niega contacto con personas con TB.
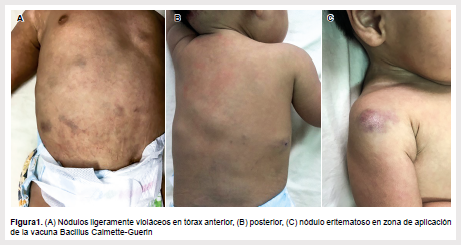
Dos semanas antes del ingreso, presentó dos tumoraciones violáceas en la región costal derecha, además de hiporexia e irritabilidad, inicialmente se le indicó diclofenaco en gel tópico, sin embargo, se presentaron nuevas lesiones en tronco y extremidades. El día de ingreso a emergencia presentó compromiso del estado general, al examen físico se observó múltiples nódulos ligeramente violáceos de 0,5 cm a 2 cm de diámetro, blandos, no dolorosos, localizados en hombro derecho, tórax, abdomen y extremidades, y adenopatías inguinales de 5 mm de diámetro (Figura 1).
En los estudios de laboratorio se encontró los siguientes valores: hemoglobina 13,1 g/dl, plaquetas 781 000/mm3, leucocitos 12 890/mm3 (linfocitos: 902/mm3), Proteína C Reactiva (PCR) 16,25 mg/dl, TGO 47 U/L, TGP 115 U/L, proteínas totales 5,8 g/ dl, albúmina 3,8 g/dl, globulinas 2 g/dl, inmunoglobulinas séricas: IgA 0 mg/dl, IgG 79 mg/dl, IgM 109 mg/dl, IgE <1 mg/dl, citometría de flujo de sangre periférica con recuento linfocitario severamente disminuido, la tinción Ziehl Nielsen de lavado gástrico mostró bacilos ácido alcohol resistentes (BAAR) con aislamiento del complejo de Micobacterium tuberculosis en medios especiales para micobacterias. La prueba cutánea de derivado proteico purificado (PPD) fue de 0 cm. La tomografía mostró múltiples nódulos y opacidad intersticial en pulmones.
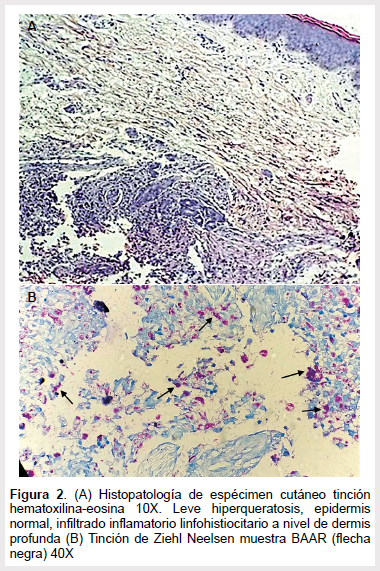
La biopsia cutánea evidenció hiperqueratosis con atrofia epidérmica, infiltrado linfohistiocitario en dermis y BAAR en la tinción de Ziehl Nielsen (Figura 2), el cultivo del espécimen cutáneo en elsistema automatizado BACTEC MGIT informó crecimiento de BAAR, la identificación del aislado mediante la técnica de PCR-hibridación GENOTYPE CM reportó Micobacterium bovis BCG. El estudio genético del paciente y de la madre reveló la presencia de mutación en el gen IL2RG, compatible con SCID. La presencia de BAAR en las lesiones cutáneas y en el lavado gástrico, la identificación del Micobacterium bovis BCG en este paciente con inmunodeficiencia confirman el diagnóstico de infección diseminada.
En hospitalización recibió una dosis de inmunoglobulina humana e inició tratamiento antituberculoso con isoniacida, rifampicina y etambutol, además de una evaluación para trasplante de progenitores hematopoyéticos para la inmunodeficiencia de base. Posterior al alta, el paciente continuó con tratamiento antituberculoso en Huancavelica y luego de tres meses presentó resolución de las lesiones cutáneas. El paciente no regreso a sus controles y se perdió contacto con la madre.
DISCUSIÓN
La vacuna BCG se aplica por inyección intradérmica, el 95% de los vacunados desarrollaran una reacción normal en el sitio de inyección con formación de una pápula que puede ulcerarse y al curar, después de dos a cinco meses, deja cicatriz; sin embargo, puede presentar efectos adversos dependientes de la cepa de la vacuna, carga bacilar, método de administración y estado inmune del huésped (2,6). Existen más de diez cepas de vacuna BCG con diferente perfil de reactogenicidad, las de Pasteur, Tokio y Copenhagen son las que más efectos adversos inducen (2,7). En Perú se aplica la vacuna BCG cepa Pasteur (3).
Los efectos adversos tras la vacunación pueden ocasionar desde reacciones locales severas hasta enfermedad diseminada de acuerdo al estado inmunológico (2). Estas reacciones se clasifican como enfermedad por BCG local, regional, a distancia y diseminada; denominando BCGitis a aquellas con afección local, regional y BCGosis cuando se extiende a distancia o diseminada (6,8). La infección diseminada suele ocurrir dentro del primer año de vacunación, se manifiesta con síntomas sistémicos como fiebre, pérdida de peso, al menos dos áreas de compromiso más allá del sitio de vacunación y la identificación de Micobacterium bovis BCG ya sea por cultivo, PCR o histopatología (7,8). Nuestro paciente presentaba compromiso cutáneo y respiratorio por lo que fue catalogado como infección diseminada.
La tuberculosis cutánea es un tipo de TB extrapulmonar, se presenta en el uno a dos por ciento de los casos; existen varias formas de clasificación, la más usada se basa en el mecanismo de inoculación; la enfermedad por BCG distante y diseminada es considerada como un tipo de TB cutánea secundaria a la administración de la vacuna BCG (9). Las lesiones cutáneas en la infección diseminada son inespecíficas, se pueden manifestar con pápulas, nódulos, placas eritematosas localizadas en extremidades, área lumbosacra y glúteos (10). El diagnóstico se realiza por identificación del bacilo en la histopatología o en cultivo, y para el tipaje de las cepas se puede hacer estudio molecular (11,12). En este caso el diagnóstico se hizo por histopatología cutánea con identificación de BARR, el cultivo informó crecimiento de BAAR, el cual reveló la presencia de Micobacterium bovis BCG.
El 62,5% de los pacientes con infección diseminada tienen IDP, y una de las más frecuentes es la SCID, esta ocurre en el 50% de casos por mutación del gen IL2RG, lo que ocasiona la ausencia o disfunción de los linfocitos; clínicamente los pacientes cursan con infecciones recurrentes y severas por cualquier tipo de microorganismo incluidos gérmenes oportunistas y agentes vacunales, que exponen a los pacientes a diarrea crónica, neumonías y sepsis. En estos pacientes está contraindicado la aplicación de vacunas con gérmenes vivos, como BCG; son niños que después de iniciar con infecciones tienen detención de peso y talla, estas características se presentaron en el lactante durante sus primeros meses de vida y según las tablas de crecimiento tenía desnutrición global (5,8,13).
Existen pruebas de diagnóstico prenatal y neonatal como la cuantificación basada en la reacción en cadena de la polimerasa de los círculos de escisión del receptor de células T, pero la historia clínica es el elemento más importante para sospechar de una inmunodeficiencia primaria, los antecedentes familiares de muertes en la infancia, enfermedades autoinmunes, varones afectados o de consanguinidad nos orientan a una herencia ligada al cromosoma X o autosómica recesiva. Por ello es necesario hacer una anamnesis minuciosa de la historia familiar cuando la gestante acude a los controles prenatales, de esa forma se podría sospechar la existencia de riesgo en el feto y por tanto evitar la aplicación de la vacuna al nacer (5).
En nuestro caso, el estudio genético confirmó el diagnóstico de inmunodeficiencia combinada severa en el paciente y su madre; probablemente el primer hermano que falleció a edad temprana por neumonía pudo haber tenido esta inmunodeficiencia.
El trasplante de células hematopoyéticas y la terapia génica parecen ser las únicas opciones curativas de la inmunodeficiencia combinada severa, el paciente recibió tratamiento con isoniacida, rifampicina y etambutol debido a que el Micobacterim bovis BCG es sensible a estos fármacos, el tiempo aproximado de tratamiento es de un año (14). La mortalidad ocurre aproximadamente en el 60% de los casos (15). Lamentablemente se desconoce la evolución de la enfermedad en este paciente ya que se perdió contacto con la madre.
Debido a su alta incidencia, la TB es considerado un problema de salud pública en el Perú, por lo que la aplicación de la vacuna BCG es habitual a todo recién nacido (1–3). Es necesario conocer los efectos secundarios que se presentan tras su administración, especialmente en aquellos pacientes con algún tipo de inmunodeficiencia, es importante realizar un diagnóstico temprano y en caso de haberla recibido indicar profilaxis para evitar la diseminación. El trasplante de células hematopoyéticas es una posibilidad de tratamiento para la inmunodeficiencia, la cual actualmente se viene realizando en Perú.
Consideraciones éticas: Se cuenta con la autorización de los padres para la presentación del caso, además las autoridades del hospital otorgaron los permisos para su publicación.
Contribuciones de autorías: CAR, JPE, RPM, participaron en la concepción, diseño y redacción del artículo; RBC realizó la revisión crítica del artículo y aprobación de la versión final. BVL facilitó el aporte de las imágenes de la patología.
Fuente de Financiamiento: Autofinanciado
Conflicto de Intereses: Los autores declaran no tener conflicto de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. World Health Organization. Global tuberculosis report 2018 [Internet]. Geneva:WHO; 2018. [citado el 15 de diciembre de 2018]. Disponible en: http://www.who.int/tb/publications/global_report/en/.
2. World Health Organization | Weekly Epidemiological Record (WER), 23 February 2018, vol. 93, 08 (pp. 73–96) [Internet]. Geneva: WHO; 2018 [citado el 15 de diciembre de 2018]. Disponible en: http://www.who.int/wer/2018/wer9308/en/.
3. Ministerio de Salud. Resolución Ministerial N° 719-2018/MINSA [Internet]. [citado el 15 de diciembre de 2018]. Lima: MINSA; 2018. Disponible en: https://www.gob.pe/institucion/minsa/normas-legales/178240-719-2018-minsa.
4. Glanzmann B, Uren C, de Villiers N, van Coller A, Glashoff RH, Urban M, et al. Primary immunodeficiency diseases in a tuberculosis endemic region: challenges and opportunities. Genes Immun. doi: 10.1038/s41435-018-0041-0. [Epub ahead of print].
5. Hernández-Blas MG, Orozco-Martínez S, Contreras-Verduzco A, Medina-Torres EA, Espinosa-Padilla S. ¿Cuándo sospechar de la inmunodeficiencia combinada grave en niños? Alerg Asma Inmunol Pediatr 2014; 23(1):20-6.
6. Hesseling AC, Rabie H, Marais BJ, Manders M, Lips M, Schaaf HS, et al. Bacille Calmette-Guérin Vaccine–Induced Disease in HIV-Infected and HIV-Uninfected Children. Clin Infect Dis. 2006;42(4):548-58. doi: 10.1086/499953.
7. Bernatowska E, Wolska-Kuœnierz B, Pac G, Kurenko-Deptuch M, Pietrucha B, Zwolska Z, et al. Risk of BCG infection in primary immunodeficiency children. Proposal of diagnostic, prophylactic and therapeutic guidelines for disseminated BCG based on experience in the Department of Immunology, Children’s Memorial Health Institute in Warsaw between 1980-2006. Centr Eur J Immunol. 2007; 32(4):221-5.
8. Ying W, Sun J, Liu D, Hui X, Yu Y, Wang J, et al. Clinical Characteristics and Immunogenetics of BCGosis/BCGitis in Chinese Children: A 6 Year Follow-Up Study. PLoS One. 2014;9(4):e94485. doi: 10.1371/journal.pone.0094485.
9. Santos JB, Figueiredo AR, Ferraz CE, Oliveira MH, Silva PG, de Medeiros VL. Cutaneous tuberculosis: epidemiologic, etiopathogenic and clinical aspects - Part I. An Bras Dermatol. 2014;89(2):219-28.
10. Al-Mousa H. An infant with disseminated bacillus Calmette-Guerin infection (BCGitis). Int J Pediatr Adolesc Med. 2014;1(2):89–92. doi: 10.1016/j.ijpam.2014.11.005
11. Al-Hammadi S, Alsuwaidi AR, Alshamsi ET, Ghatasheh GA, Souid A-K. Disseminated Bacillus Calmette-Guérin (BCG) infections in infants with immunodeficiency. BMC Res Notes. 2017;10(1):177. doi: 10.1186/s13104-017-2499-7.
12. Dias MF, Bernardes Filho F, Quaresma MV, Nascimento LV, Nery JA, Azulay DR. Update on cutaneous tuberculosis. An Bras Dermatol. 2014;89(6):925-38.
13. Cirillo E, Giardino G, Gallo V, D’Assante R, Grasso F, Romano R, et al. Severe combined immunodeficiency-an update: Severe combined immunodeficiencies. Ann N Y Acad Sci. 2015;1356(1):90-106.
14. Casanova J-L, Jouanguy E, Lamhamedi S, Blanche S, Fischer A. Immunological conditions of children with BCG disseminated infection. Lancet. 1995;346(8974):581.
15. Bernatowska EA, Wolska-Kusnierz B, Pac M, Kurenko-Deptuch M, Zwolska Z, Casanova J-L, et al. Disseminated Bacillus Calmette-Guérin Infection and Immunodeficiency. Emerg Infect Dis. 2007;13(5):799-801.
Correspondencia: Consuelo de Jesús Apagüeño Ruiz
Dirección: Avenida La Merced 858 dpto 501 Surco, Lima, Perú
Teléfono: (511) 943067224
Correo electrónico:
consuelodejesus111@hotmail.com
Recibido: 12/05/2018