REPORTE DE CASO
Peste septicémica rápidamente fatal secundaria a peste bubónica primaria inicialmente no diagnosticada: reporte de caso
Rapidly fatal septicemic plague secondary to undiagnosed primary bubonic plague: case report
Edinson Dante Meregildo-Rodriguez1,a, Miguel Villegas-Chiroque2,b
1 Servicio de Medicina Interna, Hospital Regional Lambayeque, Chiclayo. Lambayeque, Perú.
2 Servicio de Infectologia, Hospital Regional Lambayeque, Chiclayo. Lambayeque, Perú.
a Médico internista, maestro en Medicina; b médico infectólogo, doctor en Medicina.
RESUMEN
La peste es una enfermedad reemergente causada por Yersinia pestis. Los humanos generalmente adquieren la enfermedad por picaduras de pulgas. La peste es una enfermedad sistémica fulminante, siendo la peste neumónica la forma más letal. El diagnóstico tardío es una de las principales causas de mortalidad y diseminación de la enfermedad, dado que limita la efectividad de las medidas de control. Presentamos el caso de un varón de 42 años, que previamente había viajado a una zona endémica de peste, y luego presentó hiperpirexia, hipotensión, y adenopatía inguinal inflamatoria. A pesar del cuadro clínico muy característico, nadie (antes del ingreso a nuestro hospital) sospechó peste. Se inició una combinación antibiótica efectiva y tratamiento intensivo recién al quinto día de enfermedad. El paciente evolucionó con shock séptico, falla respiratoria, y muerte. Se confirmó peste por reacción en cadena de polimerasa (PCR). Este caso enfatiza la importancia de tener un alto índice de sospecha para peste.
Palabras clave: Peste; Peste bubónica; Peste septicémica; Yersinia pestis; Sepsis (fuente: DeCS BIREME).
ABSTRACT
Plague is a re-emerging disease caused by the bacteria Yersinia pestis. Humans usually get the disease through the bite of an infected flea. Plague is a fulminant systemic disease, with pneumonic plague being the most lethal form. Late diagnosis is one of the main causes of mortality and spread of the disease, as it limits the effectiveness of control measures. We present the case of a 42-year-old male, who had previously traveled to an endemic plague area and then presented hyperpyrexia, hypotension, and inflammatory inguinal adenopathy. Despite the very characteristic clinical picture, nobody (before admission to our hospital) suspected plague. An effective combination of antibiotics and intensive treatment was initiated only on the fifth day of illness. The patient went into septic shock, respiratory failure, and death. Plague was confirmed by polymerase chain reaction (PCR). This case emphasizes the importance of having a high suspicion rate for plague.
Keywords: Plague; Bubonic plague; Septicemic plague; Yersinia pestis; Sepsis (source: MeSH NLM).
INTRODUCCIÓN
La peste es una zoonosis grave causada por Yersinia pestis (Y. pestis) y transmitida por pulgas de roedores domésticos y silvestres. El hombre es un huésped incidental que adquiere la infección por picadura de pulgas, arañazos o mordedura de animales, manipulación de tejidos animales, consumo de comida contaminada o exposición de laboratorio. La enfermedad se presenta con tres síndromes clínicos: peste bubónica (80%-95%), septicémica (10%-20%) y neumónica (2%-5%) (1-4). La peste se asocia con gran infectividad, rápida diseminación y alta mortalidad, siendo su período de incubación de 2-8 días. La peste bubónica se inicia súbitamente con fiebre, escalofríos, cefalea y tumefacción ganglionar dolorosa; más del 50% de casos no tratados, evolucionan a sepsis y shock séptico; y entre el 5%-15% de pacientes con peste bubónica y septicémica desarrollan secundariamente compromiso pulmonar (peste neumónica secundaria). Sin tratamiento, la letalidad de la peste bubónica es del 50%-60%, mientras que la de la peste septicémica y neumónica es cercana al 100% (5-8). El diagnóstico y tratamiento precoz y apropiado reduce la mortalidad por peste bubónica y septicémica a 5%-15% (3).
El Perú reporta casos desde 1903 cuando la epidemia ingresó por el Callao y otros puertos del litoral peruano, se diseminó por la costa, y años después se trasladó y localizó en los valles interandinos del norte del país (Cajamarca, Lambayeque, Piura y La Libertad). Desde entonces, la enfermedad es endémica en el país con picos de mayor incidencia durante los meses del fenómeno de El Niño (9). Durante las últimas décadas, se han descrito varios brotes de peste, todos en la región La Libertad: el de 1994 con 1104 casos y 35 fallecidos, el del 2009, y el del 2010 con 4 casos de peste neumónica primaria (9,10). Lambayeque es la segunda región del país que aporta casos de peste, y registra casos esporádicos y roedores infectados en los distritos de Cañaris, Inkahuasi, Salas, Mórrope y Oyotún (11).
Presentamos un caso de peste grave atendido en el Hospital Regional Lambayeque (HRL) con período de incubación muy corto que evolucionó rápidamente de la forma bubónica a la septicémica, debido al retraso diagnóstico y terapéutico, y que finalmente tuvo desenlace fatal. La finalidad del reporte es alertar a los profesionales de la salud a considerar el diagnóstico diferencial de esta enfermedad endémica que sin terapia adecuada es altamente letal. Desde el punto de vista de salud pública, la evolución de este caso resulta aleccionador por dos razones: primero, porque es preocupante que aún en pleno siglo XXI, muchos médicos no sospechen esta zoonosis; y segundo porque las autoridades de salud deberían proveer las herramientas diagnósticas y terapéuticas que aseguren la atención apropiada de estos pacientes.
REPORTE DE CASO
INFORMACIÓN DEL PACIENTE
Varón de 42 años, natural de Chimbote, residente en los Estados Unidos desde hace nueve años, casado, con dos hijos, antecedente de Enfermedad de Parkinson sin tratamiento. Regresó al Perú de vacaciones un mes antes de enfermar, y se instaló en la ciudad de Chiclayo. El 29 de junio del 2018 viaja a un recreo campestre en el distrito de Salas, aproximadamente a 80 Km al noreste de la provincia de Chiclayo, región Lambayeque; pernoctan allí y retornan al día siguiente. No precisa exposición a pulgas o roedores, consumo de alimentos poco cocidos o bebidas locales. Asimismo, niega exposición a sesiones de curanderismo, exposición a bebidas, sustancias, o animales utilizado para tal fin. El 1 de julio de 2018, por la noche, presenta fiebre, escalofríos y malestar general, por lo que a la mañana siguiente acude a médico particular, quien diagnóstica faringitis aguda e indica antipiréticos. La fiebre y el malestar se intensifican y se le añade cefalea. El 4 de julio del 2018, las molestias persisten y se agrega tumefacción inguinal izquierda intensamente dolorosa. Acude a emergencia del HRL, donde es evaluado en triaje y se le indica acudir por consulta externa, por lo que se dirige a clínica privada donde es hospitalizado, y recibe tratamiento con ciprofloxacino endovenoso ante la sospecha de fiebre tifoidea. El 5 de julio del 2018, es referido al HRL por mala evolución clínica: dolor abdominal intenso, trastorno del sensorio, visión borrosa, anuria, disnea e hipotensión persistente. No presentó dolor torácico, tos, ni hemoptisis.
HALLAZGOS CLÍNICOS
Al ingreso, en el examen físico (12:00 h) encontramos un peso de 80 kg, una presión arterial de 60/40 mmHg, la frecuencia respiratoria en 40 por minuto, la frecuencia cardíaca en 120 por minuto, la temperatura de 39,8 °C, y con SatO2 de 95% (FiO2: 0,21).
A la ectoscopia, el paciente se veía en mal estado general, con facies tóxica, deshidratado e intranquilo. La piel era fría, con petequias en tórax, abdomen y extremidades inferiores y superiores, y sin cianosis. Encontramos una adenopatía muy dolorosa de 3 cm x 4 cm en región inguinal izquierda.
A nivel respiratorio se observó taquipnea, respiración de Kussmaul, murmullo vesicular disminuido en bases, sin ruidos agregados. Los ruidos cardíacos fueron rítmicos y taquicárdicos, sin soplos, con pulso débil y rápido, y llenado capilar prolongado. A nivel gastrointestinal, encontramos dolor a la palpación en cuadrante inferior izquierdo, el abdomen estuvo tenso a la palpación superficial, sin visceromegalias y con ruidos hidroaéreos presentes. La evaluación neurológica mostró un paciente alerta, desorientado, agitado, y sin déficit focal ni signos meníngeos.
EVALUACIÓN DIAGNÓSTICA
Ante un paciente febril con facies tóxica, manifestaciones sistémicas, adenopatía inguinal izquierda dolorosa y antecedente de viaje reciente a zona endémica de peste, se planteó el diagnóstico clínico de una sepsis severa /shock séptico debida a peste septicémica secundaria a la forma bubónica como primera posibilidad y el diagnóstico diferencial incluyó fiebre tifoidea, leptospirosis, rickettsiosis, entre otras. Se propuso un plan de exámenes de diagnóstico para determinar la extensión de la enfermedad e identificar el agente etiológico.
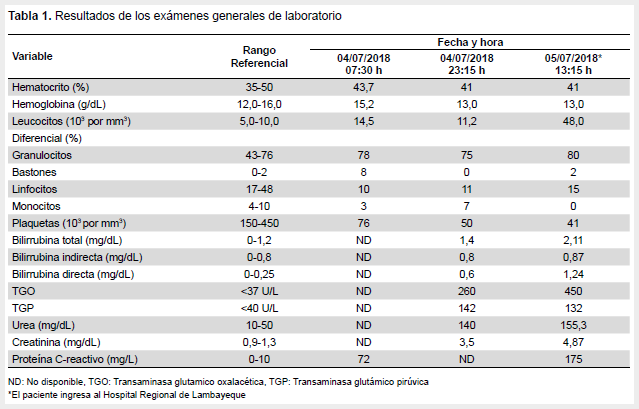
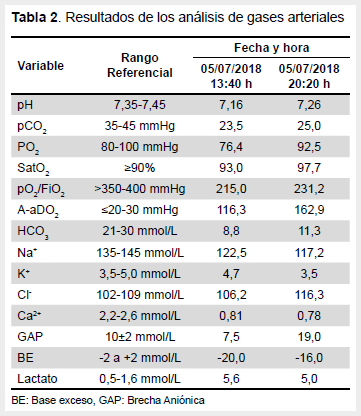
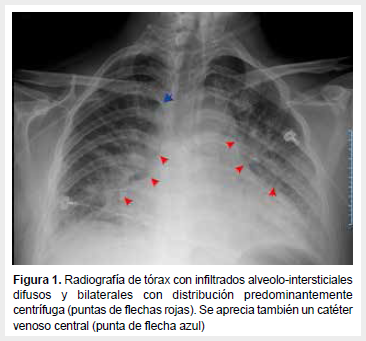
En los resultados de laboratorio se evidenció leucocitosis marcada con neutrofilia, plaquetopenia, retención nitrogenada, transaminasemia leve (Tabla 1), acidosis metabólica con hiperlactatemia e hipoxemia (Tabla 2). La radiografía de tórax (Figura 1) mostró infiltrado alveolo-intersticial bilateral a predominio de bases, compatible con síndrome de distrés respiratorio agudo. La ecografía abdominal mostró hepatoesplenomegalia y adenopatías inguino-femorales izquierdas. No evidenciamos líquido libre en cavidad abdominal.

INTERVENCIÓN TERAPÉUTICA
Se inició tratamiento con solución salina, vasopresores (noradrenalina más adrenalina), corticoides (hidrocortisona 100 mg IV tres veces al día), antibióticos (ceftriaxona 2g IV, gentamicina 160 mg IV, y doxiciclina 100 mg vía oral), y reposición de bicarbonato IV. Horas después del ingreso con mal patrón ventilatorio y resultados de gasometria arterial, el paciente fue intubado y recibió ventilación mecánica con sedoanalgesia y relajación muscular.
SEGUIMIENTO Y RESULTADOS
El paciente continúo en la unidad de shock trauma y falleció a las 06.00 h del día siguiente (18 horas después de su ingreso al HRL). La prueba rápida (antígeno F1 de Y. pestis) resultó positiva (se informó cuatro días después del deceso del paciente), al igual que la prueba de reacción en cadena de la polimerasa (PCR) procesada en el Instituto Nacional de Salud (Lima, Perú), cuyo resultado se obtuvo cinco días después del deceso.
Se procesó urocultivo, hemocultivos (dos), serología para VIH, VDRL, VHB, leptospirosis, rickettsias, y dengue. Todos dieron resultados negativos. No se realizó aspirado de bubón inguinal ni se tomó muestras de esputo o secreciones bronquiales.
El diagnóstico final fue shock séptico con falla multiorgánica por peste bubónica primaria con peste septicémica secundaria. Durante el seguimiento de contactos domiciliarios, se reportó un familiar febril que fue tamizado y descartado de peste. Finalmente, no se reportó ningún caso adicional de peste entre los contactos domiciliarios y hospitalarios, ni entre la población residente de la zona probable de contagio en el distrito de Salas, Lambayeque. Como profilaxis se administró doxiciclina 100 mg dos veces al día vía oral por siete días a los contactos domiciliarios y hospitalarios adultos; en niños menores de nueve años y gestantes, se administró cotrimoxazol a dosis 10 mg/Kg/día de trimetropin vía oral dos veces al día por siete días.
DISCUSIÓN
En el Perú, luego del eventual fenómeno de El Niño Costero del verano del 2017 se intensificó la alerta sobre la posibilidad de enfermedades metaxénicas y zoonóticas en la costa norte, incluida la vigilancia de peste. En este contexto, en Lambayeque se había notificado un caso de peste bubónica en una localidad del distrito de Salas ocurrido en junio del 2018 (11). Por ello, ante la presencia de un paciente febril, tóxico, con adenopatías inguinales dolorosas y antecedente de viaje al distrito de Salas, se planteó de forma inmediata la posibilidad de sepsis severa/shock séptico por peste e instaló soporte médico intensivo en la unidad de shock trauma. No obstante, el paciente ya había acudido por emergencia un día antes, y su atención por emergencia en el HRL fue desestimada.
El reservorio y puerta de entrada no pudo determinarse en nuestro paciente, pero es posible haya ocurrido por picadura inadvertida de pulgas, ya que la peste bubónica se adquiere usualmente de esta manera (1,6,8). Su período de incubación estimada fue menos de dos días, siendo el reportado en la literatura de dos a ocho días (1-4) lo que dificultó su manejo oportuno. La peste bubónica en más del 50% de casos no tratados evoluciona a la forma septicémica y neumónica, como en nuestro paciente. Sin embargo, el corto tiempo de evolución hizo que se superpongan las formas clínicas y dificulten aún más el diagnóstico. En la forma septicémica primaria, donde no hay bubones evidentes, el diagnóstico es frecuentemente postmortem (3-8).En el presente caso, es muy difícil establecer si el compromiso pulmonar se debió a una forma secundaria de peste o fue parte de la falla multiorgánica del paciente grave.
Se describen tres perlas clínicas diagnósticas de peste: a) fiebre en una persona en contacto con roedores, o residencia o viaje a una región endémica; b) fiebre, hipotensión, y linfadenitis regional inexplicada; y c) neumonía con hemoptisis y esputo con gérmenes gramnegativos con la tinción de Gram (3,5-8). El paciente que reportamos cumplió con los dos primeros de estos criterios, además de la combinación de leucocitosis (>20 mil leucocitos/µL) y trombocitopenia. Este último dato laboratorial es muy útil en el diagnóstico de peste, ya que está presente en al menos 50% de casos (5-7). La mayoría de hallazgos clínicos y de laboratorio de inicio son inespecíficos por lo que el diagnóstico es un verdadero reto. El rendimiento del hemocultivo es de 70%-90% en forma bubónica y casi 100% en septicémica. Las pruebas que detectan el antígeno F1 son sensibles y altamente específicas (la prueba de hemaglutinación indirecta es el patrón de referencia) (13,14). En nuestro paciente se detectó positividad en la prueba rápida para el antígeno F1 y en la PCR para Y. pestis (12).
La clave para la prevención y control de la peste es la rapidez en el diagnóstico, cuarentena y tratamiento. El tratamiento antimicrobiano precoz y efectivo es crucial para mejorar el pronóstico, siendo de elección la estreptomicina sola o combinada con doxiciclina para las formas graves. En compromiso meníngeo se recomienda cloranfenicol (1,3,4,8-10,15). Tanto estreptomicina como cloranfenicol son medicamentos «huérfanos». El primero, no está disponible en Perú desde hace varios años, y el segundo escasea por desuso.
En conclusión, este caso letal debe alertarnos sobre la inusitada presentación de la peste en nuestro país, por lo que debemos estar atentos ante su eventual presencia. Resulta desconcertante que en pleno siglo XXI, con la tecnología desarrollada con la finalidad de obtener un diagnóstico temprano, aún se presenten formas graves de peste, y es más sorprendente todavía, que muchos médicos no sean capaces de sospechar y reconocer un «caso típico» de peste. Se recomienda al personal de salud considerar la importancia del rápido diagnóstico clínico y de laboratorio, y a las autoridades del sector brindar apoyo sostenido a esta estrategia sanitaria, asegurando la disponibilidad de pruebas diagnósticas y medicamentos adecuados.
Perspectiva del paciente: La esposa del paciente consideró que debe investigarse y reportar el caso para evitar nuevos casos graves y fallecimientos por peste.
Aspectos éticos: Se obtuvo el consentimiento informado del familiar (esposa) y se contó con autorización del Comité de Investigación del Hospital Regional Lambayeque.
Contribuciones de autoría: Ambos autores contribuyeron por igual en la concepción, redacción, revisión y aprobación final del manuscrito.
Fuentes de financiamiento: Los autores declaramos que no hemos recibido financiamiento externo.
Conflictos de interés: Los autores declaramos que no tenemos conflictos de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Butler T. Plague into the 21st century. Clin Infect Dis. 2009;49(5):736-42. doi: 10.1086/604718.
2. Rollins SE, Rollins SM, Ryan ET. Yersinia pestis and the plague. Am J Clin Pathol. 2003;119 Suppl:S78-85. doi: 10.1309/DQM93R8Q-NQWB-FYU8.
3. Prentice MB, Rahalison L. Plague. Lancet. 2007;369(9568):1196-207. doi: 10.1016/S0140-6736(07)60566-2.
4. Nikiforov VV, Gao H, Zhou L, Anisimov A. Plague: Clinics, Diagnosis and Treatment. Yersinia Pestis: Retrospective and Perspective. Adv Exp Med Biol. 2016;918:293-312. doi:10.1007/978-94-024-0890-4_11.
5. Cobbs CG, Chansolme DH. Plague. Dermatol Clin. 2004;22(3):303-12. doi: 10.1016/j.det.2004.03.007.
6. Li YF, Li DB, Shao HS, Li HJ, Han YD. Plague in China 2014-All sporadic case report of pneumonic plague. BMC Infect Dis. 2016;16:85. doi: 10.1186/s12879-016-1403-8.
7. Pechous RD, Sivaraman V, Stasulli NM, Goldman WE. Pneumonic Plague: The Darker Side of Yersinia pestis. Trends Microbiol. 2016;24(3):190–197. doi: 10.1016/j.tim.2015.11.008.
8. Ratsitorahina M, Chanteau S, Rahalison L, Ratsifasoamanana L, Boisier P. Epidemiological and diagnostic aspects of the outbreak of pneumonic plague in Madagascar. Lancet. 2000; 355(9198):111-3. doi: 10.1016/S0140-6736(99)05163-6.
9. Maguiña-Vargas C. Actualización sobre peste en el Perú. Rev Per Ginecol Obstet. 2010; 56:238-241.
10. Donayres LF, Céspedes M, Valencia P, Salas JC, Luna ME, Castañeda A, et al. Peste neumónica primaria con transmisión intrahospitalaria en La Libertad, Perú 2010. Rev Peru Med Exp Salud Publica. 2010;27(3):326-36.
11. Centro Nacional de Epidemiología, Prevención y Control de Enfermedades. Ministerio de Salud. Boletín Epidemiológico del Perú. Volumen 27– SE 24-2018. [Internet]. Lima: Ministerio de Salud; 2018 [citado el 20 de enero de 2019]. Disponible en: http://www.dge.gob.pe/portal/docs/vigilancia/boletines/2018/24.pdf.
12. Centro Nacional de Epidemiología, Prevención y Control de Enfermedades. Ministerio de Salud. Brotes y Emergencias, Perú. SE 28-2018 [Internet]. Lima: Ministerio de Salud; 2018 [citado el 20 de enero de 2019]. Disponible en: http://www.dge.gob.pe/portal/docs/tools/teleconferencia/2018/SE282018/02.pdf.
13. Williams JE, Arntzen L, Robinson DM, Cavanaugh DC, Isaäcson M. Comparison of passive haemagglutination and enzymelinked immunosorbent assay for serodiagnosis of plague. Bull World Health Organ. 1982;60(5):777–8.
14. Chanteau S, Rahalison L, Ralafiarisoa L, Foulon J, Ratsitorahina M, Ratsifasoamanana L, et al. Development and testing of a rapid diagnostic test for bubonic and pneumonic plague. Lancet. 2003;361(9353):211-6. doi:10.1016/s0140-6736(03)12270-2.
15. Poland JD, Dennis DT. Treatment of plague. Plague manual: epidemiology, distribution, surveillance and control. Geneva: World Health Organization; 1999.
Correspondencia: Edinson Dante Meregildo Rodriguez
Dirección: Hospital Regional Lambayeque, Vía de Evitamiento Norte con Avenida El Progreso S/N. Lambayque, Perú.
Teléfono: 944 226 126
Correo electrónico: dante_meregildo@hotmail.com
Recibido: 13/02/2019
Aprobado: 31/07/2019
En línea: 16/08/2019