Denisse Castro
Joel de León
Brady Beltrán
ARTÍCULO DE REVISIÓN
Inmunoterapia en cáncer: de los inicios al premio Nobel
Cancer immunotherapy: from inception to Nobel Prize
Liliana Vasquez
![]() 1, Médico oncólogo pediatra
1, Médico oncólogo pediatra
Denisse Castro ![]() 1, médico oncóloga
1, médico oncóloga
Joel de León ![]() 2, Licenciado en Bioquímica, Doctor en Ciencias
Biológicas
2, Licenciado en Bioquímica, Doctor en Ciencias
Biológicas
Brady Beltrán ![]() 1, médico oncólogo, magister en Biología molecular
1, médico oncólogo, magister en Biología molecular
1
Centro de Investigación de
Medicina de Precisión, Instituto de Investigación, Facultad de Medicina Humana,
Universidad de San Martín de Porres, Lima, Perú.
2 Centro de Investigación en Infectología e Inmunología, Facultad de Medicina Humana,
Universidad de San Martín de Porres, Lima, Perú.
RESUMEN
La inmunoterapia ha significado un gran avance
científico en el tratamiento del cáncer en los últimos años, siendo considerada
como la piedra angular terapéutica de algunas neoplasias. Sin embargo, en
algunos tipos de cáncer sólo una fracción de pacientes alcanza beneficio,
planteando los desafíos y limitantes que nos llevan a la necesidad de entender
la complejidad de la biología tumoral, el microambiente tumoral y la capacidad
de respuesta de cada agente. Los resultados superan actualmente lo alcanzado
por la quimioterapia convencional, aunque aún no se puede precisar si estas
respuestas son duraderas o representan curación. En la presente revisión, se
propone un enfoque amplio sobre la inmunoterapia en cáncer, desde los conceptos
básicos hasta su aplicación clínica, descubrimiento que fue galardonado con el
Premio Nobel de Medicina en el 2018.
Palabras clave: Inmunoterapia; Neoplasias; Oncología Médica (fuente: DeCS BIREME).
ABSTRACT
Immunotherapy has meant a great scientific advance in the treatment of cancer in recent years, being
considered as the therapeutic cornerstone of some neoplasms. However, in some types of cancer only a fraction of patients achieve benefit, posing the challenges and limitations that lead us to the need
to understand the complexity of tumor biology, the microenvironment and the responsiveness of each agent. The
results currently exceed what was
achieved by conventional chemotherapy, although it is
not yet possible
to determine whether these
responses are lasting or represent cure. In this review, a broad approach to immunotherapy in cancer is proposed,
from the basics to its clinical
application, a discovery that was awarded
the Nobel Prize in Medicine
in 2018.
Keywords: Immunotherapy; Neoplasms; Medical Oncology (source: MeSH NLM).
INTRODUCCIÓN
La inmunoterapia se está
convirtiendo en la piedra angular de los enfoques terapéuticos en pacientes con
cáncer, cuyo éxito radica en manipular la actividad del sistema inmunológico,
tanto de las células como de los mediadores moleculares con el fin de aniquilar
las células malignas, mientras las células normales del organismo permanecen
intactas. Estas terapias han demostrado inducir la regresión tumoral completa y
duradera en algunos tipos de cáncer, convirtiéndose un verdadero hito en las
terapias dirigidas, incluso en el contexto de enfermedades avanzadas o metastásicas (1).
La presente revisión propone
un enfoque amplio sobre la inmunoterapia en cáncer, desde los conceptos básicos
hasta su aplicación clínica. La misma se fundamenta principalmente en el
descubrimiento por los científicos pioneros James P. Allison y Tasuku Honjo, ganadores del
Premio Nobel en Medicina en el 2018, de los puntos de control de la respuesta
inmune CTLA4 (del inglés, cytotoxic T-lymphocyte antigen 4) y el
eje PD-1/PDL-1 (del inglés, programmed
death-1 y programmed death-1 ligand),
respectivamente. Estas moléculas son actualmente blancos clave de la
inmunoterapia en cáncer.
Para la selección de los
trabajos incluidos en esta revisión se realizó una búsqueda, en Pubmed, de trabajos originales y revisiones temáticas,
publicados después del 2010 sobre inmunooncología e
inmunoterapia en cáncer. Se excluyeron de esta búsqueda aquellos trabajos de
los que solo se pudo revisar el resumen. Considerando el gran volumen de
información en este campo, se realizó una selección de aquellos estudios de
mayor trascendencia por su relevancia teórico-práctica y que resultan referencia
obligada en este campo.
INMUNO-ONCOLOGÍA: DE
INMUNOEDITAR A INMUNOVIGILAR
En el 2011, las evidencias
experimentales y clínicas acumuladas acerca de la biología de las células
neoplásicas le permitieron a los investigadores Douglas Hanahan
y Robert Weinberg fundamentar ocho propiedades
esenciales que aseguran la progresión del cáncer: señales proliferativas
constitutivas, evasión de señales antiproliferativas,
resistencia a la apoptosis, potencial replicativo
sostenido, inducción de angiogénesis, reprogramación metabólica, capacidad metastásica y capacidad para evadir el sistema inmune (2,3).Estas
cualidades se sustentan en la inestabilidad genética de las células neoplásicas
y en el contexto inflamatorio crónico ligado a la progresión tumoral.
Las propiedades inherentes a
las células neoplásicas les permiten evadir los mecanismos extrínsecos e
intrínsecos que controlan la carcinogénesis. Dentro de los mecanismos
extrínsecos se incluye la demostrada capacidad del sistema inmune de activar
sus mecanismos efectores para controlar la progresión tumoral (4).
Este evento conceptualizado como inmunovigilancia
transcurre en cuatro etapas principales (5) (Figura 1): 1) la detección por las células
presentadoras de antígenos (APC, del inglés, Antigen
Presenting Cells) de
señales de peligro producidas por la pérdida de la homeostasis en los tejidos
donde se produce la carcinogénesis, así como por la presencia de antígenos
específicos o asociados al tumor, lo cual produce una serie de cambios morfofuncionales en las células dendríticas e implica la
maduración de estas células y su migración a los ganglios linfáticos
adyacentes; 2) activación, proliferación y diferenciación funcional de los
linfocitos T colaboradores CD4+ y
citotóxicos CD8+; 3) migración de los linfocitos activados al tejido alterado
y su extravasación para interactuar con las células transformadas, y 4)
ejecución de los mecanismos efectores de la inmunidad que deben conducir a la
eliminación de las células transformadas. En esta cuarta etapa, la muerte de
las células neoplásicas incrementa la liberación de antígenos inmunogénicos.
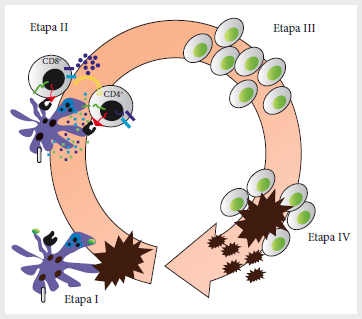
Figura
1.
Etapas principales en que se establece y ejecuta la inmunovigilancia
al cáncer. Etapa I: captura de antígenos tumorales y maduración de las células
dendríticas; Etapa II: estimulación en
En el concepto descrito, se
incluyen tanto neoantígenos como otras moléculas que
actúan como señales de peligro para el sistema inmune, las que son liberadas
como consecuencia de la muerte masiva por apoptosis. Lo anterior potencia la
estimulación de las APC, reiniciando un proceso cíclico virtuoso. La
influencia de la inmunovigilancia en la progresión
tumoral es tan relevante que se ha demostrado el valor pronóstico y predictivo
de la composición y localización del infiltrado leucocitario en el
microambiente tumoral (6-8).
Como se mencionó
anteriormente, la inestabilidad genética es una cualidad habilitante para las
propiedades esenciales del cáncer (2,3). Esta condición determina
que en las neoplasias se produzca una evolución somática, de manera que los
clones que guían la progresión tumoral son los de mayor capacidad de
adaptación a las presiones selectivas que se producen en el microambiente
tumoral (9).
Entre estas presiones selectivas se incluye la propia inmunovigilancia,
de manera que la actividad antitumoral del sistema inmune edita la composición
de los clones de células neoplásicas en el cáncer (10). Lo anterior
enriquece al tumor con células neoplásicas con capacidad de evadir la inmunovigilancia, lo que evidencia el papel dual del
sistema inmune sobre la progresión tumoral. Este efecto de edición clonal se ha nombrado inmunoedición,
concepto que refleja de manera más integral la compleja relación entre el
sistema inmune y el cáncer (10).
La inmunoedición
incluye tres etapas (10): 1) eliminación, en la que se produce la inmunovigilancia al cáncer con la consecuente muerte de
las células neoplásicas por la actividad del sistema inmune innato y
adaptativo. El incremento en la frecuencia de neoplasias en modelos de
experimentación y en pacientes con inmunodeficiencias sustenta la ocurrencia de
esta etapa; 2) equilibrio, en la que los mecanismos efectores del sistema
inmune pueden controlar la progresión tumoral pero no elimina al tumor. La
estabilización de la progresión tumoral o la reemergencia de tumores en animales
de experimentación y en pacientes, como consecuencia de inmunodeficiencias, son
evidencias de esta etapa; y 3) escape, etapa en la que la progresión tumoral no
puede ser controlada por el sistema inmune por la emergencia de una gran
diversidad mecanismos que afectan la inmunovigilancia.
Estos mecanismos incluyen la reducción de la inmunogenicidad
de las células neoplásicas, la expresión en membrana y/o secreción al
microambiente tumoral de moléculas con efecto inmunosupresor, la alteración de
la maduración de las células dendríticas, el incremento en la frecuencia
sistémica y/o reclutamiento al microambiente tumoral de células mieloides y
linfoides con actividad inmunosupresora, y las alteraciones en el tráfico
leucocitario al microambiente tumoral.
Es importante remarcar que el
establecimiento de una u otra estrategia de escape a la inmunovigilancia
se debe a la presión selectiva que ejercen los mecanismos efectores del
sistema inmune sobre las células neoplásicas. En consecuencia, la manipulación
de estos mecanismos de escape como alternativa de inmunoterapia deberá tener un
enfoque de precisión, basado no solamente en la caracterización genética del
tumor, sino también en la comprensión de los mecanismos de inmunoevasión
más relevantes en cada neoplasia (11,12).
INMUNOTERAPIA EN CÁNCER: DE ACTIVAR ACTIVADORES A INHIBIR
INHIBIDORES
Considerando las
características de la relación entre el sistema inmune y las células
neoplásicas, el cáncer manifiesta una fisiopatología de tres tipos: 1) inmunogénica, es decir, con expresión de antígenos inmunogénicos, activación de las células T antitumorales e
inducción de anticuerpos, lo que marca un pronóstico favorable; 2)
inflamatoria, con elevada producción de moléculas inflamatorias, proangiogénicas e inmunosupresoras, así como el incremento
en la frecuencia y actividad supresora de células mieloides supresoras (MDSCs, del inglés Myeloid
Derived Suppressor Cells) y células T regulatorias (Treg),
que produce una alta agresividad tumoral y pronóstico desfavorable; 3)
escapatoria, con pobre activación inmune y producción de citoquinas, de
pronóstico intermedio. La inmunoterapia dirigida a cada uno de estos escenarios
sería diferente, siendo más efectivo el uso de drogas de bloqueo de puntos de
control de la inmunidad, en el tipo inmunogénico; el
uso de antiangiogénicos, anticuerpos que bloqueen el
factor de crecimiento transformante-β y drogas de bloqueo de puntos de control
de la inmunidad, en el tipo inflamatorio; y terapia celular y anticuerpos
específicos a antígenos tumorales, en el tipo escapatorio
(13).
De acuerdo con estos puntos de
activación e inhibición señalados, las estrategias fundamentales de la
inmunoterapia serían tres: 1) la estimulación de la interacción entre las APC y
las células T (ej. vacunas tumorales); 2) la inhibición de señales coinhibitorias (ej. bloqueo de puntos de control de la
inmunidad), así como de células inmunosupresoras como las Treg
y MDSCs; 3) la transferencia adoptiva de efectores
inmunes como anticuerpos monoclonales y células T (14).
Vacunas tumorales
Están dirigidas a proveer al sistema inmune del
paciente de antígenos tumorales, péptidos o células enteras. Su efectividad es
bastante variable ya que depende de que no exista una alta carga tumoral en el
paciente y mientras sea posible vencer los mecanismos de tolerancia inmune (14). A
pesar de que en estudios iniciales de tipo preclínico los resultados han sido
desalentadores, aún existe un marcado interés en el entendimiento del rol de
las vacunas tumorales como adyuvantes a otras terapias y reformulando su uso en
el tratamiento de distintos tipos de neoplasias malignas (15,16).
Bloqueo de puntos de regulación e inmunomodulación
celular
Los puntos de regulación contribuyen a modular la
magnitud de la respuesta inmune de las células T y son críticas para evitar
fenómenos de autoinmunidad. Sin embargo, su función en relación con la terapia
dirigida en procesos neoplásicos limita la intensidad y duración de las respuestas
antitumorales de manera significativa. Los puntos de regulación claves más
estudiados incluyen las moléculas de superficie celular T: CTLA-4, PD-1 y su
ligando, Tim-3 (del inglés, T cell inmunoglobulin and mucin domain-containing protein-3) y LAG-3 (del inglés, lymphocyte activation
gene-3), las cuales han sido altamente atractivas como moléculas diana en
el desarrollo de la inmunoterapia contra el cáncer (17,18).
Inmunoterapia adoptiva
Se basa en la administración a
los pacientes de anticuerpos monoclonales de relevancia en la práctica clínica,
como el rituximab (anti-CD20), bevacizumab
(antifactor de crecimiento vascular endotelial), cetuximab (antireceptor del
Factor de Crecimiento Epidérmico), por solo mencionar algunos de los que ya se
encuentran como terapias de primera línea en neoplasias sólidas y hematológicas
(17,18).
En esta lista se incluyen inmunoconjugados, como el
Y-ibritumomab tiuxetan y el
I-tositumomab para linfoma, y los anticuerpos biespecíficos, quienes se unen al antígeno tumoral y a la
célula inmune efectora, como el blinatumomab
(anti-CD19/anti-CD20). En esta categoría terapéutica se incluye la
transferencia de células T autólogas, las cuales se
extraen del paciente para ser modificadas ex vivo, y luego se infunden
nuevamente. Las células T-CAR (del inglés, chimeric
antigen receptor-T cells)
es una de estas variantes celulares que está siendo estudiada de forma
exhaustiva debido su gran potencial terapéutico (19).
POSICIONAMIENTO DE LA
INMUNOTERAPIA: DE LA MONOTERAPIA A LA COMBINACIÓN
El uso combinado de
anticuerpos para bloquear PD1/PDL-1 y CTLA-4 tiene como racionalidad que ambas
señales se involucran en etapas diferentes de la actividad linfocitaria.
CTLA-4 funciona regulando la activación de las células T en el ganglio
linfático, mientras que PD-1 juega su papel regulador principalmente en los
tejidos periféricos. Por tanto, esta combinación permite bloquear señales
inhibitorias de la respuesta inmune en diferentes partes o puntos del ciclo de
la inmunidad del cáncer, favoreciendo la infiltración de células T en el tumor
y promoviendo la actividad citotóxica de las células T antitumorales (Figura 2)
(20,21).
La terapia dual anti CTLA-4/PD-1 modifica el microambiente de un tumor supresor
o relativamente no inflamatorio a un tumor inflamatorio. Este efecto dual de
los dos agentes permite que se ejerzan mecanismos complementarios y no
redundantes con el objetivo de aumentar la tasa de respuesta (22,23).
Adaptado de Atkins
M. Immunotherapy Combinations
With 4Checkpoint Inhibitors in Metastatic
Melanoma: Current Approaches
and Future Directions. Semin Oncol. 2015 Dec;42 Suppl 3:S12-19. doi:
10.1053/j.seminoncol.2015.10.002.
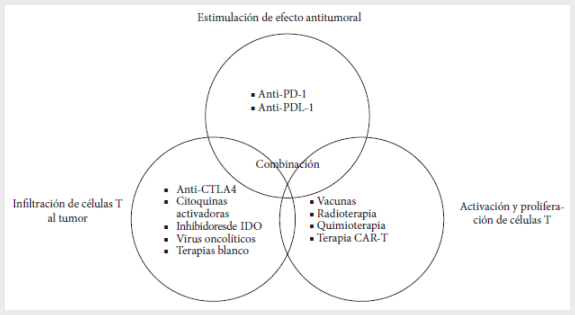
Figura
2.
Modelo de combinaciones con inmunoterapia y otros agentes. PD-1: programmed cell death protein 1, PDL-1: Programmed death-ligand 1,
CTLA-4: cytotoxic T lymphocyte antigen 4, IDO: indoleamina
2,3-dioxygenasa, CAR-T: chimeric antigen receptor.
En la actualidad, los agentes
de mayor trascendencia clínica son aquellos que bloquean puntos de control de
la inmunidad, como el ipilimumab (anti-CTLA-4), el nivolumab (anti-PD-1) y el pembrolizumab
(anti-PD-1) (20,21).
El ipilimumab tiene como mecanismo dirigirse a la
proteína de superficie de punto de control CTLA-4 que se encuentra en la célula
T. El nivolumab y pembrolizumab
se dirigen a la proteína de punto de control PD-1 que también se encuentran en
las células T. El reconocimiento por los anticuerpos de CTLA-4 o PD-1 evita la
unión con sus ligandos CD80/CD86 y PDL-1/PDL-2,
respectivamente, lo que bloquea las señales de inactivación linfocitaria,
potenciando la cronicidad del ataque inmunológico a la célula tumoral.
Actualmente, tiene gran
trascendencia la combinación de agentes inmunoterapéuticos
e incluso la combinación con otros tipos de terapias, como la terapia blanco,
la quimioterapia y la radioterapia (23-25). Un buen ejemplo de éxito
es el uso de inmunoterapia en melanoma, en donde se ha probado que la terapia
combinada es efectiva en estudios preclínicos y estudios clínicos de fase I a
III (26-28).
Este éxito en melanoma ha motivado numerosos estudios clínicos de combinación
entre el bloqueo de la señal PD-1/PDL-1 y de CTLA-4 en diferentes neoplasias,
así como con otros puntos de control como TIM-3 y LAG-3 (29-31).
El bloqueo del par molecular PD1/PDL-1 es la base de estas combinaciones,
debido a su amplio espectro en diversos cánceres y su favorable perfil de
toxicidad (20).
Además, se han propuesto otros
modelos de los potenciales mecanismos celulares que se producen con la
combinación anti-CTLA-4 y anti-PD-1: 1) las mismas células T pueden ser blanco
de ambos agentes en el mismo sitio de activación, conduciendo a un bloqueo más
efectivo de las señales inhibitorias de la actividad del sistema inmune; 2)
diferentes poblaciones de células T son blanco dentro del mismo sitio de
activación, conduciendo a efectos sinérgicos; 3) las mismas células T son
blanco de ambos agentes pero en diferente espacio y tiempo, conduciendo a una
señalización más prolongada, y 4) diferentes poblaciones celulares T son blanco
en diferentes tejidos (Figura 3) (32).
Adaptado de Wei
SC, Duffy CR, Allison JP. Fundamental Mechanisms of Immune Checkpoint Blockade Therapy. Cancer Discov. 2018 Sep;8(9):1069–86. doi: 10.1158/2159-8290.CD-18-0367.
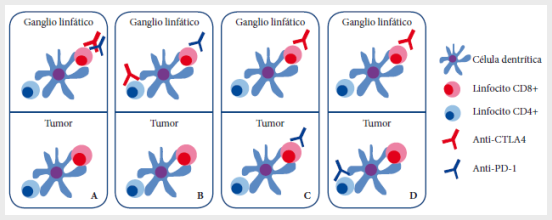
Figura
3.
Mecanismos celulares del tratamiento dual con anti-CTLA-4 y anti-PD-1: A. Una
misma célula T puede ser blanco de ambos agentes (anti-CTLA-4 y anti-PD-1) en
el sitio de activación (ganglios linfáticos), conduciendo a un mayor bloqueo de
señales inhibitorias y aumentando la activación del sistema inmune; B.
Diferentes poblaciones de células T( CD8+ y CD4+) son
blanco en el sitio de activación (provocando efectos sinérgicos; C. Una misma
célula T es blanco de ambos agentes pero en
diferente espacio y tiempo,
conduciendo a una señalización más prolongada; D. Diferentes poblaciones
celulares T son blanco de los agentes en diferentes tejidos.
RETOS Y PERSPECTIVAS DE LA INMUNO-ONCOLOGÍA
A pesar de que la inmunoterapia ha significado un
gran avance en el tratamiento del cáncer en los últimos 20 años, en algunos
tipos de cáncer las tasas de respuesta son menores al 20%, por lo que aún
existen más desafíos que alcanzar en esta área (33). Dentro de los retos de la
inmunoterapia en cáncer se encuentran:
Estrategia de combinación
Sobre la base de los
inhibidores de los puntos de control de la inmunidad, existen algunas
consideraciones en relación con la combinación con los siguientes agentes:
a. Agentes agonistas: la estrategia de combinar un agonista con
un inhibidor dependerá de la concomitancia/secuencialidad. Existe evidencia
preclínica que muestra que es mejor la estrategia de secuencia que la
concomitancia empezando con el agonista y luego el inhibidor. Otro factor para
tomar en cuenta es la dosis del agente agonista (34,35).
b. Agentes inhibidores: los resultados son evidentes con la
combinación de los anticuerpos monoclonales nivolumab
e ipilimumab en cáncer renal y melanoma; sin embargo,
los eventos adversos inmunorelacionados se
incrementan a toxicidad se incrementa notablemente (36).
c. Quimioterapia: agentes citotóxicos pueden aumentar la
exposición de antígenos tumorales y de patrones moleculares asociados a daño (DAMPs, del inglés Danger
Associated Molecular Patterns)
(36,37),
reduciendo además la actividad de las MDSCs y las Treg (38,39). Actualmente, quimioterapia en
combinación con pembrolizumab es el estándar en
primera línea de cáncer de pulmón de células no pequeñas tipo adenocarcinoma y
escamoso. En el cáncer de mama triple negativo, el anticuerpo atezolizumab asociado a nab-paclitaxel
en primera línea logra mejorar la sobrevida global fundamentalmente en
pacientes cuyas células neoplásicas expresan la molécula PDL-1 (40).
d. Agentes reguladores epigenéticos:
diversos mecanismos epigenéticos están involucrados
en la resistencia a la inmunoterapia, como el silenciamiento de genes del
complejo mayor de histocompatibilidad tipo-I, la producción de citoquinas inmunosupresoras
y la expresión de PD-1 (41,42). El empleo de agentes como los
inhibidores de desacetilasas de histonas o
inhibidores de la metilación del DNA podrían asociarse
a agentes de inmunoterapia (43).
Identificación de un biomarcador predictivo
Entre el 5 y 20% de los
pacientes que no expresan la molécula PDL-1 pueden responder a la terapia immune, (44) lo que hace de la molécula PDL-1 un biomarcador imperfecto. PDL-1 y linfocitos infiltrantes de
tumor podrían mejorar su capacidad de predicción (45,46). La evaluación
de la carga mutacional, que refleja la cantidad de neoantígenos que pueden ser detectados por el sistema
inmune, emerge como una interesante opción por los resultados en cáncer de
pulmón de células no pequeñas y melanoma. Ambas malignidades poseen alta tasa
de mutaciones inducidas por el tabaquismo y los rayos ultravioleta,
respectivamente. La inestabilidad de microsatélite
correlaciona con la tasa de mutaciones y la cantidad de neoantígenos.
La caracterización del microbioma intestinal parece identificar a los pacientes
que pueden ser respondedores a la inmunoterapia. Dos importantes hechos
confirman el rol de la microbiota y la regulación del
sistema inmune ligado al control del cáncer: primero, la influencia de los
antibióticos sobre la efectividad de la inmunoterapia; segundo, el trasplante
de microbiota fecal con Akkermansia
muciniphila aplicado a ratones con cáncer de
pulmón de células no pequeñas incrementaría la efectividad de la
inmunoterapia. Lo anterior refleja la importancia de la microbiomata
en la regulación de la vigilancia inmunológica al cáncer y en la sensiblidad de los pacientes a la inmunoterapia (47-49).
Identificación de blancos moleculares en el microambiente
tumoral
Es reconocida la influencia del microambiente
tumoral inmunosupresor en la actividad inmune. Diferentes tipos celulares del inmunocontexto en el microambiente tumoral contribuyen a la
progresión del cáncer, como es el caso de los macrófagos M2, los neutrófilos
N2, las MDSCs, entre otros. Recientemente un estudio
clínico Fase I-b, demostró que el bloqueo de la señal negativa mediada por la
molécula CD47 en macrófagos incrementa la fagocitosis de células tumorales, con
resultados impresionantes en pacientes con linfoma de células grandes B difuso
y linfoma folicular, multitratados (50).
Otra estrategia en desarrollo es el uso de inhibidores farmacológicos de la
enzima IDO en tumores. La actividad de esta enzima deprime o disminuye la
disponibilidad de triptófano e incrementa la liberación de la molécula kineurina, ambas condiciones nocivas para la actividad
linfocitaria (51).
CONCLUSIONES
La inmunoterapia combinada ha ganado protagonismo
entre los enfoques terapéuticos indicados a pacientes con cáncer. El diseñar y ensayar
combinaciones no consiste en la mera adición directa de diferentes agentes,
sino que se debe tener en cuenta la complejidad de la biología de tumor, su
microambiente y la capacidad de respuesta de cada agente. La inmunooncología ha logrado un éxito sin precedentes con
múltiples aprobaciones por la Administración de Drogas y Medicamentos de los
Estados Unidos (FDA) para diferentes neoplasias, incluyendo los inhibidores de
los puntos de control de la inmunidad y las células T-CAR. Aunque los resultados
superan lo alcanzado por la quimioterapia, aún no se puede precisar si estas
respuestas duraderas representan remisión a largo plazo.
REFERENCIAS BIBLIOGRÁFICAS
1. Restifo
NP, Dudley ME, Rosenberg
SA. Adoptive immunotherapy for cancer: harnessing
the T cell response. Nat Rev Immunol.
2012;12(4):269–81. doi: 10.1038/nri3191.
2. Hanahan
D, Weinberg R. Hallmarks of
cancer. Cell 2000;
100(1):57-70. doi:
10.1016/s0092-8674(00)81683-9.
3. Hanahan
D, Weinberg RA. Hallmarks
of cancer: the next generation. Cell. 2011;144(5):646–74. doi:
10.1016/j.cell.2011.02.013.
4. Ribatti
D. The concept of immune surveillance against tumors. The first
theories. Oncotarget. 2017;8(4):7175–80. doi:
10.18632/oncotarget.12739.
5. Chen
DS, Mellman I. Oncology meets immunology: the cancer-immunity cycle. Immunity. 2013;39(1):1–10. doi:
10.1016/j.immuni.2013.07.012.
6. Fridman
WH, Pagès F, Sautès-Fridman
C, Galon J. The immune contexture in human tumours: impact on clinical outcome.
Nat Rev Cancer.
2012 15;12(4):298–306. doi: 10.1038/nrc3245.
7. Galon
J, Mlecnik B, Bindea G, Angell HK, Berger A, Lagorce C, et
al. Towards the introduction of the “Immunoscore” in the classification of malignant tumours. J Pathol. 2014; 232(2):199–209.doi:
10.1002/path.4287.
8. Taube
JM, Galon J, Sholl LM, Rodig SJ, Cottrell TR, Giraldo
NA, et al. Implications of the
tumor immune microenvironment
for staging and therapeutics. Mod Pathol. 2018;31(2):214–34. doi: 10.1038/modpathol.2017.156.
9. Greaves
M, Maley CC. Clonal evolution in cancer. Nature. 2012;481(7381):306–13. doi: 10.1038/nature10762.
10. Vesely
MD, Kershaw MH, Schreiber
RD, Smyth MJ. Natural innate
and adaptive immunity to cancer. Annu Rev
Immunol. 2011;29:235–71. doi: 10.1146/
annurev-immunol-031210-101324.
11. Méndez R, Ruiz-Cabello F,
Rodríguez T, Del Campo A, Paschen A, Schadendorf D, et al. Identification
of different tumor escape mechanisms
in several metastases from a melanoma patient undergoing immunotherapy. Cancer Immunol Immunother. 2007;56(1):88–94. doi: 10.1007/s00262-006-0166-2.
12. Yuan J, Page DB, Ku GY, Li Y, Mu Z, Ariyan C, et
al. Correlation of clinical
and immunological data in a metastatic
melanoma patient with heterogeneous tumor responses to ipilimumab
therapy. Cancer Immun. 2010;10:1.
13. Becht
E, Giraldo NA, Dieu-Nosjean M-C, Sautès-Fridman
C, Fridman WH. Cancer immune contexture and immunotherapy. Curr Opin Immunol. 2016;39:7–13. doi:
10.1016/j.coi.2015.11.009
14. Villegas C, Ramírez D. Las
células Treg en la inmunoedición
e inflamación asociada al cáncer. Rev Fac Med. 2015;58(6):5-17.
15. Makkouk
A, Weiner GJ. Cancer immunotherapy and breaking immune tolerance: new approaches to an old challenge. Cancer Res. 2015;75(1):5–10. doi: 10.1158/0008-5472.CAN-14-2538.
16. Kumai
T, Kobayashi H, Harabuchi
Y, Celis E. Peptide vaccines
in cancer-old concept revisited.
Curr Opin Immunol. 2017;45:1–7. doi: 10.1016/j.coi.2016.11.001.
17. Scott AM, Wolchok JD, Old LJ. Antibody therapy of cancer. Nat Rev Cancer.
2012;12(4):278–87. doi: 10.1038/nrc3236.
18. Galluzzi
L, Vacchelli E, Fridman WH,
et al. Trial watch: Monoclonal antibodies in cancer therapy. Oncoimmunology. 2012;1(1):28–37. doi:
10.4161/onci.27297.
19. Prasad
V. Immunotherapy Tisagenlecleucel
- the first approved CAR-T-cell therapy: implications for payers and policy makers. Nat Rev Clin
Oncol. 2018;15(1):11-12. doi: 10.1038/nrclinonc.2017.156.
20. Postow
MA, Callahan MK, Wolchok
JD. Immune Checkpoint Blockade in Cancer Therapy. J Clin Oncol. 2015;33(17):1974–82.doi:10.1186/s40425-017-0218-5
21. Khalil
DN, Smith EL, Brentjens RJ, Wolchok
JD. The future of cancer treatment: immunomodulation, CARs and combination immunotherapy. Nat Rev Clin
Oncol. 2016;13(5):273–90. doi: 10.1038/nrclinonc.2016.25.
22. Atkins
M. Immunotherapy Combinations
With Checkpoint Inhibitors in Metastatic
Melanoma: Current Approaches
and Future Directions. Semin Oncol. 2015;42 Suppl 3:S12-19. doi: 10.1053/j.seminoncol.2015.10.002.
23. Ott
PA, Hodi FS, Kaufman HL, Wigginton JM, Wolchok JD. Combination immunotherapy: a road map. J Immunother
Cancer. 2017;5:16. doi: 10.1186/ s40425-017-0218-5.
24. Harris SJ, Brown J, Lopez J, Yap TA. Immuno-oncology combinations: raising the tail
of the survival curve. Cancer Biol Med.
2016;13(2):171–93. doi: 10.20892/j. issn.2095-3941.2016.0015.
25. Fucà
G, de Braud F, Di Nicola M. Immunotherapy-based
combinations: an update. Curr Opin
Oncol. 2018 Sep;30(5):345–51.
doi: 10.1097/
CCO.0000000000000466.
26. Curran MA, Montalvo W, Yagita H, Allison JP. PD-1 and CTLA-4 combination
blockade expands infiltrating T cells and reduces regulatory T and myeloid cells within B16 melanoma tumors. Proc Natl
Acad Sci USA. 2010;107(9):4275–80. doi:
10.1073/pnas.0915174107.
27. Larkin J, Chiarion-Sileni V, Gonzalez R, Grob JJ, Cowey CL, Lao CD, et
al. Combined Nivolumab
and Ipilimumab or Monotherapy in Untreated
Melanoma. N Engl J Med.
2015;373(1):23–34. doi: 10.1056/NEJMoa1504030.
28. Wolchok
JD, Chiarion-Sileni V, Gonzalez
R, Rutkowski P, Grob J-J, Cowey CL, et al. Overall Survival with Combined
Nivolumab and Ipilimumab in
Advanced Melanoma. N Engl J
Med. 2017 05;377(14):1345–56.
Doi: 10.1056/NEJMoa1709684.
29. Marmarelis
ME, Aggarwal C. Combination
Immunotherapy in Non-small Cell Lung Cancer.
Curr Oncol Rep. 2018;20(7):55. doi:
10.1007/s11912018-0697-7.
30. Hoffman-Censits J, Wilde L. Combination immunotherapy in genitourinary malignancies. Curr Opin Urol. 2016;26(6):523–8.
doi: 10.1097/
MOU.0000000000000336.
31. George S, Rini BI, Hammers HJ. Emerging Role of Combination Immunotherapy in the First-line Treatment of Advanced Renal Cell Carcinoma: A Review. JAMA Oncol. 2019;5(3):411-421. doi:
10.1001/jamaoncol.2018.4604.
32. Wei
SC, Duffy CR, Allison JP. Fundamental Mechanisms of Immune Checkpoint Blockade Therapy. Cancer Discov. 2018;8(9):1069–86. doi: 10.1158/21598290.CD-18-0367.
33. Marshall HT, Djamgoz MBA. Immuno-Oncology: Emerging Targets and Combination Therapies. Front Oncol. 2018;8:315. doi:
10.3389/fonc.2018.00315.
34. Shrimali
RK, Ahmad S, Verma V, Zeng
P, Ananth S, Gaur P, et al.
Concurrent PD-1 blockade negates the effects
of OX40 agonist antibody in
combination immunotherapy through inducing T-cell apoptosis. Cancer Immunol Res 2017; 5(9):755–766. doi: 10.1158/2326-6066.CIR-17-0292.
35. Messenheimer
DJ, Jensen SM, Afentoulis ME, Wegmann
KW, Feng Z, Friedman DJ, et al. Timing of PD-1
Blockade Is Critical to Effective Combination Immunotherapy with Anti-OX40. Clin Cancer Res. 2017;23(20):6165–77. doi: 10.1158/1078-0432.CCR-16-2677.
36. Zhou
S, Khanal S, Zhang H. Risk
of immune-related adverse events
associated with ipilimumab-plus-nivolumab and nivolumab therapy in cancer patients. Ther Clin Risk
Manag. 2019;15:211-221. doi: 10.2147/TCRM.S193338.
37. Zitvogel
L, Kepp O, Kroemer G. Immune parameters affecting the efficacy
of chemotherapeutic regimens.
Nat Rev Clin
Oncol. 2011 Mar;8(3):151–60.
doi: 10.1038/nrclinonc.2010.223.
38. Zitvogel
L, Galluzzi L, Smyth MJ, Kroemer G. Mechanism of action of conventional and targeted anticancer therapies: reinstating immunosurveillance. Immunity.
2013 Jul 25;39(1):74–88. doi: 10.1016/j.immuni.2013.06.014.
39. van der Most RG, Currie AJ, Mahendran S, Prosser A, Darabi A, Robinson BWS, et al. Tumor eradication after cyclophosphamide depends on concurrent depletion
of regulatory T cells: a
role for cycling
TNFR2-expressing effector-suppressor T cells in limiting effective chemotherapy. Cancer Immunol Immunother. 2009;58(8):1219–28. doi: 10.1007/s00262-008-0628-9.
40. Schmid
P, Adams S, Rugo HS, Schneeweiss A, Barrios CH, Iwata H, et al. Atezolizumab
and Nab-Paclitaxel in Advanced
Triple-Negative Breast Cancer. N Engl J Med. 2018;379(22):2108–21. doi: 10.1056/NEJMoa1809615.
41. Chang C-C, Ferrone S. Immune selective pressure and HLA class I antigen defects in malignant lesions. Cancer Immunol Immunother. 2007;56(2):227–36. doi:
10.1007/s00262-006-0183-1.
42. Yasmin
R, Siraj S, Hassan A, Khan
AR, Abbasi R, Ahmad N. Epigenetic
regulation of inflammatory cytokines and associated genes in
human malignancies. Mediators
Inflamm. 2015;2015:201703. doi: 10.1155/2015/201703.
43. Wrangle
J, Wang W, Koch A, Easwaran H, Mohammad
HP, Vendetti F, et al. Alterations
of immune response of Non-Small Cell
Lung Cancer with Azacytidine. Oncotarget. 2013;4(11):2067–79. doi: 10.18632/oncotarget.1542.
44. Fusi
A, Festino L, Botti G et al. PD-L1 expression as a potential predictive biomarker. Lancet Oncol. 2015;
16(13):1285–7. doi:
10.1016/S1470-2045(15)00307-1.
45. Smyth
MJ, Ngiow SF, Ribas A, Teng
MWL. Combination cancer immunotherapies tailored to the tumour microenvironment.
Nat Rev Clin
Oncol. 2016;13(3):143–58. doi: 10.1038/nrclinonc.2015.209.
46. Teng
MWL, Ngiow SF, Ribas A, Smyth
MJ. Classifying Cancers Based on T-cell
Infiltration and PD-L1. Cancer
Res. 2015;75(11):2139–45. doi: 10.1158/00085472.CAN-15-0255.
47. Routy
B, Le Chatelier E, Derosa
L, Duong CPM, Alou MT, Daillère
R, et al. Gut microbiome
influences efficacy of
PD-1-based immunotherapy against
epithelial tumors. Science. 2018;359(6371):91–7. doi: 10.1126/science.aan3706.
48. Gopalakrishnan
V, Spencer CN, Nezi L, Reuben
A, Andrews MC, Karpinets TV, et al. Gut microbiome modulates response to anti-PD-1 immunotherapy
in melanoma patients. Science.
2018;359(6371):97–103. doi: 10.1126/science.aan4236.
49. Matson
V, Fessler J, Bao R Chongsuwat T, Zha Y, Alegre ML,
et. al. The commensal microbiome is associated with
anti-PD-1 efficacy in metastatic
melanoma patients. Science.
2018; 359(6371):104–108. doi:
10.1126/science.aao3290.
50. Advani
R, Flinn I, Popplewell L,
Forero A, Bartlett NL, Ghosh N, et al. CD47 Blockade by Hu5F9-G4 and Rituximab in Non-Hodgkin’s Lymphoma. N Engl J Med. 2018;379(18):1711–21. doi: 10.1056/NEJMoa1807315.
51. Epacadostat
Shows Value in Two SCCHN Trials. Cancer Discov. 2017;7(9):OF2. doi: 10.1158/2159-8290.CD-NB2017-100.
Fuentes de financiamiento: Autofinanciado.
Citar como: Vasquez L, Castro D, De León J, Beltrán B. Inmunoterapia
en cáncer: de los inicios al premio Nobel. Rev Peru Med Exp
Salud Publica. 2020;37(1):115-21.
Doi: https://doi.org/10.17843/rpmesp.2020.371.4329.
Correspondencia: Brady Beltran Garate; bgbrady@hotmail.com.
Contribuciones de autoría: LV, DC, JL y BB han participado en la concepción
del artículo. Todos los autores participaron de la redacción del artículo y la aprobación
de la versión final.
Conflictos de interés: Los autores declaran no tener conflictos de
intereses en la publicación del artículo.
Recibido:
07/03/2019
Aprobado:
15/01/2020
En línea:
19/03/2020