REPORTE DE CASO
Fiebre amarilla selvática con serología positiva para leptospira en un varon joven peruano
Jungle yellow fever with positive serology for leptospira in a young peruvian male
Edinson Dante Meregildo-Rodriguez1,a, Miguel Villegas-Chiroque1,b
1
Servicio de Medicina Interna, Hospital Regional de Lambayeque. Lambayeque,
Perú.
a Médico Internista; maestro en Medicina; b Médico Infectólogo; doctor en Medicina
RESUMEN
Fiebre amarilla (FA) y leptospirosis son zoonosis endémicas subdiagnosticadas de las regiones tropicales de África y Sudamérica. Ambas, pueden ser clínicamente indistinguibles y presentarse como síndrome febril icterohemorrágico agudo. Reportamos el caso de un varón de 20 años, procedente del departamento de Amazonas que se presentó con nueve días de enfermedad caracterizada por falla multiorgánica (compromiso neurológico, renal, hepático, respiratorio, y hematológico). Recibió tratamiento antibiótico, soporte transfusional, dialítico, hemodinámico, y ventilatorio; y a pesar de la gravedad del cuadro clínico, evolucionó favorablemente. Se confirmó FA por Rt-PCR y se obtuvo serología positiva para leptospira por ELISA y microaglutinación. Sin embargo, no se pudo demostrar, desde el punto de vista laboratorial, coinfección real por FA y leptospira. Este caso de FA severa con desenlace no fatal enfatiza la importancia del diagnóstico sindrómico adecuado, y un tratamiento de soporte precoz y agresivo que puede salvar la vida del paciente.
Palabras clave: Fiebre Amarilla; Leptospirosis; Infección; Perú. (Fuente: DeCS BIREME).
ABSTRACT
Yellow fever (YF) and leptospirosis are under-diagnosed endemic zoonoses of the tropical regions of Africa and South America. Both may be clinically indistinguishable and present as an acute icterohemorrhagic febrile syndrome. We report the case of a 20-year-old male from the department of Amazonas who presented with nine days of disease characterized by multiorgan failure (neurological, renal, hepatic, respiratory, and hematological involvement). He received antibiotic treatment, as well as, transfusion, dialysis, hemodynamic, and ventilatory support. Despite the severity of the clinical condition, he evolved favorably. YF was confirmed by Rt-PCR and positive serology was obtained for leptospira by ELISA and microagglutination. However, from a laboratory point of view, real co-infection by yellow fever and leptospira could not be demonstrated. This case of severe YF with non-fatal outcome emphasizes the importance of adequate syndromic diagnosis, and early and aggressive supportive treatment that can save a patient's life.
Keywords: Yellow fever; Leptospirosis; Infection; Peru. (source: MeSH NLM).
INTRODUCCIÓN
El diagnóstico diferencial del síndrome febril icterohemorrágico agudo (SFIHA) incluye: leptospirosis, fiebre amarilla (FA), dengue, malaria, rickettsiosis, salmonelosis, hepatitis virales, bartonelosis, hantavirus, entre otras. (1,2). Se ha descrito coinfección de leptospirosis con dengue, malaria, chikungunya, Zika, tifus, etc. (1-7). La coinfección leptospirosis y FA es rara (2). Reportamos un caso de FA selvática y serología positiva para leptospira con evolución favorable.
REPORTE DE CASO
Varón de 20 años dedicado a la conducción de botes, procedente del caserío Puente Nieva, distrito Santa María de Nieva, provincia Condorcanqui, departamento Amazonas. Ingresa al Hospital Regional Lambayeque (HRL) referido de Bagua, niega inmunizaciones y enfermedades previas. Presentaba nueve días de enfermedad caracterizada por fiebre, cefalea, malestar, y artromialgias; seis días antes del ingreso se agrega ictericia, vómitos, y trastorno del sensorio (sopor); tres días antes del ingreso se agrega hipotensión, edema, equimosis, y convulsiones tónico-clónico generalizadas. El día previo al ingreso, se agrega anuria.
Al examen físico presentaba mal estado general, presión arterial 164/90 mm Hg, frecuencia respiratoria 28 rpm, frecuencia cardiaca 60 lpm, To: 38 °C, SatO2: 96% (FiO2: 0,21); facies: tóxica y abotagada; inyección conjuntival, edema generalizado, equimosis en extremidades y tronco, no petequias; no adenopatías; taquipnea, respiración de Kussmaul; ruidos cardiacos rítmicos, no soplos; ruidos hidroaéreos disminuidos, abdomen blando, depresible, doloroso a la palpación; en la evaluación neurológica se presentaba soporoso (Glasgow 12), agitado, sin déficit focal ni signos meníngeos.
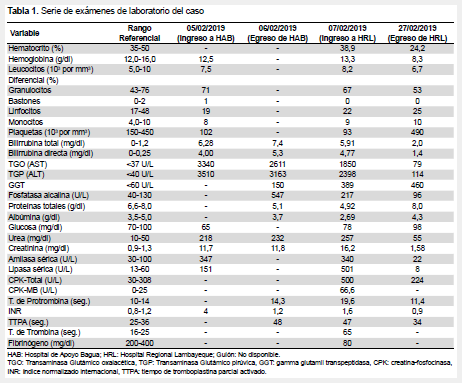
Los resultados de exámenes de laboratorio se muestran en la Tabla 1 y el análisis de gases arteriales en la Tabla 2. La Figura 1 muestra una secuencia de radiografías de tórax (RxT). La ecografía abdominal muestra un hígado de 19,4 cm; vías biliares, colédoco, y páncreas sin alteraciones; riñones aumentados de tamaño; bazo de 10,4 cm; líquido libre en cavidad abdominopélvica y derrame pleural izquierdo laminar.
Después de su ingreso a emergencia, ante un paciente con SFIHA procedente de una zona endémica, se sospechó FA y leptospirosis. Se inició tratamiento con suero salino, antibióticos (ceftriaxona más clindamicina), bicarbonato, solución «polarizante» (insulina más dextrosa), vitamina K, y transfusiones (crioprecipitado y plasma fresco congelado). Una hora después de su ingreso, inició hemodiálisis (HD). Dos días después de su ingreso, pasó a UCI, inició ventilación mecánica y vasopresores. Un día después, se aisló en cultivo de secreción bronquial E. Coli productora de beta-lactamasas de espectro extendido. Dado la presencia de infiltrados radiográficos alveolo-intersticiales pulmonares (Figura 1), se sospechó leptospirosis con afectación pulmonar y/o neumonía intrahospitalaria, rotándose los antibióticos (meropenem más vancomicina más doxiciclina). El paciente continuó con HD diarias y transfusiones. Pasó a medicina interna dos semanas después, y fue dado de alta una semana después. Los resultados de la prueba de microaglutinación (MAT) para leptospira y Rt-PCR para FA se obtuvieron varios días después del ingreso a UCI (Tabla 3). Se realizó serología para VIH, Zika, dengue, hepatitis A, B y C, VDRL/RPR, aglutinaciones febriles, gota gruesa para malaria, frotis para Bartonella, urocultivos, y hemocultivos, todos negativos. Las troponinas séricas, electrocardiograma y ecocardiograma fueron normales. El uroanálisis mostró: sangre/hemoglobina 3+, eritrocitos >100 por campo, leucocitos 8-10 por campo; cilindros, glucosa, esterasa, nitritos, cetonas, proteínas, todos negativos. La tomografía computada cerebral resultó normal.
DISCUSIÓN
FA y leptospirosis son zoonosis que constituyen problemas de salud pública reemergentes. La FA es causada por un Flavivirus. Su ciclo primario de transmisión (FA selvática) involucra monos y mosquitos (África: Aedes; Sudamérica: Haemagogus y Sabethes). La FA urbana, en África y Sudamérica, es transmitida por A. aegypti (1-4).
La FA evoluciona en tres fases: 1) infección, congestiva o roja; 2) remisión; 3) intoxicación, amarilla o icterohemorrágica. Aproximadamente 15% de pacientes hacen la tercera fase; de éstos fallecen 20% a 50% (1,3,4). La mortalidad por FA es mayor en Sudamérica (50%-70%), que en África (20%-30%). El tratamiento de FA es sintomático, incluyendo soporte y manejo de complicaciones (3,4), las cuales incluyen sobre infecciones (neumonía, parotiditis y sepsis).
El diagnóstico de FA se confirma por serología (ELISA de captura para IgM específica); PCR o aislamiento viral; o histopatología e inmunohistoquímica. Los métodos serológicos pueden dar reacciones cruzadas con otros flavivirus y vacunación previa (3,4). La FA selvática continúa siendo endémica en áreas de transmisión (cuencas hidrográficas), donde el virus se mantiene circulando. Desde el 2013 hasta la tercera semana epidemiológica del 2019, en eldepartamento de Amazonas –zona de procedencia del paciente– sólo se reportaron tres casos de FA, todos ocurridos el 2016 (9).
La leptospirosis es causada por espiroquetas patógenas del género Leptospira. Varios mamíferos son huéspedes naturales; los humanos adquieren la infección incidentalmente por exposición animal o ambiental. Son puertas de entrada: piel lesionada, mucosas y conjuntivas (5-8). La mayoría de casos son leves y autolimitados, o subclínicos. Los casos sintomáticos tienen un curso bifásico (leptospirémica o septicémica; e inmune o leptospirúrica), y cursan con síndrome febril inespecífico, enfermedad de Weil (EW) y/o neumonitis alveolar hemorrágica. La EW es la presentación más severa (letalidad 50%-70%), se presenta en 5%-10% de casos, e incluye síndrome de distrés respiratorio agudo (SDRA), hemorragia alveolar difusa (HAD), edema pulmonar, falla hepática, e injuria renal aguda (IRA) (2, 5-8, 10-12).
El diagnóstico de leptospirosis requiere un alto índice de sospecha. El MAT es considerado el «gold standard». Define caso confirmado un incremento ≥4 veces del título sérico de MAT (fase convaleciente respecto a la fase aguda). Un título único ≥1:800 es evidencia fuerte de infección reciente o actual; y un título ≥1:200 es evidencia sugestiva de infección reciente o actual (6-8). En nuestro paciente, obtuvimos un único título por MAT para L. interrogans serovar hardjo de 1:800 y para L. icterohaemorrhagiaede 1:200. De acuerdo a la Norma Técnica del Ministerio de Salud, una sola muestra con un título ≥1:800 podría confirmar el diagnóstico en la selva; y títulos de 1:100 a 1:400 confirman el diagnóstico en costa y sierra. Esto no se aplica a nuestro paciente pues procedía de la selva del departamento de Amazonas. En zonas endémicas, un único resultado positivo por MAT puede no ser suficiente para el diagnóstico, porque la prueba no distingue entre anticuerpos «recientes» (IgM) o «de memoria» (IgG), siendo necesario muestras pareadas para determinar seroconversión o incremento de los títulos (≥4 veces) (7).
L. interrogans serovar hardjo causa infecciones en ganado, no en humanos (5,6,8). Existen falsos positivos con sífilis, fiebre recurrente, enfermedad de Lyme y legionelosis (5,6,8). En nuestro paciente, a pesar que presentaba algunas características clínicas compatibles con EW, desde el punto de vista serológico, resulta difícil sustentar el diagnóstico de leptospirosis (5-8), y esimposible discernir, si se trató de una infección pasada, infección actual concomitante asintomática u oligosintomática, o un falso positivo.
Leptospirosis y FA pueden causar síndromes clínicamente indistinguibles. Sin embargo, algunos indicios clínicos pueden ser orientadores. Primero, los signos más precoces y característicos de leptospirosis son mialgias e inyección conjuntival; ambos presentes en nuestro paciente (1-4, 12). Segundo, la FA difiere de otras hepatitis virales en que los niveles séricos de TGO exceden a los de TGP, y la bilirrubina oscila entre 5-10 mg/dL (4, 6, 8). En EW, la ictericia está presente en casi todos los casos (12), la bilirrubina puede alcanzar los 80 mg/dL, y la transaminitis es leve a moderada (< 200 U/L) (3-6, 8,13). En el paciente, la TGP fue más alta que la TGO, probablemente por la ausencia de compromiso cardiaco y muscular; la bilirrubina directa fue ~5 mg/dL, alejando la posibilidad de EW.
Tercero, la EW cursa con injuria pulmonar severa. En FA, es inhabitual el compromiso pulmonar, salvo neumonía sobreagregada (1-4). Si bien, el compromiso respiratorio no correspondía a HAD ni SDRA, se sospechó en EW; aunque se demostró infección sobreagregada. Cuarto, en EW, el compromiso renal es prácticamente universal con insuficiencia renal aguda (IRA) no-oligúrica. El uroanálisis muestra proteinuria, piuria, hematuria, y cilindros granulosos. La hiperazoemia se presenta en ~50% de pacientes (6,8,10-12,14). La insuficiencia respiratoria e IRA se asocian a alta mortalidad. La HD precoz y diaria, como en el paciente, reducen la mortalidad en EW (10). La FA causa IRA oligoanúrica, hiperazoemia, y proteinuria (3,4,11,14). Quinto, la EW cursa con hiponatremia (~60%), normo o hipokalemia (40%-87%), e hipomagnesemia (~50%). El paciente cursó con hiperzoemia, anuria, e hiperkalemia (6,8,10-12,14). Por último, la EW cursa con nefromegalia con ecogenicidad parenquimal preservada (nefritis tubulointersticial) (12), similar al presente reporte.
Leptospirosis y FA son subdiagnosticadas debido a varias razones; un bajo índice de sospecha, falta de reconocimiento sindrómico (hasta 90% de casos de leptospirosis y 50% de FA, son oligosintomáticos) y la mayoría de casos ocurren en lugares remotos donde no hay disponibilidad de pruebas diagnósticas (1, 3-6). La alta letalidad de FA enfatiza la necesidad de fortalecer estrategias de prevención y control, siendo la inmunización la más eficaz (1, 3-6, 8, 15).
El presente caso es resaltante por tres aspectos: 1) la importancia de las muestras serológicas pareadas para diagnosticar leptospirosis; 2) tener un alto índice de sospecha ante un paciente con SFIHA procedente de una zona endémica; y 3) la necesidad de instalar un tratamiento de soporte precoz y agresivo que puede salvar la vida del paciente a pesar de su gravedad.
Contribuciones de los autores: EDMR, MVC contribuyeron por igual en la concepción, redacción, revisión y aprobación final del manuscrito.
Fuentes de financiamiento: Autofinanciado
Conflictos de interés: Los autores declaramos que no tenemos conflictos de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Fortaleza CMCB, Rocha R, Aragão VDN, Almeida RAMB. Syndromic surveillance and the reemergence of yellow fever in São Paulo state, Brazil. J Venom Anim Toxins Incl Trop Dis. 2009;15(2):186-9. doi: 10.1590/S1678-91992009000200002.
2. López E, Moros R , Cardona M, Zambrano J, Morón D, Hernández R, et al. Hallazgo de infecciones concomitantes leptospira-fiebre amarilla y leptospira-dengue en casos de pacientes fallecidos con síndrome febril icterohemorrágico en Venezuela años 2003-2004. Bol Venez Infectol. 2006;17(1):8-12.
3 . PAHO/WHO. Yellow Fever Epidemiological Update. Washington, DC: PAHO/WHO; 2017.
4. Monath TP. Yellow fever: an update. Lancet Infect Dis. 2001;1(1):11-20. doi: 10.1016/S1473-3099(01)00016-0
5. World Health Organization. Human Leptospirosis: Guidance for Diagnosis, Surveillance and Control. Geneva: WHO; 2003.
6. Zunino ME, Pizarro PR. Leptospirosis: a literature review. Rev Chilena Infectol. 2007;24(3):220-6. doi: /S0716-10182007000300008
7. Vilcarromero S, Marin J, Casapia M. Consideraciones para la definición de coinfección en casos de leptospirosis. Rev Peru Med Exp Salud Publica. 2019;36(2):360-1. doi: 10.17843/rpmesp.2019.362.4466.
8. Kobayashi Y. Clinical obser vation and treatment of leptospirosis. J Infect Chemother. 2001;7(2):59-68. DOI: 10.1007/ s1015610070059.
9. Centro Nacional de Epidemiología, Prevención y Control de Enfermedades. Ministerio de Salud. Número de casos de fiebre amarilla, Perú 2000 – 2019. [Internet]. Lima: Ministerio de Salud; 2019. [Citado el 07 de marzo de 2019] Disponible en: https://www.dge.gob.pe/portal/docs/vigilancia/sala/2019/SE07/f_amarilla.pdf.
10. Andrade L, Cleto S, Seguro AC. Door-to-dialysis time and daily hemodialysis in patients with leptospirosis: impact on mortality. Clin J Am Soc Nephrol. 2007;2(4):739-44. doi: 10.2215/CJN.00680207.
11. Burdmann EA, Jha V. Acute kidney injury due to tropical infectious diseases and animal venoms: a tale of 2 continents. Kidney Int. 2017;91(5):1033-46. doi: 10.1016/j.kint.2016.09.051
12. da Silva Junior GB, Srisawat N, Galdino GS, Macedo &S, Pinto JR, Farias GM, Alencar RL, Pires Neto Rd, Barros EJ, De Francesco Daher E. Acute kidney injury in leptospirosis: Overview and perspectives. Asian Pac J Trop Med. 2018;11:549-54. doi: 10.4103/1995-7645.244514
13. Talwani R, Gilliam BL, HowellC. Infectious diseases and the liver. Clin Liver Dis. 2011;15(1):111–30. doi:10.1016/j.cld.2010.09.002
14. Wiwanitkit S, Wiwanitkit V. Renal failure due to important arbovirus infection: A short summary. Saudi J Kidney Dis Transpl. 2017; 28(5):1206-8. doi: 10.4103/1319-2442.215124.
15. Paules CI, Fauci AS. Yellow Fever - Once Again on the Radar Screen in the Americas. N Engl J Med. 2017;376(15):1397-9. doi: 10.1056/ NEJMp1702172.
Correspondencia: Edinson Dante Meregildo Rodriguez
Dirección: Hospital Regional Lambayeque, Vía de Evitamiento Norte con Avenida El Progreso S/N.
Teléfono: +51 944226126
Correo electrónico:
dante_meregildo@hotmail.com
Recibido: 07/03/2019
Aprobado: 31/07/2019
En línea: 20/11/2019