
ORIGINAL BREVE
Características de la neoplasia quística mucinosa del páncreas en pacientes atendidos en un hospital nacional del Perú
Characteristics of pancreatic mucinous cystic neoplasm in patients treated at a national hospital in Peru
Fernando Revoredo-Rego 1,a, Gustavo Reaño-Paredes 1,a, José de Vinatea-de Cárdenas 1,a, José Arenas-Gamio 2,b, Luis Villanueva-Alegre 1,a, Fritz Kometter-Barrios 1,a, Jorge Tang-Sing 1,a, Mónica Uribe-León 1,a, Italo Landeo-Aliaga 3,c
1 Servicio de Cirugía de Páncreas, Bazo y Retroperitoneo, Hospital Nacional Guillermo Almenara. Lima, Perú.
2 Servicio de Anatomía Patológica, Hospital Nacional Guillermo Almenara Irigoyen. Lima, Perú.
3 Servicio de Gastroenterología, Hospital Nacional Guillermo Almenara Irigoyen. Lima, Perú.
a Médico Cirujano General; b Médico Anátomo-Patólogo; c Medico Gastroenterólogo.
RESUMEN
Con el objetivo de analizar las características clínico, patológicas y quirúrgicas de la Neoplasia Quística Mucinosa de páncreas (NQM), se realizó un análisis de los pacientes del servicio de Cirugía de Páncreas, Bazo y Retroperitoneo del Hospital Nacional Guillermo Almenara Irigoyen en Lima, Perú desde enero del 2009 hasta octubre del 2018. La presencia del estroma ovárico se usó como criterio diagnóstico de NQM. De diez pacientes con edad promedio de 47,8 años, nueve fueron mujeres, las lesiones estuvieron localizadas en el páncreas distal, el tamaño tumoral promedio fue de 88,6 mm. En todos los pacientes se realizó una pancreatectomía distal siendo tres laparoscópicas, no hubo reoperaciones ni fallecidos, dos pacientes tuvieron carcinoma invasor asociado. En conclusión, la presentación de NQM es mayor en mujeres de edad media siendo la localización en el páncreas distal y el porcentaje de malignidad bajo. La cirugía laparoscópica es una alternativa de manejo.
Palabras clave: Neoplasia Quística Mucinosa; Páncreas (fuente: DeCS BIREME).
ABSTRACT
In order to analyze the clinical, pathological, and surgical characteristics of pancreatic mucinous cystic neoplasm (MCN), an analysis of the patients from the Pancreas, Spleen, and Retroperitoneal Surgery Service of the Guillermo Almenara Irigoyen National Hospital in Lima, Peru, was performed from January 2009 to October 2018. The presence of ovarian stroma was used as a diagnostic criterion for MCN. From ten patients with an average age of 47.8 years, nine were women; the lesions were located in the distal pancreas, and the average tumor size was 88.6 mm. All patients underwent a distal pancreatectomy, three of which were laparoscopic; there were no reoperations or deaths; two patients had associated invasive carcinoma. In conclusion, the frequency of MCN is higher in middle-aged women, being the location in the distal pancreas and the percentage of malignancy is low. Laparoscopic surgery is a disease management option.
Keywords: Mucinous Cystic Neoplasm, Pancreas (source: MeSH NLM).
INTRODUCCIÓN
Actualmente, se sabe que existen cuatro lesiones precursoras del adenocarcinoma de páncreas, la neoplasia intraepitelial pancreática, la Neoplasia Papilar Mucinosa Intraductal (NPMI), la Neoplasia Quística Mucinosa (NQM) y la neoplasia tubulopapilar intraductal (NTPI) (1). La NQM del páncreas es una neoplasia que forma quistes con epitelio y que usualmente no se comunican con el sistema ductal pancreático. Esta neoplasia tiene dos componentes, un epitelio columnar productor de mucina asociado a un estroma tipo ovárico subepitelial (2-4). El estroma tipo ovárico consiste en células fusiformes densamente comprimidas con núcleos redondos o alargados y escaso citoplasma.
Este tipo de estroma es una característica distintiva de las NQM y su presencia es un requisito para el diagnóstico (2-7).
Las NQM son relativamente raras, representan aproximadamente el 8% de todas las lesiones pancreáticas quísticas resecadas (4) y se presentan casi exclusivamente en mujeres con una proporción de mujeres a hombres de veinte a uno (4,6,8). La edad promedio al diagnóstico es entre 40 a 50 años, con un rango de 14 a 95 años (4,8). Casi todos los casos se localizan en el cuerpo y cola del páncreas (4,6,8). La mayoría de las NQM son de crecimiento lento, asintomáticas (8) y de hallazgo incidental. Radiológicamente las NQM aparecen como lesiones solitarias, macroquísticas, uniloculares o multiloculares, con paredes gruesas y sin comunicación con el conducto pancreático principal (4).
Las NQM se categorizan de acuerdo con el grado de displasia del epitelio, y esta puede ser displasia de bajo grado (adenoma), grado intermedio (borderline) y alto grado (carcinoma in situ). Si existe un componente de carcinoma invasor, estas lesiones son denominadas como NQM asociadas a un carcinoma invasor (4,7). Este se encuentra presente en 2,9% a 33% de todas las NQM (9-13) y generalmente es un carcinoma tubular/ductal (8). La sobrevida a cinco años de las NQM resecadas no invasoras es de 100% y de las asociadas a carcinoma invasor es de 20 a 75% (8,13,14).
El presente estudio tiene como objetivo revisar las características clínicas y patológicas, así como los resultados quirúrgicos de los pacientes con diagnóstico de neoplasia quística mucinosa de páncreas.
EL ESTUDIO
De la base de datos del servicio de Cirugía de Páncreas, Bazo y Retroperitoneo del Hospital Nacional Guillermo Almenara Irigoyen (HNGAI) en Lima, Perú, se identificaron a los pacientes con diagnóstico anatomo-patológico de NQM de páncreas resecadas desde enero del 2009 hasta octubre del 2018 y se revisó la información clínico-patológica, radiológica y de morbimortalidad postoperatoria. La presencia del estroma ovárico se usó como criterio diagnóstico de NQM.
Los tumores fueron clasificados como displasia de bajo grado, displasia de grado intermedio, displasia de alto grado y NQM con carcinoma invasor (4,7). En la displasia de bajo grado, el epitelio columnar tiene cambios mínimos en su arquitectura y no hay mitosis. En la displasia de grado intermedio hay cambios de la arquitectura y atipia citológica con proyecciones papilares o invaginaciones en forma de cripta, pseudoestratificación celular y mitosis esporádicas. La displasia de alto grado está caracterizada por cambios en la arquitectura significantes, atipia citológica, formación de papilas, pleomorfismo y nucleolos prominentes, así como mitosis frecuentes (4,7). Para el análisis, las NQM con displasia de bajo, intermedio y alto grado fueron agrupadas como «no invasoras» y las NQM con carcinoma invasor como «invasoras» (7).

Valores de antígeno sérico tumoral (CA 19-9) menor o igual a 37 U/mL fueron considerados como normales (15). En el estudio de líquido intra quístico, se consideró valores de CEA mayores a 192 ng/mL, para el diagnóstico de neoplasia de neoplasis mucinosa (3,16,17).
La morbilidad posoperatoria se definió como toda complicación posquirúrgica local o sistémica dentro de los 90 días del posoperatorio. La fístula pancreática se definió como aquella clínicamente relevante grado B o C (International Study Group on Pancreatic Fistula) (18). La colección intrabdominal se definió como toda colección de más de 5 cm de diámetro en la tomografía o ecografía después del tercer día posquirúrgico. La mortalidad posoperatoria fue definida como la ocurrida dentro de los 90 días posquirúrgicos o durante la misma hospitalización.
El procesamiento de datos se realizó con el programa Microsoft Excel. Para las variables cuantitativas se calculó la mediana. Las variables cualitativas se expresaron en frecuencias absolutas y relativas.
El estudio contó con la autorización de la Unidad de Investigación y Docencia del HNGAI.
RESULTADOS
Se identificaron diez pacientes con resecciones pancreáticas por NQM (nueve del sexo femenino y uno del masculino). La edad promedio de presentación fue de 49 años. Un 90% de los pacientes fueron sintomáticos, siendo el síntoma más frecuente el dolor. Sólo un paciente con NQM asociada a carcinoma invasor tuvo un valor de CA 19-9 superior a 37 U/L (145 U/L) (Tabla 1).
Para el diagnóstico el 100% de los pacientes contó con una tomografía multicorte y un 40% con resonancia magnética. Se realizó eco endoscopia con punción sólo en dos pacientes (20%). El valor del CEA fue mayor a 200 ng/mL en ambos casos.
El 100% de las lesiones se encontraron en el cuerpo o cola del páncreas. La lesión de menor tamaño fue de 1,6 cm y la de mayor tamaño fue de 20 cm; ambas correspondieron a NQM no invasoras (Figura 1).
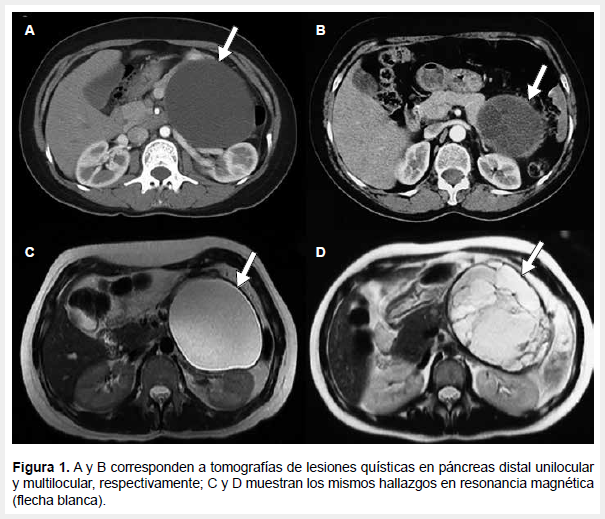
Para la resección de las NQM se realizó una pancreatectomía distal; abierta (70%) o laparoscópica (30%). Se realizó preservación esplénica sólo en un caso (NQM no invasora). En un caso se resecó estómago y glándula adrenal izquierda (NQM con displasia de alto grado). Una paciente del grupo de los procedimientos abiertos tuvo una fístula pancreática B y absceso residual. La mortalidad fue de 0% y la estancia hospitalaria general fue de ocho días. (Tabla 1).
En el diagnóstico patológico final, 8 pacientes (80%) correspondieron a NQM no invasora y 2 pacientes (20%) correspondieron a NQM invasora. De los pacientes con NQM no invasora, 4 (50%) correspondieron a displasia de bajo grado, 2 (25%) a displasia de grado intermedio y 2 (25%) a displasia de alto grado. El promedio de ganglios resecados fue de 5,8 (rango: 2 a 11). Ningún ganglio resecado tuvo compromiso metastásico. Todos los bordes de sección estuvieron libres de enfermedad.
En cinco pacientes se pudo realizar inmunohistoquímica; de ellos uno marcó para citoqueratina (CK7), dos marcaron para CEA, cinco marcaron para Receptor de Progesterona, tres marcaron para Receptor de Estrógeno, dos marcaron para α-inhibina y uno marcó para calretinina (Figura 2).
DISCUSIÓN
La NQM del páncreas es una patología presente en Perú, siendo este estudio la primera serie de casos que muestra sus características clínico y patológicas.
En todos los pacientes de la serie se demostró la presencia de estroma tipo ovárico, aún en el caso del varón. La mayor presentación en mujeres concuerda con lo publicado en otras series, en las que reportan una prevalencia de NQM en mujeres de 95% (6,8,14). El 90% de los pacientes tuvieron síntomas, porcentaje mayor a lo publicado en otras series, donde encontraron que la mayoría de los pacientes fueron asintomáticos (12-14).
El marcador sérico tumoral CA19-9 estuvo elevado sólo en un paciente. Este paciente correspondió a una NQM invasora, hallazgo similar a lo descrito por Park (14), quien además reporta una sensibilidad de 55,6% y una especificidad de 80,2% para este marcador tumoral, en lesiones malignas.
La tomografía y la resonancia magnética son exámenes realizados para el diagnóstico de estas lesiones (6). Actualmente la resonancia magnética con pancreatocolangiografía es el método de elección para la evaluación de los quistes pancreáticos, debido a que facilita el reconocimiento de signos que sugieran malignidad como nódulos murales que captan contraste, lesiones grandes (mayor a 6 cm), calcificación periférica de la pared del quiste, grosor irregular en las paredes y excrecencias papilares que se proyectan al interior del quiste (1,4,6). La eco endoscopía con o sin punción, se realiza cuando la tomografía o la resonancia magnética no son determinantes.
Valores del antígeno carcino embrionario (CEA) > 192 ng/mL, en el líquido intraquístico, muestra una sensibilidad de 79% para diferenciar una neoplasia mucinosa de una no mucinosa (7,16,17). Sin embargo, no diferencia una neoplasia benigna de una maligna (4,7). En la presente serie realizamos dos eco endoscopías con punción del quiste, debido a duda diagnóstica. En ambos casos el CEA resulto elevado.
El diagnóstico diferencial de la NQM, incluye otras neoplasias quísticas del páncreas y el pseudoquiste. La mejor forma de obtener un diagnóstico más exacto es la evaluación conjunta de los hallazgos clínicos, radiológicos, serológicos y morfológicos (4). Para el diagnóstico diferencial de la neoplasia quística del páncreas, además de la localización de la lesión y el aspecto morfológico, ayuda mucho el valor de CEA intraquístico. Las neoplasias quísticas serosas generalmente tienen un valor de CEA por debajo de 5 ng/mL (17). La característica radiológica que diferencia una NMQ de una NPMI tipo rama, es la ausencia de comunicación con el sistema ductal pancreático de la NQM (7). Finalmente, el diagnóstico diferencial con el pseudoquiste de páncreas puede ser difícil por los cambios degenerativos que sufre la NQM y muchas veces se hace necesario un muestreo extenso de la pieza operatoria para llegar al diagnóstico (4).
La gran mayoría (93 a 99%) de NQM se localizan en el cuerpo y cola del páncreas (2,13,14), por este motivo, la cirugía más frecuentemente realizada es la pancreatectomía distal (88 a 96%) (2,14). Todas las NQM de esta serie se localizaron en el cuerpo y cola del páncreas siendo resecadas mediante una pancreatectomía distal. La pancreatectomía distal laparoscópica se asocia a menor sangrado intraoperatorio, menos infección de herida y menor estancia hospitalaria (19).
En cuanto a las complicaciones, sólo una paciente del grupo de las pancreatectomías distales abiertas, cursó con una fístula pancreática B y un absceso residual, que se manejó con drenaje percutáneo y antibioticoterapia. Ninguno requirió reoperación y la mortalidad fue nula, siendo estos resultados similares a lo reportado por Crippa (3).
El rango de carcinoma invasor asociado de las NQM fue mucho más bajo que lo reportado en otras lesiones, lo que sugiere que las NQM demoran más en transformarse en lesiones malignas o que tienen un menor potencial maligno (6). No existen datos concluyentes sobre la terapia neoadyuvante o adyuvante para la NQM maligna. Actualmente las opciones terapéuticas se han extrapolado del manejo del adenocarcinoma de páncreas, que típicamente incluyen gemcitabina o fluorouracilo (20).
La limitación más importante del trabajo es el número reducido de pacientes que no nos permite realizar comparaciones entre las NQM no invasoras y las invasoras para poder entender el comportamiento de esta patología.
En conclusión, la neoplasia quística mucinosa del páncreas se define por la presencia de estroma tipo-ovárico. Las características de esta serie ratifican la presentación mayoritaria en mujeres de edad media, la localización en el páncreas distal y el bajo porcentaje de malignidad. Se recomienda la resección en todos los casos, por ser una enfermedad premaligna. Así mismo, el grupo etario de los pacientes y la localización en el páncreas distal de estas lesiones, permiten una cirugía segura; incluso con los beneficios del abordaje mínimamente invasivo.
Contribuciones de los autores: FRR, GRP y JdVdC han participado en la concepción del artículo, la recolección de datos, su redacción, análisis e interpretación de datos, revisión crítica y aprobación de la versión final. JAG, LVA, FKB, JTS, MUL, ILA han participado en la concepción del artículo, su redacción, análisis e interpretación y aprobación de la versión final.
Fuentes de financiamiento: autofinanciado
Conflictos de interes: no hay conflicto de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. Fukushima N, Zamboni G. Mucinous cystic neoplasms of the pancreas: update on the surgical pathology and molecular genetics. Semin Diagn Pathol. 2014; 31(6):467-474. doi: 10.1053/j.semdp.2014.08.007.
2. Crippa S, Salvia R, Warshaw AL, Dominguez I, Bassi C, Falconi M, et al. Mucinous cystic neoplasms of the pancreas is not an agresive entity: lessons from 163 resected patients. Ann Surg. 2008; 247(4):571-579. doi: 10.1097/SLA.0b013e31811f4449.
3. Werner J, Fritz S, Büchler MW. Intraductal papillary mucinous neoplasms of the pancreas – a surgical disease. Nat Rev Gastroenterol Hepatol. 2012;9(5):253-259. doi: 10.1038/nrgastro.2012.31.
4. Zamboni G, Fukushima N, Hruban RH, Kloppel G. Mucinous cystic neoplasms of the páncreas. En: Bosman FT, Carneiro F, Hruban RH, Theise ND, editores. WHO classification of tumors of the digestive system. 4a edic. Lyon: WHO Press; 2010: 300 – 303.
5. Tanaka M, Chari S, Adsay V, et al. International Consensus for management of intraductal papillary mucinous neoplasms and mucinous cystic neoplasms of the pancreas. Pancreatology. 2006;6(1-2):17–32. doi: 10.1159/000090023 .
6. Nilsson LN, Keane MG, Shamali A, Bocos JM, vs Zanten MM, Antila A, et al. Nature and management of pancreatic mucinous cystic neoplasm (MCN): a systematic review of the literature. Pancreatology. 2016;16(6):1028–1036. doi: 10.1016/j.pan.2016.09.011.
7. Tanaka M, Fernández-del Castillo C, Adsay V, Chari S, Falconi M, Jang JY, et al. International consensus guidelines 2012 for the management of IPMN and MCN of the pancreas. Pancreatology. 2012;12(3):183-197. doi: 10.1016/j.pan.2012.04.004.
8. Testini. M, Gurrado A, Lissidini G, Venezia P, Greco L, Piccinni G. Management of mucinous cystic neoplasms of the pancreas. World J Gastroenterol. 2010;16(45):5682-5692. doi: 10.3748/wjg.v16.i45.5682.
9. Go BK, Tan YM, Chung FY, Chow PK, Cheow PCh, Wong WK, et al. A review of mucinous cystic neoplasms of the pancreas defined by ovarian-type stroma: clinicophatological features of 344 patients. World J Surg. 2006;30(12):2236–2245. doi: 10.1007/s00268-006-0126-1
10. Jang KT, Park SM, Basturk O, Bagci P, Bandyopadhyay S, Stelow EB, et al. Clinicopathologic characteristics of 29 invasive carcinomas arising in 178 pancreatic mucinous cystic neoplasms with ovarian-type stroma. Implications for management and prognosis. Am J Surg Pathol. 2015;39(2):179-187. doi: 10.1097/PAS.0000000000000357
11. Baker ML, Seely ES, Pai R, Suriawinata AA, Mino-Kneudson M, Zamboni G, et al. Invasive mucinous cystic neoplasms of the pancreas. Ex Mol Pathol. 2012;93(3):345–349. doi: 10.1016/j.yexmp.2012.07.005
12. Le Baleur Y, Couvelard A, Vullierme MP, Sauvanet A, Hammel P, Rebours V, et al. Mucinous cystic neoplasms of the pancreas: definition of preoperarive criteria for high risk lesions. Pancreatology. 2011;11(5):495-499. doi: 10.1159/000332041
13. Yamao K, Yanagisawa A, Takahashi K, Kimura W, Doi R, Fukushima N, et al. Clinicopathological features and prognosis of mucinous cystic neoplasms with ovarian-type stroma: a multi-institutional study of the Japan Pancreas Society. Pancreas. 2011;40(1):67-71. doi: 10.1097/MPA.0b013e3181f749d3
14. Park JW, Jang JY, Kang MJ, Kwon W, Chang YR, Kim SW. Mucinous cystic neoplasm of the pancreas: is surgical resection recommended for all surgical fit patients?. Pancreatology. 2014;14(2):131–136. doi: 10.1016/j.pan.2013.12.006
15. Fritz S, Hackert T, Hinz U, Hartwig W, Büchler MW, Werner J. Role of serum carbohydrate antigen 19-9 and carcinoembryonic antigen in distinguishing between benign and invasive intraductal papillary mucinous neoplasm of the pancreas. Br J Surg. 2011; 98(1):104–110. doi: 10.1002/bjs.7280
16. Brugge WR, Lewandrowski K, Lee-Lewandrowski E, Centeno BA, Szydlo T, Regan S, del Castillo CF, Warshaw AL. Diagnosis of pancreatic cystic neoplasms: a report of the cooperative pancreatic cyst study. Gastroenterology. 2004;126(5):1330–1336. doi: 10.1053/j.gastro.2004.02.013
17. Park WG, Mascarenhas R, Palaez-Luna M, Smyrk TC, O’Kane D, Clain JE, et al. Diagnostic performance of cyst fluid carcinoembryonic antigen and amylase in histologically confirmed pancreatic cysts. Pancreas. 2011;40(1):42–45. doi: 10.1097/MPA.0b013e3181f69f36
18. Bassi C, Marchegiani G, Dervenis C, Sarr M, Hilal MA, Adam M, et al. The 2016 update of the International Study Group (ISGPS) definition and grading of postoperative pancreatic fistula: 11 years after. Surgery. 2017;161(3):584–591. doi: 10.1016/j.surg.2016.11.014
19. De Rooij T, Klompmaker S, Abu Hilal M, Kendrick ML, Busch OR, Besselink MG. Laparoscopic pancreatic surgery for benign and malignant disease. Nat Rev Gastroenterol Hepatol. 2016;13(4):227–238. doi: 10.1038/nrgastro.2016.17
20. Shimada K, Iwase K, Aono T, Takeda S, Yoshida H, Koma M, Nomura M, et al. A case of advanced mucinous cystadenocarcinoma of the pancreas with peritoneal dissemination responding to gemcitabine. Gan To Kagaku Ryoho. 2009;36(6):995-998.
Correspondencia:
Fernando Revoredo Rego
Correo electrónico:
fernandorevoredo@hotmail.com
Recibido: 11/03/2019
Aprobado: 04/09/2019
En línea: 03/12/2019