Rosario Rojas
Candy Ruiz
Jasmin Hurtado
ORIGINAL BREVE
Actividad antimicrobiana de Streptomyces sp. 6E3 aislado de concentrado de
mineral*
Streptomyces sp. 6E3 antimicrobial
activity isolated from mineral concentrate
Angela Ampuero
![]() 1,Químico farmacéutico
1,Químico farmacéutico
Rosario Rojas ![]() 2, médico cirujano, PhD en Química Médica y
Farmacognosia
2, médico cirujano, PhD en Química Médica y
Farmacognosia
Candy Ruiz ![]() 2, químico, magister en Química
2, químico, magister en Química
Jasmin Hurtado ![]() 1, microbiólogo, doctor en Ciencias
1, microbiólogo, doctor en Ciencias
1
Laboratorio de Biotecnología
Ambiental, Laboratorios de Investigación y Desarrollo, Facultad de Ciencias y
Filosofía, Universidad Peruana Cayetano Heredia, Lima, Perú.
2 Unidad de Investigación en
Productos Naturales, Laboratorios de Investigación y Desarrollo, Facultad de
Ciencias y Filosofía, Universidad Peruana Cayetano Heredia, Lima, Perú.
* El presente estudio forma
parte de la tesis: Ampuero A. Evaluación de actividad
antibacteriana de Streptomyces sp. 6E3 aislado de minerales frente a Staphylococcus aureus meticilino resistente. [Tesis de Licenciatura]. Lima:
Facultad de Ciencia y Filosofía. Universidad Peruana Cayetano Heredia; 2016.
RESUMEN
El objetivo de este estudio fue determinar la
actividad antimicrobiana de un cultivo de Streptomyces
sp. 6E3 aislado de minerales frente a diferentes
cepas patógenas, producir un extracto y estimar la concentración mínima
inhibitoria (CMI) de las fracciones contra Staphylococcus
aureus resistente a meticilina
(SARM). La cepa Streptomyces sp. 6E3 mostró actividad antimicrobiana
principalmente contra Staphylococcus aureus (S. aureus). Cinco de
las seis fracciones presentaron actividad antimicrobiana y la más efectiva dio
una CMI de 0,88 ug/mL
frente a S. aureus ATCC 33862, 0,44 ug/mL frente a S. aureus ATCC 43300 y 1,76 ug/mL frente a S. aureus cepa
SARM. Streptomyces sp.
6E3 tiene un potencial antimicrobiano frente a cepas de S. aureus resistentes a meticilina y no resistentes, siendo de interés la
realización de más estudios sobre sus metabolitos activos.
Palabras clave: Streptomyces; Minerales; Agentes Antiinfecciosos; Extractos Celulares; Bacteria; Staphylococcus aureus; Productos Biológicos; Pruebas de Sensibilidad Microbiana (fuente: DECS BIREME).
ABSTRACT
The objectives of this study were
to determine the antimicrobial
activity of a culture of Streptomyces
sp. 6E3 isolated from minerals against
different pathogenic strains, to produce an extract and to estimate the minimum inhibitory
concentration (MIC) of the fractions against methicillin-resistant Staphylococcus
aureus (MRSA). Streptomyces
sp. 6E3 showed antimicrobial activity primarily against Staphylococcus aureus
(S. aureus). Five of
the six fractions
presented antimicrobial activity and the most effective gave a MIC of 0.88 ug / mL against S. aureus ATCC 33862, 0.44 ug / mL against S. aureus ATCC 43300 and 1.76 ug
/ mL vs. a S. aureus MRSA strain. Streptomyces sp. 6E3 has an antimicrobial potential against S. aureus strains resistant to methicillin and non-resistant, being of interest carrying out of more studies on its active metabolites.
Keywords: Streptomyces; Minerals, Anti-infective agents; Cell extracts; Bacteria; Staphylococcus aureus; Biological Products; Microbial Sensibility Tests (Source: MeSH NLM).
INTRODUCCIÓN
La resistencia a los
antibióticos es una de las más importantes amenazas para la salud mundial, la
seguridad alimentaria y el desarrollo de los países. Actualmente se están
desarrollando diferentes alternativas para combatir a las cepas microbianas que
presentan multirresistencia y una de ellas consiste
en la búsqueda de nuevos metabolitos secundarios con bioactividad
antimicrobiana.
Dentro de los microorganismos
productores de compuestos bioactivos, los Streptomyces son el género más importante de
bacterias que producen compuestos bioactivos como policétidos, péptidos e híbridos de policétidos-péptidos
que han sido caracterizados con diferentes actividades biológicas como
antibacterianas, antifúngicas y anticancerosas (1).
Aproximadamente el 60% de
todos los antibióticos conocidos contra bacterias grampositivas
y gramnegativas han sido aislados de Streptomycetes, entre ellos tetraciclina, daptomicina y cloranfenicol (2). En los últimos años
y con el fin de encontrar nuevos metabolitos con actividad antimicrobiana a
partir de estos microorganismos, se ha empezado a realizar el aislamiento de
estas bacterias a partir de ambientes poco explorados como el mar, las plantas (3,4) e inclusive los minerales (5).
En Perú se han encontrado
especies, en ambientes marinos, con actividad antibacteriana en cepas de Staphylococcus aureus resistente
a meticilina (SARM) y Enterococcus
faecalis resistente a vancomicina (6) y una cepa capaz de actuar frente a cepas
patógenas resistentes a betalactámicos (7).
El objetivo de este estudio es
determinar la actividad antimicrobiana de cultivos y extractos metabólicos de Streptomyces sp.
6E3 frente a diferentes enterobacterias patógenas, Staphylococcus aureus
y Candida sp.
|
MENSAJES CLAVE |
|
Motivación para realizar el estudio: La creciente resistencia microbiana a los
antibióticos debido al uso indiscriminado de estos, requiere el desarrollo de
nuevas alternativas, como el uso de microorganismos aislados de ambientes
poco estudiados. Principales hallazgos: Se ha podido identificar una cepa de Streptomyces 6E3 aislada de minerales con
capacidad de inhibir Staphylococcus aureus resistente a meticilina. Implicancias: La obtención de microorganismos que podrían
convertirse en una alternativa de tratamiento, ayudaría a resolver el
problema de salud pública que estamos enfrentando. |
EL ESTUDIO
Este estudio es de tipo
experimental en el que se analizó la actividad antimicrobiana de la cepa de Streptomyces sp.
6E3, la cual fue aislada a partir de minerales y previamente identificada,
fenotípica y genéticamente (5). Las cepas a las que fue enfrentada Streptomyces sp.
6E3 fueron: Escherichia coli
ATCC 25922, Staphylococcus aureus ATCC 33862, Proteus
mirabilis ATCC 12453, Salmonella typhimurium ATCC 25241, Shigella
sonnei ATCC 25931, Candida
albicans ATCC 90028, Staphylococcus
aureus ATCC 43300 (SARM) y Staphylococcus
aureus (SARM) de origen clínico, provenientes del
Instituto de Medicina Tropical Alexander Von Humboldt, de Lima.
La fase de producción se
determinó por medio de la prueba de actividad antimicrobiana, en la cual se usó
el método de doble capa de Singh et al. (8) Se enfrentaron cultivos de Streptomyces
sp. 6E3 sembrados en agar XGAL en el
centro de la placa de 3, 5, 7 y 10 días de crecimiento a cepas de Escherichia coli
ATCC 25922 y Staphylococcus aureus ATCC 33862. En estas etapas de crecimiento
también se realizaron observaciones microscópicas y macroscópicas del
crecimiento de la colonia.
Para el cribado de la
actividad antimicrobiana de la cepa, se utilizó el método de doble capa de
Singh et al. (8) El experimento
fue llevado a cabo por duplicado frente a cada cepa patógena. Para los
extractos y las fracciones, se empleó el método de difusión en agar,
modificado por Rojas et al. (9)
Para la preparación de los
extractos se utilizó el solvente acetato de etilo. Se sembraron 30 placas de
XGAL y, con ayuda de una micropipeta, se añadió al
cultivo 3 mL del solvente. Se procedió al barrido de
las células humedecidas por el solvente y el sobrenadante, los que se
colectaron en tubos Falcon. Se homogenizó el
contenido de los tubos y se agitó con ayuda de ultrasonido por 15 minutos
a temperatura ambiente. Los tubos con las células lisadas fueron centrifugados
por 10 minutos a 5000 rpm. Luego se retiró el sobrenadante y se
procedió a evaporar el solvente acetato de etilo, primero en un rotavapor con una presión menor a 250 milibar
y en baño maría a 40 °C y luego con una corriente de gas nitrógeno hasta
obtener 147 mg de extracto, el cual fue mantenido a ‒20 °C hasta su
uso.
A este extracto se le realizó
una cromatografía de capa fina de fase reversa (TLC Silicagel
60 RP18 de Merck®) con una fase móvil de acetonitrilo:agua en proporción de 2:1 para observar el número de
compuestos bajo una lámpara UV a 254 nm y
366 nm. Además, se realizó un antibiograma por
el método de difusión con discos para observar si aún se tenía el efecto
antimicrobiano deseado.
Para el fraccionamiento del
extracto, se utilizó una columna de vidrio empacada con gel de sílice RP60 de
Merck®, lavada previamente con metanol. Se disolvieron 50 mg del extracto en
400 uL de acetato de etilo. Las fases móviles fueron
20 mL de acetonitrilo y
agua en proporciones de 1:1 (v/v), 1:2, 6:4, 7:3, 8:2, 9:1 y 10:0. Se
recolectaron las fracciones en tubos de ensayo hasta un volumen de 4 mL y se les realizó una cromatografía de capa fina de fase
reversa, usando una fase móvil de acetonitrilo:agua, en proporción 3:1.
Las cromatografías fueron
observadas bajo luz UV de 366 nm. Se reunieron
las fracciones que presentaron perfiles cromatográficos
similares y se procedió a eliminar el solvente por medio del rotaevaporador. Se obtuvieron al final seis fracciones
denominadas A, B, C, D, E y F, a las cuales se les realizó nuevamente una
cromatografía de capa fina y un antibiograma según el método de difusión con
discos para observar cuál de las fracciones tiene el efecto antimicrobiano.
Se utilizó el método de Wiegan et al. (10) para determinar la concentración mínima
inhibitoria (CMI). Como control positivo, se usó vancomicina para las cepas de
SARM y penicilina para Staphylococcus aureus, las cuales iban en un rango de 120 a 0,06 ug/mL. El control negativo fue un
caldo Mueller Hinton
inoculado con cepa patrón, el blanco fue un caldo estéril. Se disolvieron las
seis fracciones en 400 uL de dimetilsulfóxido
(DMSO) para preparar soluciones stock y luego realizar las diluciones
respectivas. Las cantidades usadas de las fracciones para hacer las soluciones
madre fueron los siguientes: 0,5 mg de la fracción B; 0,5 mg de la fracción C;
0,5 mg de la fracción D; 2 mg de la fracción E, y 1 mg de la fracción F.
La microplaca
fue incubada a 37 °C por 24 horas. Los resultados se obtuvieron por medio de
dos métodos: a) se utilizó cloruro de trifeniltetrazolio,
con el cual el viraje de la coloración del contenido de los pozos a rojo indicó
crecimiento microbiano, y b) la microplaca fue
puesta en una lectora de ELISA, en la cual solo se midió la turbidez. La CMI
fue encontrada por medio de curvas de absorbancia versus concentración, según
la metodología de Devienne et al. (11)
Se realizó el análisis
estadístico descriptivo para analizar los resultados de las pruebas de
actividad antimicrobiana por el método de doble capa y de difusión con discos.
HALLAZGOS
Se observó que la actividad
antimicrobiana se dio en los cultivos de 7 y 10 días, lo cual se relacionó con
la observación macroscópica de una sustancia rojiza en la colonia, mientras
que microscópicamente se advirtieron esporas, lo cual indicó el fin de su fase micelial (Figura 1).
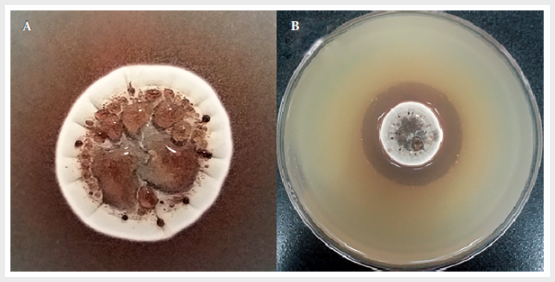
Figura
1.
Determinación de la fase de producción. Observación macroscópica de la colonia
de Streptomyces
sp. 6E3 a los siete días (A). Actividad
antimicrobiana de la cepa frente Staphylococcus aureus a los siete días (B)
En el cribado con las cepas Staphylococcus aureus
ATCC 33862, Staphylococcus aureus ATCC 43300 (SARM) y Staphylococcus
aureus cepa clínica (SARM), se observaron la
presencia de halos de inhibición de 21,5 mm a 42 mm de diámetro. Con todas las
otras cepas se encontraron halos de inhibición de 1,5 mm a 3 mm, razón por la
cual se prosiguió con las tres cepas de Staphylococcus
aureus.
Se obtuvieron 141,9 mg de
extracto, de los cuales se obtuvieron seis fracciones denominadas A, B, C, D, E
y F y se pudieron identificar seis manchas cromatográficas
numeradas 1, 2, 3, 4, 5 y 6, respectivamente. La cromatografía de capa fina
realizada a las fracciones corroboró la presencia de las mismas manchas cromatográficas presentes en el extracto bruto (Figura 2).
1-6: manchas cromatográficas;
A-F: fracciones; X: extracto bruto.

Figura
2.
Cromatografía de capa fina de las seis fracciones observadas bajo lámpara UV a
254 nm (A) y a 366 nm (B)
Se determinó la actividad
antibacteriana de las fracciones, observándose halos de inhibición de 8 a 15 mm
frente a las cepas de Staphylococcus aureus. La fracción D fue la que presentó la mejor
actividad, así como una CMI más baja a diferencia del resto de las fracciones
(Tabla 1 y figura 3). La fracción no mostró ninguna actividad con el método de
difusión con disco, razón por la cual no se determinó la CMI.
Tabla
1.
Actividad antimicrobiana de las fracciones del extracto de Streptomyces sp.
6E3 frente a cepas de Staphylococcus aureus por medio
del método de difusión con discos y de microdilución.
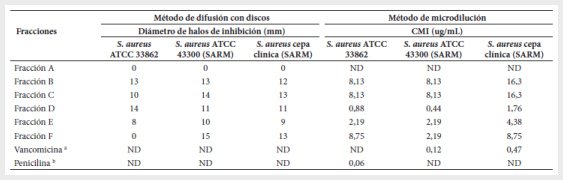
ND: no determinado; CMI:
concentración mínima inhibitoria
a Se utilizó como
control positivo para las cepas S. aureus resistente a meticilina
b Se utilizó como
control positivo para la cepa de S. aureus ATCC 33862
FB-FF: fracciones; CP: control
positivo (vancomicina); CN: control negativo (caldo Mueller
Hinton inoculado); B: blanco (caldo Mueller Hinton estéril).
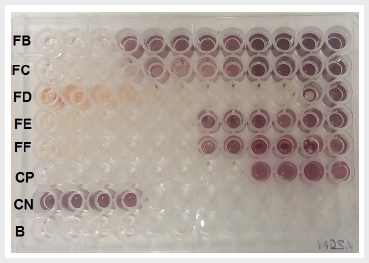
Figura
3.
Concentración mínima inhibitoria de las cinco fracciones frente a Staphylococcus aureus ATCC
43300 (SARM)
DISCUSIÓN
Los compuestos bioactivos son mayormente producidos como metabolitos
secundarios y algunos de ellos pueden también pueden ser pigmentos (12).
Muchos Streptomyces producen compuestos
pigmentados con actividad antimicrobiana, como los antibióticos actinorrodina (13) y roseoflavina (14). La
coloración rojiza observada en los cultivos de siete días podría estar relacionada
con la producción de algún compuesto antimicrobiano producido por esta
bacteria.
La cepa de Streptomyces
utilizada en esta investigación, es de origen mineral, específicamente de un
concentrado de arsenopirita (5).
Esto demuestra que los ambientes mineros son de mucha importancia para la
búsqueda de cepas con potencial bioactividad, lo
mismo ha sido demostrado en un estudio, en el cual Pleurostomophora
sp. aislado de minerales
produjo compuestos antiinflamatorios (15).
Empleando el método de doble
capa (Tabla 1) se vio que la cepa de Streptomyces,
aunque mostró inhibir el crecimiento de las cepas gramnegativas,
la mayor actividad la obtuvo frente al grupo de grampositivas
que estuvo representado por las tres cepas de Staphylococcus
aureus, dentro de las que se incluyen a las
resistentes a meticilina. Se han aislado Streptomyces de ambientes poco estudiados, como el
marino, aislándose la cepa RT‒408 productor de un policétido (16) y Streptomyces
asociados a un coral (17) que inhibe a cepas grampositivas,
entre ellas SARM.
El proceso de extracción fue
realizado a partir del barrido de la superficie de la placa de cultivo, y es
posible que este método, haya permitido recuperar los metabolitos liberados
por las bacterias al medio o presentes en las células.
Para el caso de esta cepa, por
medio de la cromatografía de capa fina se han visualizado al menos seis manchas
cromatográficas (Figura 2). Muchas de las especies
del género Streptomyces producen más de
un metabolito dependiendo del extracto obtenido, el cual está en relación con
el solvente usado y de la capacidad de arrastre según su polaridad y la de los
compuestos (18,19).
De los metabolitos encontrados, solo algunos tendrían actividad antimicrobiana.
En Streptomyces coelicolor,
además de producir la actinorrodina también produce
otros compuestos relaciones con actividad antimicrobiana (13) y en Streptomyces
violaceusniger se produce un antibacteriano y un antifúngico (20).
Los resultados obtenidos de la
prueba de CMI de las fracciones muestran que la fracción D es la de mayor
actividad. Se han separado dos manchas cromatográficas
en esta fracción en mayor concentración, esto indicaría una mayor concentración
de metabolitos activos con actividad antimicrobiana frente a las cepas de Staphylococcus aureus.
Se ha reportado que el
extracto de Streptomyces sp. ERI-3 produce inhibición de Staphylococcus
aureus con una CMI de 0,25 mg/mL
(19),
el compuesto 2 aislado de Streptomyces sp. SPG278 tiene una CMI de 256 ug/mL contra Staphylococcus
aureus (N6) y el extracto de Streptomyces
M10-77 de origen marino tiene una CMI de 7,9 ug/mL (6); mientras que, la fracción D de Streptomyces sp.
6E3 produjo una CMI de 0,44 ug/mL
frente a Staphylococcus aureus
ATCC 43300 (SARM).
Entre las limitaciones del estudio se
considera el número de repeticiones de las pruebas. Además, no se pudo
determinar si la actividad antimicrobiana del extracto estaba en un compuesto
dentro de la célula o era excretado. Asimismo, como en cada fracción del
extracto pueden estar presentes varios metabolitos secundarios, faltaría
determinar si la inhibición se debió a la acción combinada de estos metabolitos
o solo por uno de ellos.
En conclusión, la cepa Streptomyces sp.
6E3 presentó una mayor actividad antimicrobiana frente a Staphylococcus
aureus ATCC 33862 y a las cepas SARM.
REFERENCIAS BIBLIOGRÁFICAS
1. Sottorff
I, Wiese J, Lipfert M, Preußke N, Sönnichsen FD, Imhoff JF. Different secondary metabolite profiles of phylogenetically almost identical Streptomyces griseus
strains originating from geographically remote locations. Microorganisms. 2019;7(6). pii: E166.
2. Klementz
D, Döring K, Lucas X, Telukunta
KK, Erxleben A, Deubel D, et
al. StreptomeDB 2.0—an
extended resource of natural products
produced by streptomycetes. Nucleic Acids Res. 2015;44(D1):D509-D14.
3. Liang
L, Haltli BA, Kerr RG. Draft Genome Sequence
of Streptomyces sp. Strain, an Antibiotic
Producer Isolated from
Marine Sediment in Prince Edward Island, Canada. Microbiol Resour Announc. 2019;8(35):e00870-19.
4. Qi
D, Zou L, Zhou D, Chen Y, Gao Z, Feng R, et al.
Taxonomy and Broad-Spectrum
Antifungal Activity of Streptomyces sp. SCA3-4 Isolated From Rhizosphere
Soil of Opuntia stricta.
Front Microbiol. 2019;10:1390.
5. Hurtado J, Pacheco SL, Sheen P, Ugarte D. Actinobacteria
isolated from Mineral Ores
in Peru. J Microbiol Biotechnol Food Sci. 2019;2019:366-70.
6. León J, Aponte JJ, Rojas R,
Cuadra D, Ayala N, Tomás G, et al. Estudio de actinomicetos marinos
aislados de la costa central del Perú y su actividad antibacteriana frente a Staphylococcus aureus
meticilina resistentes y Enterococcus
faecalis vancomicina resistentes. Rev Peru Med
Exp Salud Publica. 2011;28(2):237-46.
7. Navarro ML, León J, Huamán
M, De Amat C, Morales M, Flores L, et al. Identificación de un Complejo
Antimicrobiano Natural, producido por Streptomyces
californicus 13A2 inhibidor de Bacterias B-Lactámicos Resistentes de Origen Hospitalario aisladas del
Instituto Nacional Materno Perinatal de Lima, Perú. Vitae. 2014;21:S59.
8. Singh LS, Baruah I, Bora T. Actinomycetes
of Loktak habitat: isolation and screening for antimicrobial activities. Biotechnology. 2006;5(2):217-21.
9. Rojas JJ, García AM, López
AJ. Evaluación de dos metodologías para determinar la actividad antimicrobiana
de plantas medicinales. Bol latinoam Caribe plantas med aromát. 2005;4(2):28-32.
10. Wiegand
I, Hilpert K, Hancock RE.
Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial
substances. Nat Protoc. 2008;3(2):163-75.
11. Devienne
KF, Raddi MSG. Screening for antimicrobial activity of natural products using a microplate photometer. Braz J Microbiol. 2002;33(2):166-8.
12. Rao
MPN, Xiao M, Li W-J. Fungal
and Bacterial Pigments: Secondary Metabolites with Wide Applications. Front Microbiol. 2017;8(1113).
13. Nodwell
JR. Microbe Profile: Streptomyces coelicolor:
a burlesque of pigments and
phenotypes. Microbiology.
2019;165(9):953-5.
14. Otani
S, Takatsu M, Nakano M,
Kasai S, Miura R. Roseoflavin, a new antimicrobial pigment from Streptomyces. J Antibiot (Tokyo). 1974;27(1):88-9.
15. Stierle
AA, Stierle DB, Girtsman T,
Mou T, Antczak C, Djaballah H. Azaphilones from an Acid
Mine Extremophile Strain of
a Pleurostomophora sp.
J Nat Prod. 2015;78(12):2917-23.
16. Sujatha
P, Raju KVVSNB, Ramana T. Studies on a new marine streptomycete BT-408 producing polyketide antibiotic SBR-22 effective against methicillin resistant Staphylococcus aureus.
Microbiol Res. 2005;160(2):119-26.
17. Ubillus
JA, Quispe JL, Durán RR, Trujillo SM, Salazar LL. Actividad antimicrobiana y
sinérgica de metabolitos producidos por Streptomyces
erythrogriseus M1077 de origen marino. RSVM.
2015;35(1):13-9.
18. Ilic
S, Konstantinovic S, Todorovic
Z, Lazic M, Veljkovic V, Jokovic N, et al. Characterization
and antimicrobial activity
of the bioactive metabolites in streptomycete isolates. Mikrobiologiia. 2007;76(4):480-7.
19. Arasu
MV, Duraipandiyan V, Agastian
P, Ignacimuthu S. In vitro antimicrobial
activity of Streptomyces
spp. ERI-3 isolated from Western Ghats rock soil (India). J Mycol Med. 2009;19(1):22-8.
20. Tripathi
C, Praveen V, Singh V, Bihari
V. Production of antibacterial
and antifungal metabolites by Streptomyces violaceusniger and media optimization
studies for the maximum metabolite
production. Med Chem Res. 2004;13(8-9):790-9.
Financiamiento: Por el Programa Nacional de Innovación para la Competitividad y
Productividad (Innóvate Perú) bajo el contrato 235-FincyT-IA-2013.
Citar como: Ampuero A, Rojas R, Ruiz C, Hurtado J. Actividad antimicrobiana de Streptomyces sp. 6E3 aislado de
concentrado de mineral. Rev Peru
Med Exp Salud Publica. 2020;37(1):110-4. Doi: https://doi.org/10.17843/rpmesp.2020.371.4505.
Correspondencia: Jasmin Hurtado; Av. Honorio Delgado 430, San Martin de
Porres. Lima, Perú; jasmin.hurtado@upch.pe.
Contribución de los autores: JH, AA, CR y RR han participado en la concepción
del trabajo experimental, diseño del artículo, así como en su análisis,
interpretación de datos y redacción. Además, AA ejecutó el trabajo experimental
y recolectó datos, y CR apoyó en la ejecución. Todos los autores aprobaron la
versión final del artículo.
Conflicto de interés: Los autores declaran que no tienen conflictos de
interés.
Recibido:
30/04/2019
Aprobado:
29/01/2020
En línea:
19/03/2020