10.17843/rpmesp.2020.373.4597
ARTÍCULO ORIGINAL
Neutralización de la
actividad letal del veneno de serpiente Bothrops atrox por suero
hiperinmune de llama (Lama glama)
Neutralization of the
lethal activity from Bothrops atrox venom by hyperimune llama serum (Lama
glama)
Henri Bailon Calderon
 1, Biólogo, magíster en Bioquímica y Biología Molecular
1, Biólogo, magíster en Bioquímica y Biología Molecular
Elizabeth Gaby Colque Alave
 1,
médico veterinario
1,
médico veterinario
Verónica Olga Yaniro Coronel
 1,
biólogo
1,
biólogo
Carlos Padilla Rojas
 1,
biólogo
1,
biólogo
Marco Galarza Pérez
 1,
biólogo
1,
biólogo
Omar Alberto Cáceres Rey
 1,
biólogo
1,
biólogo
César Bonilla Ferreyra
 2,
Biólogo, magíster en Bioquímica y Biología Molecular
2,
Biólogo, magíster en Bioquímica y Biología Molecular
Benigno Tintaya Felix
 2,
médico veterinario
2,
médico veterinario
David García Neyra
 1,
técnico de laboratorio
1,
técnico de laboratorio
>Rosalina Rosio Inga Arellano
 2,
Biólogo, magíster en Bioquímica y Biología Molecular
2,
Biólogo, magíster en Bioquímica y Biología Molecular
Silvia Seraylan Ormachea
 2,
Biólogo, magíster en Bioquímica y Biología Molecular
2,
Biólogo, magíster en Bioquímica y Biología Molecular
Harrison Montejo Arevalo
 1, administrador
1, administrador
1 Laboratorio de
Referencia Nacional de Biotecnología y Biología Molecular, Centro Nacional
de Salud Pública, Instituto Nacional de Salud, Lima, Perú.
2 Centro Nacional de Producción de Biológicos, Lima, Perú.
RESUMEN
Objetivos: Evaluar
la capacidad del suero hiperinmune de llama (Lama glama) para
neutralizar la letalidad del veneno de la serpiente Bothrops atrox en
ratones de laboratorio.
Materiales y métodos:
Se calculó la dosis letal media (DL50) de un pool de venenos de
serpientes de Bothrops atrox de Perú, y se midieron los títulos de
anticuerpos por ensayo ELISA; así como la potencia de neutralización del
suero inmune por el cálculo de la dosis efectiva media (DE50)
durante el periodo de inmunización.
Resultados: La DL50
del veneno fue de 3,96 µg/g, similar a otros trabajos realizados en
Bothrops atrox en Perú. Los títulos de anticuerpos contra el veneno se
incrementan rápidamente en la llama mostrando una rápida respuesta inmune;
sin embargo, la capacidad de neutralización se incrementa más lentamente y
requiere de varias dosis y refuerzos de las inmunizaciones alcanzado una DE50
de 3,30 µL/g ratón y una potencia de neutralización 3,6 mg/mL después de
15 inmunizaciones.
Conclusiones: El
suero hiperinmune de llama es capaz de neutralizar la letalidad del veneno
de la serpiente Bothrops atrox de Perú en ratones de laboratorio.
Palabras clave:
Bothrops atrox; Lama glama; Neutralización; Sueros Inmunes; Dosis
Letal 50; Letalidad (Fuente: DeCs BIREME).
ABSTRACT
Objectives: To
evaluate the capacity of the hyperimmune llama serum (Lama glama) to
neutralize the lethal activity of Bothrops atrox venom in laboratory
mice.
Materials and methods:
Mean lethal dose (LD50) was calculated from a Bothrops atrox
venom sample pool from Peru. The antibody titers were measured by ELISA
assay; and the immune serum neutralization potency was measured by
calculating the mean effective dose (ED50) during the
immunization period.
Results: The venom’s
LD50 was 3.96 μg/g; similar to what was found in other studies
about Bothrops atrox carried out in Peru. The titers of antibodies
against the venom increased rapidly in the llama, demonstrating a fast
immune response; however, the neutralization capacity increased slowly and
required several doses and immunization reinforcements, obtaining a ED50
of 3.30 μL/g mouse and a neutralization potency of 3.6 mg/mL after 15
immunizations.
Conclusions: The
hyperimmune llama serum is able to neutralize the lethality of the
Bothrops atrox venom from Peru in laboratory mice.
Keywords:
Bothrops atrox; Lama glama; Neutralization; Immune Sera; Lethal
Dose 50; Mortality (Source: MeSH NLM).
INTRODUCCIÓN
El ofidismo es un síndrome
resultante del envenenamiento ocasionado por serpientes venenosas,
generalmente de especies pertenecientes a las familias Viperidae y
Elapidae (1,2). En el Perú, se conoce a la serpiente
Bothrops atrox como la especie de mayor importancia médica, responsable
del 88% al 92% de los casos de ofidismo en el país (1,3), causa
morbimortalidad y deja secuelas como amputaciones o laceraciones en las
partes afectadas. El daño tisular se debe a un conjunto de actividades
biológicas producidas por enzimas presentes en el veneno, como el efecto
proteolítico −destrucción de proteínas especialmente estructurales−
coagulante, vasculotóxico y nefrotóxico (4).
El cuadro clínico se
caracteriza por dolor, edema, equimosis, eritema y necrosis. En los casos
graves pueden presentarse vesículas o ampollas de contenido seroso y
hemorrágico, así como hematemesis y choque hemorrágico. El único tratamiento
farmacológicamente válido para los casos de ofidismo es la aplicación de
inmunoterapia artificial pasiva, mediante la transferencia de anticuerpos
IgG antiveneno, generalmente heterólogos, de origen equino (5).
El suero antibotrópico
polivalente líquido es elaborado por el Instituto Nacional de Salud (INS)
como una solución purificada de inmunoglobulinas específicas IgG completa,
obtenidas a partir del plasma de equinos hiperinmunizados con un pool de
venenos de las serpientes del género Bothrops, específicamente
Bothrops atrox, Bothrops pictus, Bothrops barnetti, Bothrops braziili
y Bothrocophias hyoprora (2,3,6).
Actualmente existen algunos
problemas asociados a la producción de antídoto contra el veneno de esta
serpiente, como la necesidad del uso de serpientes para obtener el veneno,
el riesgo implícito en la obtención del veneno, el uso de equinos para la
obtención del suero hiperinmune y la posterior extracción de los anticuerpos
totales que contienen los anticuerpos neutralizantes del veneno y demás
anticuerpos del animal (1,2). Los equinos utilizados sufren a
menudo de hepatomegalia, a causa de la inmunización con los venenos. Algunas
investigaciones se dirigen a mejorar los procesos fisiológicos y
bioquímicos, entre ellos las pruebas con coadyuvantes alternativos que
mejoran la liberación y asimilación del veneno dentro del caballo con miras
para reducir los efectos negativos de las inoculaciones (5).
Además, los anticuerpos
equinos completos contienen la fracción constante en la cadena pesada,
reconocida por los receptores de varios tipos celulares, como linfocitos NK,
neutrófilos, macrófagos, células B y mastocitos, y por los factores del
complemento; también pueden causar otras reacciones adversas conocidas como
enfermedad asociada al suero, que se caracteriza principalmente por
urticaria, tos, náuseas y vómitos, taquicardia y dolores de cabeza. Además,
en muchos casos el paciente puede desarrollar anafilaxia sistémica con
síntomas como hipotensión, broncoespasmo y angioedema (7).
El objetivo principal de
este estudio es determinar la eficacia del suero hiperinmune de llama (Lama
glama) como neutralizante de la actividad letal del veneno de serpiente
peruana Bothrops atrox; además aportará conocimiento de nuevas
alternativas de producción de biológicos, lo cual contribuirá con la
capacidad de producción de antiofídicos por el Instituto Nacional de Salud
del Perú.
| MENSAJES CLAVE |
|
Motivación para realizar
el estudio:
En el Perú existen pocos estudios sobre el uso de animales diferentes al
caballo para la producción de antídotos contra la mordedura de serpientes
venenosas. Es necesario diseñar y evaluar nuevas alternativas para enfrentar
este problema.
Principales hallazgos:
El suero hiperinmune de la llama es capaz de neutralizar el veneno de la
serpiente Bothrops atrox de forma similar a los antídotos usados actualmente
para este tipo de serpiente.
Implicancias: Se Si
se realizan más estudios y se demuestra la eficacia del suero de llama para
la producción de antídotos, podría contarse con una nueva alternativa para
la producción de antídotos antibotrópico.
|
MATERIALES Y MÉTODOS
El presente estudio es de tipo experimental analítico.
Animales de
experimentación
Se empleó un ejemplar de
llama (Lama glama) macho para obtener el suero preinmune y posinmune.
El animal provenía de un centro agropecuario (SAIS Pachacutec), estuvo sano
y saludable, pasó un periodo de evaluación veterinaria y cuarentena de 40
días, previo a la experimentación. Se emplearon ratones BALB/c (Mus
musculus) de 17 g a 19 g del bioterio del Centro Nacional de Producción
de Biológicos del INS, los cuales fueron mantenidos en un ambiente
controlado del laboratorio. El manejo de los ratones se realizó siguiendo
lo descrito en la Guía de manejo y cuidado de animales de laboratorio:
ratón, del INS (8).
Procedimientos
Obtención y conservación
del veneno
Las muestras de veneno se
obtuvieron por extracción manual, fueron recogidas en un vaso de
precipitados y se transportaron al laboratorio en cadena de frío. Se
centrifugaron a 5000 rpm por 20 minutos para eliminar los componentes
extraños al veneno y se tomaron alícuotas de 2 ml en viales de vidrio. Los
viales se congelaron a –80 °C toda la noche, luego fueron colocados en una
liofilizadora hasta que se forme una tableta homogénea; se registró el peso
neto del veneno liofilizado que se almacenó a –80 °C hasta su uso.
Electroforesis de
proteínas por SDS-PAGE
El veneno se trató con un
buffer de proteínas bajo condiciones reductoras durante 5 minutos a 100 °C
para luego ser sometido a electroforesis por el método SDS-PAGE al 12%
durante 1 hora a 100 voltios. Se utilizó un marcador de peso molecular de
proteínas (Thermo Scientific #26623). La tinción del gel se realizó con
azul de Coomassie durante 1 hora y luego fue lavado con solución
decolorante. En el caso del suero, las condiciones de electroforesis, la
tinción y el revelado del gel fueron las mismas que para el veneno.
Determinación del efecto
letal medio
Se preparó la solución
madre de veneno a una concentración de 1 mg/mL empleando como disolvente una
solución fisiológica estéril. Se tomaron de referencia los valores de dosis
letal media (DL50) reportado en estudios previos (12-15)
que, para el veneno de Bothrops atrox se reporta en un rango de
3 µg/g a 6 µg/g de ratón. Se prepararon soluciones de mayor y menor cantidad
de veneno que el valor de referencia, manteniendo un factor de dilución
constante de 1,22 µg/g ratón. Se inoculó por vía intraperitoneal un
volumen de 0,5 mL de solución de veneno a cada ratón. Se registró la
cantidad de ratones vivos/muertos (V/M) de cada grupo a las 24 y 48 horas.
Se tuvo en cuenta la cantidad de ratones muertos de cada caja a las 48 horas
para el análisis probit.
Inmunización de Lama
glama con veneno de Bothrops atrox
Las inmunizaciones se
realizaron en un cepo o manga de inoculación para animales mayores. Se
rasuró la lana de la zona de inoculación en el dorso de la llama y se
inoculó el veneno, una mezcla de relación 1:1 entre el veneno y el
adyuvante GERBU (9,10), su volumen total fue de 4 mL (2 mL de
veneno y 2 mL del adyuvante GERBU). Se inoculó el veneno por vía subcutánea
(distribuido proporcionalmente en cuatro lugares del dorso y alternando
entre ambas partes laterales del lomo entre cada inoculación).
Esquema de inmunización
de llama con veneno de Bothrops atrox
El esquema primario de
inmunización comprendió 8 inmunizaciones con veneno total de Bothrops
atrox más el adyuvante GERBU en la proporción 1:1 (V/V). Las cantidades
de veneno inoculadas en cada dosis de inmunización, así como los intervalos
de tiempo entre las dosis, se indican en el material suplementario. Luego
del esquema primario se aplicaron 7 dosis de refuerzo, según se indica en la
Tabla 1.
Tabla 1. Esquema de inmunización primaria y refuerzo de Lama glama con veneno de Bothrops atrox
|
Día |
Veneno de Bothrops atrox |
Volumen de inoculación (mL) |
Adyuvante |
Procedimiento
a |
|
0 |
- |
- |
- |
Obtención de suero
preinmune |
|
Esquema primario de
inmunización |
|
7 |
0,5 mg |
4 |
GERBU |
Obtención de suero /
inmunización |
|
14 |
1 mg |
4 |
GERBU |
Obtención de suero /
inmunización |
|
21 |
2 mg |
4 |
GERBU |
Obtención de suero /
inmunización |
|
28 |
3 mg |
4 |
GERBU |
Obtención de suero /
inmunización |
|
35 |
4 mg |
4 |
GERBU |
Obtención de suero /
inmunización |
|
42 |
4 mg |
4 |
GERBU |
Obtención de suero /
inmunización |
|
51 |
4 mg |
4 |
GERBU |
Obtención de suero /
inmunización |
|
65 |
4 mg |
4 |
GERBU |
Obtención de suero /
inmunización |
|
Esquema de refuerzo
de inmunización |
|
126 |
4 mg |
4 |
GERBU |
Obtención de suero /
inmunización |
|
201 |
4 mg |
4 |
GERBU |
Obtención de suero /
inmunización |
|
229 |
4 mg |
4 |
GERBU |
Obtención de suero /
inmunización |
|
236 |
4 mg |
4 |
GERBU |
Obtención de suero /
inmunización |
|
245 |
4 mg |
4 |
GERBU |
Obtención de suero /
inmunización |
|
253 |
4 mg |
4 |
GERBU |
Obtención de suero /
inmunización |
|
268 |
4 mg |
4 |
GERBU |
Obtención de suero /
inmunización |
a Excepto el día 0, se realizó la obtención de suero el mismo día antes de cada inmunización
Obtención de suero de
Lama glama
Se tomó una muestra de
sangre (20 mL aprox.) de la vena yugular derecha con una jeringa de 20 mL
utilizando una aguja n.o 18. La sangre fue colectada en tubos
vacutainer que contienen un gel separador para colección de suero y se
procedió a centrifugar a 3000 rpm por 5 minutos. El suero se colectó en
tubos de microcentrifuga de 1,5 ml que se guardaron a –80 °C. El suero
preinmune se obtuvo antes de la primera inmunización y los sueros
posinmunización fueron colectados el mismo día antes de cada inmunización
(Tabla 1).
ELISA para la medición
de anticuerpos de Lama glama contra el veneno de Bothrops atrox
Se diluyó el veneno en
buffer carbonato (Na2CO3 0,015 M, NaHCO3
0,035 M) a una concentración final de 0,5 µg/mL. Se aplicaron 100 µL/pocillo
del veneno diluido, se cubrió la placa y se incubó toda la noche a 4 °C. Se
removió la solución de veneno por inversión. Se agregaron 250 µL del buffer
de bloqueo (BSA o leche descremada) en cada pocillo y se incubaron por 1
hora a temperatura ambiente. Los sueros a titular se diluyeron desde 1/200
hasta 1/800 en buffer carbonato; así como el control negativo (suero
preinmune) y el blanco (buffer carbonato sin antígeno). Se removió el
buffer de bloqueo y se lavó 5 veces, luego se añadió a cada pocillo 100 µL
del suero a titular y se incubó durante 1 hora a temperatura ambiente,
realizándolo por duplicado. Se removió el suero y se lavó 5 veces para luego
agregar a cada pocillo 100 µL de conjugado (anti-Llama IgG (H+L)-Peroxidasa)
diluido 1:10 000 en buffer de dilución de conjugado; se incubó durante 1
hora a temperatura ambiente, se removió el conjugado y se lavó 5 veces; a
cada pocillo se añadió 100 µL del sustrato TMB (tetrametil-benzidina) y se
incubó de 5 a 15 minutos a temperatura ambiente y en oscuridad. A cada
pocillo se añadió 50 µL de solución de parada (H2SO4)
0,5 M. Se leyó la placa a una longitud de onda de 450 nm.
Determinación de la
neutralización del efecto letal
Se siguieron las
recomendaciones del manual de procedimientos del Instituto Clodomiro Picado
para determinar las actividades tóxicas de venenos y su neutralización (11).
Se utilizaron ratones macho de 17 g a 18 g, se consideraron 5 grupos de 6
ratones por cada caja y una caja adicional para los controles.
Se determinó la dosis de
veneno tomando en cuenta 4 veces el valor de la DL50 por cada gramo de ratón
a inocular (µg veneno/g ratón). Se utilizó el método de preincubación de
veneno con antiveneno (suero de llama) a 37 °C por 30 minutos, con dosis
fijas de veneno (4DL50) y 5 diluciones de veneno. Se determinó el
volumen de suero de cada inóculo, partiendo de que 1 mL de suero debe
neutralizar al menos 2,5 mg de veneno (suero antibotrópico-INS). Se preparó
la solución de veneno (sin suero) para los ratones control, la cual contiene
4DL50. Se inoculó por vía intraperitoneal un volumen de 0,5 mL de
las soluciones preparadas a cada ratón. Se observó a los ratones en las
siguientes horas. Se registró la cantidad de animales V/M de cada grupo a
las 24 y 48 horas, se tuvo en cuenta la cantidad de ratones muertos de cada
caja a las 48 horas para el cálculo estadístico.
Análisis estadísticos
El análisis estadístico se
realizó con el programa Stata versión 11 y la función probit para
determinar la DL50; también se analizaron los datos de
neutralización de letalidad para calcular la DE50 del suero. Las
diferencias entre los grupos se determinaron con la prueba de Chi cuadrado,
considerando estadísticamente significativos los valores de p menores a
0,05.
Aspectos éticos
El estudio del cual forma
parte este artículo fue aprobado por el Comité de Ética Institucional en
Seres Humanos y por el Comité de Ética para el Uso de Animales de
Experimentación del INS.
RESULTADOS
La DL50 del pool
de venenos de serpientes peruanas Bothrops atrox fue de 3,96 µg de
veneno/g de ratón a las 48 horas, con un límite inferior de 3,57 µg/g y un
límite superior de 4,38 µg/g, según su intervalo de confianza al 95%.
Además, se encuentra un valor de R2 de 0,99 lo cual indica una
alta correlación entre la dosis aplicada y el efecto letal del veneno
(Figura 1).
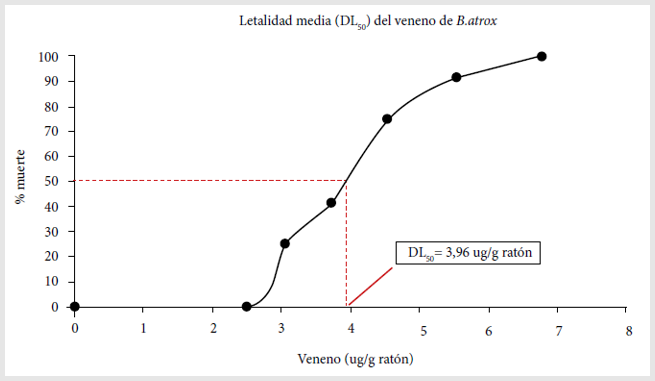
Figura 1. Determinación de dosis letal media (DL50) del veneno de serpiente Bothrops atrox. Se evaluaron diferentes cantidades de veneno, desde 2,5 hasta 6,75 ug de veneno por gramo de ratón en grupos de 12 ratones. Se inocularon las soluciones de veneno por vía intraperitoneal y se contaron los ratones vivos y muertos a las 48 horas.
El análisis del veneno de
Bothrops atrox por electroforesis por SDS-PAGE muestra un perfil
característico de proteínas que concuerda con el perfil de proteínas
reportado para esta especie (6). Se observaron cuatro bandas
fuertes (proteínas más abundantes) y al menos 6 bandas tenues; entre las
proteínas más abundantes, dos bandas de alto peso molecular (45-60 kDa) y
dos bandas de menor peso molecular (10-20 kDa) (Figura 2A). En el análisis
de electroforesis del suero se observó el perfil de proteínas de bandas
correspondientes a las cadenas pesadas y ligeras de los anticuerpos IgG
(Figura 2B).
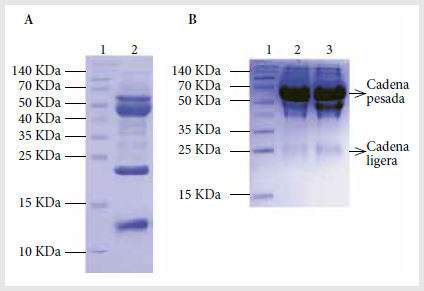
Figura 2. Electroforesis SDS-PAGE del veneno de Bothrops atrox y suero de llama. A) Perfil de proteínas del veneno de serpiente Bothrops atrox. Carril 1: marcador de peso molecular de proteínas (Termo Scientific #26623). Carril 2: veneno total de Bothrops atrox. B) Electroforesis del suero de llama (Lama glama). Carril 1: marcador de peso molecular de proteínas (Thermo Scientific #26623). Carril 2: suero preinmune de
llama. Carril 3: suero inmune de llama.
La estandarización del
ensayo de ELISA para detectar anticuerpos contra el veneno de Bothrops
atrox en el suero de llama demostró que la cantidad óptima de antígeno a
utilizar es de 50 ng, la dilución óptima del suero es de 1:800 y la dilución
ideal del anticuerpo conjugado con peroxidasa es de 1:10 000. La albúmina
sérica bovina (BSA) resultó ser un mejor agente bloqueante que la leche
descremada para el ELISA. Para elegir los parámetros óptimos del ensayo se
consideró la diferencia de absorbancia entre el suero control preinmune y el
suero inmune. El título de anticuerpos específicos para el veneno de
Bothrops atrox se incrementó rápidamente en el suero a partir de la
segunda semana después del inicio de las inmunizaciones alcanzando el máximo
en la cuarta semana y luego manteniéndose constante.
Al término de la
inmunización primaria no se logró la potencia esperada, similar a la del
suero de referencia (suero equino) (2,5 mg/mL); por lo tanto, luego de este
primer esquema se procedió a realizar siete refuerzos de inmunización de
4 mg de veneno en volumen de 2 mL, hasta lograr que la potencia
neutralizante fuese igual o mayor a 2,5 mg/mL. Luego de los refuerzos la DE50
fue 3,30 µL/g ratón y los limites superior e inferior fueron 3,86 µL/g ratón
y 2,90 µL/g ratón, respectivamente. Esta DE50 equivale a una
potencia de neutralización del veneno de 3,6 mg/mL; 1 mL de suero de llama
es capaz de neutralizar 3,6 mg de veneno de Bothrops atrox. Se
realizó una comparación entre los títulos de anticuerpos y las potencias
para estas fechas (Figura 3).
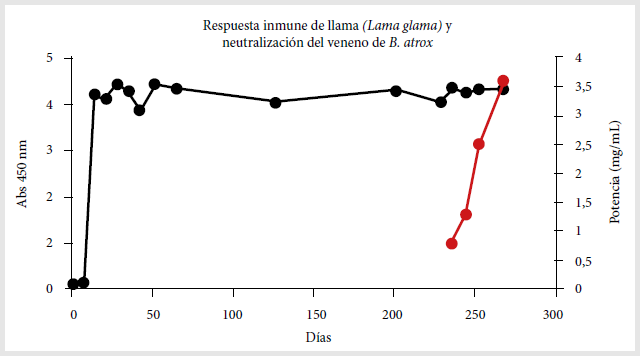
Figura 3. Medición de anticuerpos contra veneno de Bothrops atrox por ELISA y neutralización del efecto letal en ratones. Se midieron los anticuerpos en el suero de llama luego de las inmunizaciones por el ensayo de ELISA (valores en eje Y izquierda, línea de color negro), y se analizó la potencia de neutralización de letalidad en ratones del suero hiperinmune de llama, en ratones de laboratorio (valores en eje Y derecho, línea de color rojo).
DISCUSIÓN
Si bien los antivenenos
producidos en equinos son el principal tratamiento utilizado en los casos
de ofidismo, aún existen algunos problemas asociados al uso de los
antivenenos, como la aparición de reacciones adversas en los pacientes (3).
El presente estudio analiza la respuesta inmune de la llama al veneno de la
serpiente Bothrops atrox y la capacidad de este suero hiperinmune
para neutralizar la letalidad del veneno, como una aproximación para
evaluar otras especies seroproductoras.
Ruiz et al.
(12) determinaron una DL50 de Bothrops atrox
intraperitoneal a las 48 horas de 2,3 mg/kg. Por otro lado, Ohsaka (13)
determinó una DL50 de 3,8 µg/g a las 48 horas y por vía
intraperitoneal. Barros et al. (14) determinaron una DL50
de 6,85 µg/g, y Meier y Theakston (15) determinaron un DL50
de 3,95 µg/g en las mismas condiciones. Comparados con nuestros resultados
de 3,96 µg/g estos valores son similares, debido a que el ensayo es el mismo
y las muestras biológicas son de la misma especie. Las diferencias podrían
deberse a variaciones entre las poblaciones de serpientes estudiadas, ya que
las características de los venenos de una misma especie de serpiente pueden
variar en función de la edad de los especímenes, su origen o si se
encuentran en estado silvestre o en cautiverio (4,16).
Estudios previos (17)
muestran que los venenos botrópicos son entre 1,2 y 3,6 veces más tóxicos
cuando se inoculan por la vía endovenosa que por la vía intraperitoneal.
También los datos previos sugieren que la vía subcutánea no es recomendable
para la evaluación de la potencia tóxica (17). Por estas razones,
en este estudio se utilizó la inoculación por vía intraperitoneal, mostrando
buenos resultados en el ensayo de neutralización de letalidad.
Los antivenenos producidos
en caballos son evaluados por las mismas instituciones que las fabrican, en
nuestro caso el INS, pero además se realizan estudios para verificar la
efectividad que tienen y corroborar cuál es su rango de acción en cuanto a
especies de serpientes y verificar su poder de neutralización (18);
en nuestro estudio, el suero hiperinmune de llama presentó una potencia de
neutralización de 3,6 mg/mL; que significa que 1 mL del suero hiperinmune de
llama es capaz de neutralizar 3,6 mg de veneno de Bothrops atrox.
En este trabajo se
analizaron los datos dosis-respuesta con el estadístico probit, aunque se
encontró en referencias otros tipos más de análisis posibles, se optó por el
probit por ser el más adecuado para el ensayo. Debido a la necesidad de
obtener datos objetivos, la estadística se ha usado desde hace décadas y
conforme ha ido avanzando se han ideado algunas formas de calcular el DL50.
Por ejemplo, en 1985 Meier y Theaicston (15) propusieron un
método de análisis estadístico para reducir la cantidad de ratones de
experimentación de 30 a 10 que no diferían significativamente en sus
resultados siendo más deseable por motivos económicos y éticos. Pero esto ha
sido superado posteriormente por el estadístico probit, que es muy útil
frente a datos dosis-respuesta de este tipo.
Ya en trabajos anteriores
se demostró el gran valor del uso de la técnica ELISA en ensayos in vitro
para el análisis de anticuerpos generados en respuesta a la inmunización con
venenos, en comparación con otros métodos usados anteriormente como
inmunodifusión o hemaglutinación (19).
No se observó una
concordancia simultánea entre el título de anticuerpos y la capacidad de
neutralización durante el proceso de inmunización, ya que los anticuerpos
contra el veneno de Bothrops atrox se incrementan rápidamente, pero
la potencia de neutralización se incrementa más lentamente y requiere más
tiempo y la administración de dosis de refuerzo de inmunización.
Otros estudios con suero de
llama tampoco encontró una correlación entre el título y la efectividad de
neutralización de venenos en ensayos preclínicos (20). Esta
observación se debe probablemente a que el ensayo de ELISA detecta
tempranamente todos los anticuerpos producidos contra todos los antígenos
del veneno; mientras que el efecto de neutralización solo depende de un
grupo pequeño de anticuerpos específicos que neutralizan o bloquean la
toxicidad producida por las toxinas o proteínas del veneno.
El desarrollo lento de la
potencia de neutralización en llama es comprensible, considerando que en
caballos también se requieren en total de 12 dosis o más de inmunización,
para alcanzar los valores esperados de potencia de neutralización del veneno
(21).
Harrison et al.
(22) midieron la capacidad neutralizante del suero hiperinmune de
Lama glama contra el veneno de Echis ocellatus, y
encontraron que se produce un título elevado de anticuerpo de llama a las
dos semanas, similar a nuestros resultados, ambos trabajos indican que es
factible preparar antisuero botrópico a partir del suero de llama. Además,
encontraron un componente aún no determinado dentro del suero de llama que
no es un IgG y que presenta actividad antihemorrágica. Fernandez et al.
(23) encontraron que el suero de llama es efectivo contra el veneno de
la serpiente Bothrops mattogrossensis que también representa una
alternativa valiosa para la fabricación de antídotos en Sudamérica.
Entre las limitaciones del
estudio se debe considerar que solo se ha evaluado la respuesta inmune al
veneno de serpiente Bothrops atrox en una sola llama y es
recomendable hacer el análisis en más de un animal; tampoco se ha comparado
la capacidad neutralizante del suero de llama contra el suero antibotrópico
producido en equino, debido a que este último es un suero polivalente y el
suero de llama es solo contra el veneno de la serpiente Bothrops atrox.
Se debe resaltar que este es uno de los pocos estudios que evalúan la
capacidad neutralizante del suero de llama contra el veneno de serpientes,
y, aunque existen otros trabajos similares con el veneno de serpientes del
género Bothrops, como Bothrops matogrosensis, este el único estudio
conocido con la especie Bothrops atrox.
En conclusión, los
resultados muestran que el suero hiperinmune de llama tiene actividad
neutralizante para el veneno de Bothrops atrox de Perú, con una DE50
de 3,30 µL de suero/g ratón y una potencia de neutralización del veneno de
3,6 mg/mL, lo cual significa que 1 mL de suero hiperinmune es capaz de
neutralizar 3,6 mg de veneno. La DL50 del veneno de Bothrops
atrox de Perú fue de 3,96 µg veneno/g ratón y se utilizó cuatro veces
esta cantidad como dosis de desafío para analizar la neutralización del
veneno. La respuesta inmune de la llama al veneno es rápida, con altos
títulos de anticuerpos desde la segunda semana de inmunización, pero se
requieren varias semanas más y dosis adicionales de refuerzo para alcanzar
la potencia esperada de neutralización del veneno por este suero
hiperinmune. La prueba ELISA es un buen método in vitro de análisis
de anticuerpos generados ante la inmunización con veneno de Bothrops
atrox y permite monitorear la respuesta inmune durante la inmunización.
REFERENCIAS
BIBLIOGRÁFICAS
1. Loja OD, Aviles GR,
Necochea VY, Vilca VM, Castro TJ. Ofidismo por Bothrops atrox: estudio
clínico-epidemiológico. Diagnóstico. 2000;39(5):261-5.
2. Poggi D. Veneno de
serpiente en la industria e investigación farmacoló¬gica–Plan estratégico de
desarrollo de la bioindustria en el eje Amazo¬nas–Marañón [Internet]. 2002.
Disponible en:
http://www.iiap.org.pe/upload/publicacion/CD_PEBIAM/documentos/BIO%203/BIO3-A.pdf.
3. Ministerio de Salud.
Norma Técnica N° 007-MINSA-DGSP. MINSA 2004. Sobre Prevención y Tratamiento
De Accidentes Por Animales Ponzoñosos [Internet]. Lima: MINSA; 2004.
Disponible en: http://bvs.minsa.gob.pe/local/dgsp/123_NTPONZONOSOS.pdf.
4. Zelanis A, Tashima AK.
Unraveling snake venom complexity with ‘omics’ approaches: challenges and
perspectives. Toxicon. 2014;87:131-4. doi: 10.1016/j.toxicon.2014.05.011.
5. Mora D. Productividad
Antiofídica De Equinos Destinados a la In¬dustria Inmunobiológica en Costa
Rica. Nutrición Animal Tropical. 2014;8(1):44-54.
6. Segura A, Castillo MC,
Núñez V, Yarlequé A, Gonçalves LR, Villalta M, et al. Preclinical assessment
of the neutralizing capacity of antivenoms produced in six Latin American
countries against medically-relevant Bothrops snake venoms. Toxicon.
2010;56(6):980-9. doi: 10.1016/j.toxicon.2010.07.001.
7. Rodríguez S. Negrin A,
Burger M. Efecto adverso por suero antibothró¬pico. Rev Med Uruguay. 2004;
20:228-32.
8. Instituto Nacional de
Salud. Guía de Manejo y Cuidado de Animales de Laboratorio: ratón
[Internet]. Lima: MINSA, INS; 2008. Disponible en:
https://www.ins.gob.pe/insvirtual/images/otrpubs/pdf/GUIA_ANIMA¬LES_RATON.pdf.
9. Grubhofer NA. Vaccine
Adjuvants Revisited. TOVSJ. 2008;2:63-67.
10. Pardon E. A general
protocol for the generation of Nanobodies for struc¬tural biology. Nat
Protoc. 2014;9(3):674-93. doi: 10.1038/nprot.2014.039.
11. Instituto Clodomiro
Picado. Determinación de actividades Tóxicas de venenos de serpientes y su
neutralización por antivenenos. Manual de métodos de laboratorio [Internet].
Costa Rica: Universidad de Costa Rica, Facultad de Microbiología; 2007.
Disponible en:
http://www.icp.ucr.ac.cr/sites/default/files/content/Manual%20de%20procedimientos%20determinacion%20actividades%20toxicas%20de%20venenos%20de%20serpientes%20y%20su%20neutralizaci%¬C3%B3n.pdf.
12. Ruiz RI, Ruiz LI,
Martínez-Vargas AZ, Arruz MS, Gutiérrez JM. Toxicidad y neutralización de
venenos ofídicos peruanos de los géneros Bothrops y Lachesis (Serpentes:
Viperidae). Rev Biol Trop.1993;41(3A): 351-7.
13. Ohsaka A. Hemorrhagic,
necrotizing and edema-forming effects of snake venoms. In: Handbook of
Experimental Pharmacology. Volume 52. Berlin: Springer-Verlag;1979.
14. Barros SF,
Friedlanskaia I, Petricevich VL, Kipnis TL. Local inflammation, lethality
and cytokine release in mice injected with Bothrops atrox venom. Mediators
Inflamm. 1998;7(5):339-46. doi: 10.1080/09629359890866.
15. Meier J, Theakston RD.
Approximate LD50 determinations of snake ven¬oms using eight to ten
experimental animals. Toxicon. 1986;24(4):395-401. doi:
10.1016/0041-0101(86)90199-6.
16. Sousa LF, Portes-Junior
JA, Nicolau CA, Bernardoni JL, Nishiyama-Jr MY, Amazonas DR, et al.
Functional proteomic analyses of Bothrops atrox venom reveals phenotypes
associated with habitat variation in the Amazon. J Proteomics.
2017;159:32-46. doi: 10.1016/j.jprot.2017.03.003.
17. Olascoaga ME. Estudio
del veneno de Bothropspictus: bioquímica, toxicidad, neutralización y
efectos biológicos [Tesis doctoral]. Lima: Universidad Nacional Agraria La
Molina; 1987.
18. Otero R, Núñez V,
Barona J, Díaz A, Saldarriaga M. Características bioquí¬micas y capacidad
neutralizante de cuatro antivenenos polivalentes frente a los efectos
farmacológicos y enzimáticos del veneno de Bothrops asper y Porthidium
nasutum de Antioquia y Chocó. Latreia; 2002,15(1):5-15.
19. Sandoval G, Mendoza J,
Roldán W, EspinozaY, Solis, H, Yarlequé A. Inmunogenicidad del veneno de
Bothrops atrox (Ophidia: Viperidae) y su evaluación por métodos
inmunoenzimáticos. Rev Peru Biol; 2011;18(3):335-42.
20. Cook D, Owen T.
Analysis of camelid antibodies for antivenom development: Neutralisation of
venom-induced pathology. Toxi¬con. 2010;1;56(3):373-80. doi:
10.1016/j.toxicon.2010.04.005.
21. Espino-Solis G. Los
caballos y la producción de antivenenos. [In¬ternet]. Hypatia. 2010; 36(4).
Disponible en: https://revistahypatia.org/216.
22. Harrison RA, Hasson SS,
Harmsen M, Laing GD, Conrath K, Theak¬ston RD. Neutralisation of
venom-induced haemorrhage by IgG from camels and llamas inmunised with viper
venom and also by endoge¬nous, non-IgG components in camelid sera. Toxicon.
2006;47(3):364-8. doi: 10.1016/j.toxicon.2005.10.017.
23. Fernández GP, Segura A,
Herrera M, Velasco W, Solano G, Gutiérrez JM, et al. Neutralization of
Bothrops mattogrossensis snake venom from Bolivia: experimental evaluation
of llama and donkey antivenoms produced by caprylic acid precipitation.
Toxicon. 2010; 55(2-3):642-5. doi: 10.1016/j.toxicon.2009.07.031.
Citar como: Bailon
Calderon H, Colque Alave EG, Yaniro Coronel VO, Padilla Rojas C, Galarza
Pérez M, Cáceres Rey OA, et al. Neutralización de la actividad letal del
veneno de serpiente Bothrops atrox por suero hiperinmune de llama (lama
glama). Rev Peru Med Exp Salud Publica. 2020;37(3):446-53. doi:
https://doi.org/10.17843/rpmesp.2020.373.4597.
Correspondencia:
Henri Bailon Calderon; Av. Defensores del Morro 2268, Chorrillos. Lima,
Perú; hbailon@ins.gob.pe
Contribuciones de los
autores: HBC, EGC, VOYC, CPR, OCR, CBF, BTF han participado en el diseño
del artículo, recolección de resultados, análisis de datos, redacción del
artículo, revisión del artículo, aprobación de la versión final. MGP, DGN,
RIA, SSO, HMA han participado en la recolección de resultados, análisis de
datos, revisión del artículo y aprobación de la versión final.
Fuentes de
financiamiento: El presente artículo deriva de un estudio más amplio
financiado por el Fondo Nacional de Desarrollo Científico, Tecnológico y de
Innovación Tecnológica (FONDECYT, Perú) Convenio N.o 188-2015-FONDECYT,
además del financiamiento no monetario del INS.
Conflicto de interés:
Los autores declaran no tener ningún conflicto de interés.
Material suplementario:
Disponible en la versión electrónica de la RPMESP.
Recibido: 15/06/2019
Aprobado: 27/05/2020
En línea: 02/09/2020


