CARTAS AL EDITOR
Pneumocystis jirovecii en pacientes con VIH/sida en un hospital de Lima, Perú
Pneumocystis jirovecii detection in HIV/AIDS patients in a hospital in Peru
Coralith García1,2,a,b, Theresa Ochoa1,b, Edgar Neyra3,c, Jimmy Camargo1,d, Fiorela Alvarez1,d, Beatriz Bustamante1,2,d
1 Instituto de Medicina Tropical Alexander von Humboldt, Universidad Peruana Cayetano Heredia. Lima, Perú.
2 Hospital Cayetano Heredia. Lima, Perú.
3 Facultad de Medicina, Universidad Peruana Cayetano Heredia. Lima, Perú.
a PhD en Ciencias Biomédicas; b Médico Pediatra, especialista en Infectología Pediátrica, Magister en Medicina; c Biólogo, Magister en Bioquímica; d Médico Cirujano, Especialista en Enfermedades Infecciosas y Medicina Tropical.
Los resultados fueron presentados por Camargo J, Bustamante B, Neyra E, Ochoa T, Alvarez F, García C. Pneumocystis jiroveci Detection by Nested PCR in HIV-Infected Peruvian Patients. En IDWeek 2018, San Francisco, USA. Modalidad: Poster (#2049).
Sr. Editor. Pneumocystis jirovecii es el hongo oportunista a nivel pulmonar más común en personas con VIH/sida. El diagnóstico se basa tradicionalmente en la identificación microscópica de los quistes y trofozoítos en secreciones respiratorias. Sin embargo, con la introducción de la Reacción en Cadena de la Polimerasa (PCR) anidada el diagnóstico puede hacerse incluso en secreciones respiratorias obtenidas por métodos no invasivos (1). La PCR anidada en el caso de Pneumocystis amplifica el ADN mitocondrial a través de la detección del gen mtLSU rRNA que es una región altamente conservada. Esta es una prueba altamente sensible y reproducible pudiendo ser usada en diferentes muestras biológicas (2).
Nuestro objetivo fue determinar la frecuencia de Pneumocystis en pacientes con VIH/sida con y sin síntomas respiratorios para lo cual realizamos un estudio transversal que incluyó pacientes mayores de 18 años con VIH-SIDA, y recuento de linfocitos CD4 ≤ 500 células/µL que acudieron al Hospital Cayetano Heredia entre mayo del 2017 y marzo del 2018. El estudio fue aprobado por el Comité de Ética del hospital. Los pacientes fueron invitados a participar en los consultorios o en el área de hospitalización del Departamento de Enfermedades Infecciosas, Tropicales y Dermatologicas. Después de firmar el consentimiento informado, se recolectó la información clínica y la muestra de esputo espontáneo en caso el paciente presentara expectoración o de lavado oral (enjuague con solución salina por dos minutos) si no tenía expectoración.
Las muestras respiratorias fueron transportadas al Laboratorio de Micología Clínica del Instituto de Medicina Tropical Alexander von Humboldt donde se realizó la extracción y purificación de ADN de acuerdo a las especificaciones del kit de Qiagen (QIAamp® DNA Mini Kit). Posteriormente, las muestras fueron cuantificadas mediante el Biofotómetro D5 Eppendorf para analizarlas a través de PCR-anidado, usando los cebadores específicos para Pneumocystis jirovecii. Se amplificó el gen que codifica la subunidad mayor del rARN mitocondrial, utilizando los siguientes partidores: para la primera ronda: pAZ102-E: 5` GATGGCTGTTTCCAAGCCCA 3` y pAZ102-H: 5`GTGTACGTTGCAAAGTACTC 3` con producto de amplificación 346pb y para la segunda ronda, pAZ102-X: 5`GTGAAATACAAATCGGACTAG g3` y PAZ102-Y :5`TCACTTATTATTAATTGGGGAGC 3` con producto de amplificación de 263pb. (3). Se incluyó la amplificación del gen de beta-globina humana como un control positivo de ADN, usando los cebadores PCO3 (5’CTTCTGACACAACTGTGTTCACTAGC3’) y PCO4 (5’TCACCGCAACTTCATCCACGTTCACC3’) (4).
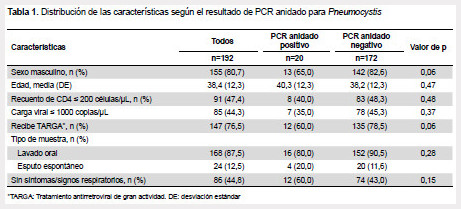
Se incluyeron 192 pacientes con promedio de edad en 38,4 años, siendo el 80,7% de sexo masculino. Veinte tuvieron resultado positivo del PCR-anidado para Pneumocystis (10,4%), 16 de los cuales fueron detectados en el lavado oral. No hubo diferencias estadísticamente significativas cuando se compararon a los pacientes con PCR-anidado positivo con aquellos con un resultado negativo en cuanto al sexo, la edad, el recuento de linfocitos CD4, la carga viral, el uso de tratamiento antirretroviral de gran actividad (TARGA), el tipo de muestra analizada, y la ausencia de síntomas respiratorios (Tabla 1).
Entre los pacientes con CD4 ≤ 200 células/µl, se compararon aquellos que recibían trimetoprim–sulfametoxazol profiláctico (n=54) y los que no recibían (n=37), no encontrándose diferencia estadísticamente significativa en el porcentaje de positivos (9,3% versus 8,1%, p >0,8). Se sabe que el uso de trimetoprim–sulfametoxazol previene el desarrollo de neumonía por Pneumocystis pero el rol que tiene sobre la colonización no ha sido plenamente identificado.
Ocho de los 106 pacientes que no presentaban síntomas respiratorios tuvieron PCR-anidado positivo (7,6%), comparado con 12 de los 86 pacientes (13,9%) que presentaban algún síntoma respiratorio. Aunque hubo una frecuencia mayor de detección de Pneumocystis en este último grupo, la diferencia no fue estadísticamente significativa.
Detectamos la presencia de Pneumocystis en 10,4% de pacientes con infección VIH/sida con CD4 menor a 500 células/µl, siendo el porcentaje de 7,6% en aquellos pacientes sin síntomas respiratorios. Este porcentaje es menor al descrito que va 20% a 69% (5). Es posible que hayamos encontrado una baja tasa de detección porque en casi 90% analizamos el lavado oral. No encontramos diferencia en la detección de Pneumocystis en relación al recuento de linfocitos CD4, la carga viral, el uso TARGA, o la profilaxis con trimetoprim-sulfametoxazol.
Nuestro estudio tiene varias limitaciones, en la mayoría de pacientes evaluamos la presencia de Pneumocystis de la muestra de lavado oral y la positividad en estas secreciones no necesariamente corresponde a colonización pulmonar. Otra limitación fue la falta de seguimiento de los pacientes lo que hubiera permitido definir el rol de la detección de Pneumocystis en el posterior desarrollo o no de la enfermedad. Finalmente, tampoco pudimos identificar otras causas que explicaran la presencia de síntomas respiratorios.
Encontramos una baja frecuencia de Pneumocystis en pacientes con VIH-sida a través del PCR anidado analizando principalmente el lavado oral. No encontramos diferencia en la detección de Pneumocystis en relación al recuento de linfocitos CD4, la carga viral, el uso TARGA, o la profilaxis con trimetoprim-sulfametoxazol.
Contribución de los autores: CG ha participado de la concepción, recolección de resultados, análisis de datos y redacción del artículo, TO ha participado de la concepción y diseño, EN ha participado en recolección de resultados, JC y FA han participado en recolección de resultados, y BB ha participado de la concepción, y redacción del artículo.
Fuentes de financiamiento: El estudio fue parcialmente financiado por ERANet LAC subvención # ELAC2014/HID-0254, a través de Fondecyt según convenio N° 083-2015.
Conflicto de interés: Los autores declaran no tener conflictos de interés
REFERENCIAS BIBLIOGRÁFICAS
1. Huang L, Cattamanchi A, Davis JL, Boon S Den, Kovacs J, Meshnick S, et al. HIV-associated Pneumocystis pneumonia. Proc Am Thorac Soc. 2011;8(3):294-300.
2. Wakefield A, Pixley F, Banerji S, Sinclair K, Miller R, Moxon E. Detection of Pneumocystis carinii with DNA amplification. Lancet. 1990;336:451-453.
3. Tamburrini E, Mencarini P, Visconti E, Zolfo M, De Luca A, Siracusano A, et al. Detection of Pneumocystis carinii DNA in blood by PCR is not of value for diagnosis of P. carinii pneumonia. J Clin Microbiol. 1996;34(6):1586-8.
4. Saiki R, Scharf S, Faloona F, Mullis K, Horn G, HA E, et al. Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia. Science (80- ). 1985;230(4732):1350-4.
5. Morris A, Norris KA. Colonization by Pneumocystis jirovecii and its role in disease. Clin Microbiol Rev. 2012;25(2):297-317.
Correspondencia: Coralith García
Dirección: Instituto de Medicina Tropical Alexander von Humboldt, Universidad Peruana Cayetano Heredia. Av. Honorio Delgado 430 San Martin de Porres Lima 31 Perú
Teléfono: +51-1-3190000 Anexo 201320
Correo electrónico: coralith.garcia@upch.pe
Recibido: 03/12/2018
Aprobado: 13/03/2019
En línea: 28/06/2019