Eduardo Villalobos-Pacheco
Danilo Chávez-Rojas
Juan Rodriguez-Tafur Dávila
Manuel Palomino-Yamamoto
10.17843/rpmesp.2020.372.4756
ARTÍCULO ORIGINAL
Actividad antitumoral de biopolímeros aislados de Vibrio sp. en cáncer de mama inducido en ratas
Antitumor activity of Vibrio sp. isolated biopolymers in induced breast cancer in rats
Daisy Flores-Cortez
![]() 1,2, Médico cirujano, magíster en Farmacología, doctora en
Ciencias de la Salud
1,2, Médico cirujano, magíster en Farmacología, doctora en
Ciencias de la Salud
Eduardo Villalobos-Pacheco
![]() 2,3, licenciado en Obstetricia, magíster en Fisiología
2,3, licenciado en Obstetricia, magíster en Fisiología
Danilo Chávez-Rojas
![]() 4, químico, magíster en Ciencias Químicas
4, químico, magíster en Ciencias Químicas
Juan Rodriguez-Tafur Dávila
![]() 1, Médico cirujano, magíster en Inmunología
1, Médico cirujano, magíster en Inmunología
Manuel Palomino-Yamamoto
![]() 1,2, Médico cirujano, doctor en Ciencias de la Salud
1,2, Médico cirujano, doctor en Ciencias de la Salud
1 Laboratorio de
Farmacología, Facultad de Medicina Humana, Universidad Nacional Mayor de San
Marcos, Lima, Perú.
2 Centro de Investigación en Recursos Naturales (CIRNA),
Universidad Nacional Mayor de San Marcos, Lima, Perú.
3 Facultad de Medicina Humana, Universidad Científica del Sur,
Lima, Perú.
4 Laboratorio de Química, Facultad de Ingeniería, Universidad
Nacional Tecnológica de Lima Sur (UNTELS), Lima, Perú.
RESUMEN
Objetivo: Evaluar la actividad antitumoral del extracto crudo de biopolímeros aislados de la bacteria marina Vibrio sp. en cáncer de mama inducido por N-Methyl-N-nitrosourea (MNU) en ratas.
Materiales y métodos: Se cultivó la bacteria marina Vibrio sp. durante siete días, luego se filtró, precipitó y concentró el sobrenadante crudo. Se administró una dosis única de MNU 50 mg/kg a 39 ratas Holtzman y fueron tratadas diariamente durante nueve semanas por vía oral: G1 (n = 13): suero fisiológico 0,1 mL/100 g; G2 (n = 13): extracto crudo de biopolímeros de Vibrio sp. 20 mg/kg; G3 (n = 13): tamoxifeno 100 mg/kg. El G4 (n = 11) solo recibió suero fisiológico 0,1 mL/100 g. Se valoró semanalmente el peso corporal y la aparición de tumores mamarios identificados mediante palpación; así como el examen histopatológico al final del tratamiento.
Resultados: El 77% de las ratas del grupo G1 desarrollaron tumores a partir de la séptima semana en un promedio de 2,2 tumores por cada animal; en contraste al grupo tratado con el extracto crudo de biopolímeros y tamoxifeno; donde solo una rata (8%) en cada grupo desarrolló tumores y posterior a la semana nueve de la inducción (p = 0,001). Los resultados histopatológicos sostienen que todos los tumores extirpados corresponden a adenocarcinoma ductal de mama con distintos patrones: sólido, papilar y quístico. Asimismo, se evidenciaron focos necróticos en el 30% de los tumores del grupo G1.
Conclusión: El extracto crudo de biopolímeros aislados de Vibrio sp. presentan efecto antitumoral en cáncer de mama inducido en ratas.
Palabras clave: Biopolímeros; Vibrio; Metilnitrosourea; Cáncer de Mama (fuente: DeCS BIREME).
ABSTRACT
Objective: To evaluate the antitumor activity of the raw extract from biopolymers isolated from the Vibrio sp. marine bacteria in breast cancer induced by N-Methyl-N-nitrosourea (MNU) in rats.
Materials and methods: The Vibrio sp. marine bacteria was cultured for seven days, then the raw supernatant was filtered, precipitated and concentrated. MNU was administered in a single dose of 50 mg/kg to 39 Holtzman rats and were daily treated for 9 weeks orally: G1 (n = 13): 0.1 mL/100 g of saline solution; G2 (n = 13): 20 mg/kg of raw extract from Vibrio sp. biopolymers; G3 (n = 13): 100 mg/kg of tamoxifen; G4 (n = 11) received no MNU and only 0.1 mL/100 g of saline solution. Body weight and the appearance of breast tumors identified by palpation were assessed weekly, as well as histopathological examination at the end of treatment.
Results: Seventy-seven percent of the rats in the G1 group developed tumors from week 7 onwards in an average of 2.2 tumors per animal; in contrast to the group treated with the raw biopolymer extract and tamoxifen; where only one rat (8%) in each group developed tumors after week nine of induction (p = 0.001). The histopathological results support that all the removed tumors correspond to breast ductal adenocarcinoma with different patterns: solid, papillary and cystic. Likewise, necrotic foci were evidenced in 30% of the tumors of the G1 group.
Conclusion: The raw extract of biopolymers isolated from Vibrio sp. present antitumor effect in breast cancer induced in rats.
Keywords: Biopolymers; Vibrio; Methylnitrosourea; Breast Cancer (source: MeSH NLM).
INTRODUCCIÓN
El cáncer de mama es un problema sociosanitario por su elevada incidencia y mortalidad, la complejidad terapéutica y el alto costo de tratamiento (1,2). Dentro de las opciones terapéuticas, la quimioterapia está ligada a potenciales efectos adversos multisistémicos que recaen en la falta de adherencia y un aumento de la morbimortalidad. Esto ha originado que, en las últimas décadas, se incremente la búsqueda de nuevas sustancias con potencial antitumoral como alternativas de tratamiento; tal es el caso de los productos naturales derivados de organismos marinos considerando que de ellos se deriva más del 60% de los agentes antineoplásicos utilizados actualmente (3-5).
Diversos péptidos, producidos por especies marinas y de sus bacterias hospederas, presentan una amplia gama de actividad biológica con acción antimicrobiana, antitumoral y antiviral. Entre los mecanismos que involucran el efecto antineoplásico se encuentra el bloqueo de la división celular, lo cual afecta principalmente a la tubulina, de manera similar a las drogas alcaloides de la vinca y a los taxanos (6). Drogas derivadas de péptidos de origen marino como la trabectedina, citarabina, vidarabine y ziconotide han sido aprobadas por la Unión Europea y por la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) para estadios avanzados del sarcoma de tejidos blandos y en cáncer de ovario (7-10). Se estima que 118 productos naturales de origen marino (MNP, por sus siglas en inglés) se encuentran en ensayos preclínicos; 22 MNP, en ensayos clínicos; y 4 MNP, en el mercado farmacéutico (11).
Las bacterias del género Vibrio se caracterizan por ser miembros autóctonos de la biota bacteriana de los mares y estuarios, y constituye del 0,1 al 60% del total de las bacterias heterotróficas. Hay estudios que muestran que el extracto crudo producido por algunas especies de este género presentan actividad antibacteriana contra el Staphylococcus aureus, resistente a meticilina, y actividad citotóxica contra algunas líneas celulares (12). Otros estudios señalan que los péptidos obtenidos del género Vibrio presentan acción citotóxica contra la línea celular de leucemia murina P388 (13). Asimismo, uno de los compuestos producidos por un miembro de Vibrionaceae marina se encuentra en un ensayo clínico para el tratamiento del cáncer de próstata, pulmón e hígado y posiblemente estos metabolitos sensibilicen las células tumorales a la citólisis mediada por macrófagos (14).
En consecuencia, la evaluación de la actividad antitumoral de los péptidos derivados de la Vibrio sp. marino constituye una importante línea de investigación biotecnológica y farmacológica; sin embargo, se requieren más estudios para determinar la eficacia de su actividad biológica en tumores sólidos como en el cáncer de mama. El presente estudio tiene como objetivo evaluar el efecto antitumoral de los biopolímeros aislados de la bacteria marina Vibrio sp. en cáncer de mama inducido por N-Methyl-N-nitrosourea (MNU) en ratas.
|
MENSAJES CLAVE |
|
Motivación para realizar el estudio: Las glucoproteínas de especies marinas constituyen una alternativa para tratar el cáncer. Se pretende contribuir al avance científico en la farmacología oncológica con la búsqueda de nuevas drogas derivadas de bacterias marinas que ofrezcan eficacia preventiva o terapéutica, con un buen perfil de seguridad para el tratamiento del cáncer de mama. Principales hallazgos: El extracto crudo de biopolímeros aislados de Vibrio sp. presentan efecto antitumoral en cáncer mamario inducido en ratas. Implicancias: Promover la potencialidad antitumoral de biopolímeros aislados de Vibrio sp. en adenocarcinoma mamario como una alternativa coadyuvante eficaz y segura. |
MATERIALES Y MÉTODOS
Población y muestra
Se realizó un estudio experimental, con dos grupos de comparación. Un grupo (n = 13) con cáncer de mama inducido por MNU y un segundo grupo (n = 11) con animales sin la enfermedad. La asignación de los sujetos experimentales fue aleatoria. Todos los ensayos farmacológicos se realizaron en el Laboratorio de Investigación de Farmacología de la Facultad de Medicina de la Universidad Nacional Mayor de San Marcos (UNMSM).
Animales
Se emplearon 50 ratas hembras de 21 días de edad de la cepa Holtzman adquiridas en el Instituto Nacional de Salud (INS), las cuales fueron acondicionadas en el Bioterio de la Facultad de Medicina de la UNMSM, en jaulas de acero inoxidable con un ciclo de luz-oscuridad (12-12 horas), a una temperatura ambiental aproximada de 23 °C. Asimismo, recibieron una dieta balanceada peletizada y agua ad libitum. El tiempo de acondicionamiento previo al inicio del experimento fue siete días. Todos los animales fueron atendidos de acuerdo con las directrices del INS para el cuidado y utilización de animales de experimentación (15).
Procedimiento
Microorganismos y condiciones de cultivo
La bacteria marina Vibrio sp. fue proporcionada por el cepario del Instituto del Mar del Perú (IMARPE) (Estación E14-Pisco). Se seleccionó el género Vibrio porque se ha reportado que produce metabolitos bioactivos y que el extracto crudo ha mostrado actividad antibacteriana y citotóxica contra algunas líneas celulares (12,16); la actividad inhibitoria de este género nos orienta a que además tendría actividad antitumoral.
La preparación del caldo de cultivo de la bacteria se llevó a cabo en cuatro litros de agua de mar estéril enriquecido con D-glucosa (5 g/L) y peptona de carne (3 g/L) donde se inoculó la bacteria de acuerdo a protocolo estándar y se agitó manual y diariamente por un periodo de cinco minutos durante siete días a temperatura ambiente.
Una vez concluida la fermentación, el caldo de cultivo se centrifugó durante 30 minutos, removiéndose así las células y sólidos remanentes. El sobrenadante se filtró mediante un sistema de soporte Microfil (Merck Millipore) con un filtro bacteriológico de 0,2 µm para eliminar bacterias presentes en el sobrenadante.
Extracción del extracto crudo de biopolímeros a partir de la fermentación
El filtrado concentrado (30 mL) de sobrenadante se precipitó con una solución saturada de sulfato de amonio ([NH4]2SO4) hasta una concentración final de 70%. Se dejó en reposo durante 24 horas a 4 °C y, después de este tiempo, se centrifugó 400 g durante 30 minutos, y se obtuvo un precipitado de color blanco amarillento que se disolvió en el mínimo volumen de agua destilada; el resultante se llevó a secado en una estufa a una temperatura máxima de 40 °C. El producto final fue disuelto en agua destilada a una concentración de 20 mg/mL.
Evaluación de la actividad antitumoral de los biopolímeros
Para la inducción del cáncer se emplearon 39 ratas a las que se administró una dosis única de MNU (Sigma, St. Louis, MO, EUA) 50 mg/kg intraperitonealmente (IP). De acuerdo con este modelo, los tumores inducidos por MNU presentan regulación hormonal dependiente de estrógenos, sujeta a factores de crecimiento similar a la descrita para el cáncer de mama humano (17).
Luego, los animales fueron distribuidos aleatoriamente en tres grupos y tratados vía oral (VO): G1 (n = 13): suero fisiológico 0,1 mL/100 g; G2 (n = 13): extracto crudo de biopolímeros aislados de Vibrio sp. 20 mg/kg; G3 (n = 13): tamoxifeno 100 mg/kg. Un último grupo no recibió MNU y fue tratado con suero fisiológico 0,1 mL/100 g (G4 (n = 11)). Los tratamientos se realizaron diariamente, seis días por semana, en un mismo horario durante nueve semanas.
Valoración de la actividad antitumoral
Semanalmente, se valoraron el peso corporal de los animales y el consumo de la dieta. Además, las ratas fueron examinadas por un mismo evaluador, quien realizó la palpación de la línea mamaria para evidenciar tumores y registró el tiempo de aparición de estos. Al término del experimento los animales fueron eutanasiados con 100 mg/kg de pentobarbital sódico. Se registró el número, peso, tamaño y la localizacion de cada tumoración palpable; además se evaluó la presencia visible de metástasis en la cadena linfática y otros órganos.
Todos los tumores fueron escindidos, fijados en formol neutro al 10% y luego procesados por un técnico en patología usando métodos rutinarios en condiciones uniformes de fijación e inclusión en parafina y teñidos en secciones de 6 mm con hematoxilina y eosina. Para determinar la malignidad de las muestras de tejido mamario se consideraron los siguientes criterios histopatológicos: pérdida de patrón tubular-alveolar de la glándula mamaria normal, presencia de células epiteliales grandes con un aumento de la relación citoplasmática nuclear, respuesta estromal por fibrosis e infiltración de células inflamatorias, necrosis y hemorragia (18). La lectura de las láminas fue realizada por un patólogo especializado en el Instituto de Patología de la Facultad de Medicina de la UNMSM.
Análisis estadístico
Las variables numéricas fueron expresadas en promedio y desviación estándar (DE), mientras que las variables categóricas se expresaron como frecuencias relativas. Se determinó si existían diferencias significativas entre los tres grupos de tratamiento empleando la prueba Kruskal-Wallis; cuando se encontraron diferencias intragrupo, se empleó la prueba U de Mann-Whitney para las comparaciones pares entre grupos de tratamiento. Para variables cualitativas respecto a la presencia o ausencia de tumoración se empleó la asociación lineal por lineal. Se consideró un p < 0,05 como estadísticamente significativo.
Aspectos éticos
El cuidado de los animales fue conducido de acuerdo a la guía institucional para el cuidado de roedores del INS. Para efectos de este experimento se eligió el método de eutanasia inducido por pentobarbital 100 mg/kg. Este procedimiento es considerado un método aceptable para roedores según las publicaciones «Report of the AVMA Panel on Eutanasia» de la American Veterinary Medical Association (1993) y «Euthanasia of Experimental Animals» de la Unión Europea (1995) (19).
RESULTADOS
Uno de los parámetros observados para evaluar el compromiso de la enfermedad fue la ganancia de peso corporal al término del tratamiento: el grupo tratado con solo el inductor de cáncer (MNU) presentó una ganancia de peso promedio de 115 g; mientras que en los animales tratados con MNU + extracto crudo de biopolímeros aislados de Vibrio sp. se observa una ganancia de peso de 141 g, siendo esta diferencia significativamente mayor (p = 0,03) al grupo MNU y cercana al grupo control (133 g) (Figura 1).
MNU: metilnitrosurea; SF:
suero fisiológico
a Valor de p de la prueba U Mann-Whitney para comparaciones
pareadas en relación al control MNU.
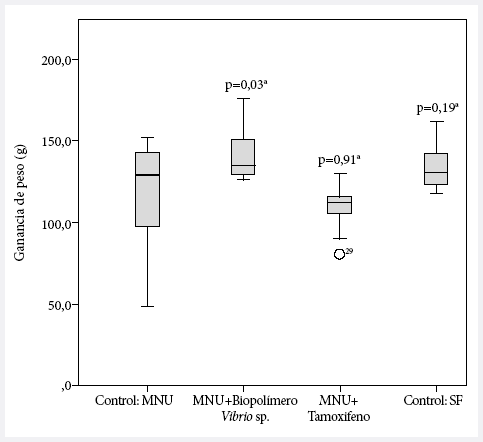
Figura 1. Ganancia de peso al término del estudio en animales tratados con biopolímeros de la bacteria marina Vibrio sp.
En la Figura 2, se muestra el promedio de animales que desarrollaron tumores y se observa que el 76,9% de las ratas correspondientes al grupo control desarrollaron tumores al final del experimento; mientras que solo el 7,7% de los animales de los grupos MNU + biopolímeros de la bacteria marina Vibrio sp. y MNU + tamoxifeno presentaron tumores (p = 0,001). Las localizaciones más frecuentes fueron axilares, suprainguinal y suprapúbico en ambos lados de la cadena mamaria; asimismo, el periodo de latencia de aparición de tumores fue siete semanas para el grupo control MNU y nueve semanas para el grupo MNU + biopolímeros.
MNU: metilnitrosurea; SF:
suero fisiológico.
a Valor de p < 0,001 para la asociación lineal por lineal en
relación a control MNU.
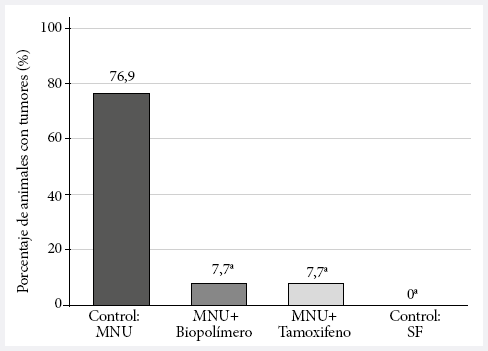
Figura 2. Porcentaje de tumores palpables en animales tratados con biopolímeros de la bacteria marina Vibrio sp.
El total de tumoraciones observadas en el grupo control fueron 22 con un promedio de 2,2 tumores por cada animal, mientras que solo se evidenció una tumoración en cada uno de los grupos MNU + extracto crudo de biopolímeros de la bacteria Vibrio sp. y MNU + tamoxifeno, tal como se muestra en la Tabla 1. Además, se observa que el peso promedio de la tumoración observada en el grupo tratado con extracto crudo de biopolímeros fue mayor al tratado solo con MNU, sin embargo, para el caso del grupo tratado con tamoxifeno, el tumor desarrollado fue notoriamente menor al control.
Tabla 1. Número de tumores palpables y peso promedio de las tumoraciones en ratas tratadas con biopolímeros de la bacteria marina Vibrio sp.
|
Variable |
Control: MNU |
MNU + biopolímero |
MNU + tamoxifeno |
Control: SF |
Valor de p a |
|
Número total de tumores |
22 |
1b |
1b |
0b |
<0,001 |
|
Peso promedio de los tumores (g) |
2,02 |
2,98 |
0,26 |
0 |
- |
MNU: metilnitrosurea; SF:
suero fisiológico
a
Valor de p obtenido con la prueba Kruskall Wallis.
b
Prueba de U Mann-Whitney para comparaciones pareadas en relación al control
MNU: p < 0,01.
De acuerdo con los resultados histopatológicos, todos los tumores extirpados corresponden a adenocarcinoma ductal de mama con distintos patrones: sólido, papilar y quístico. Asimismo, se observaron focos necróticos en el 30% de los tumores encontrados en el grupo MNU, lo que sugiere una mayor capacidad invasiva de la tumoración (Tabla 2).
Tabla 2. Observaciones histopatológicas agrupadas según tratamientos, en la inducción del cáncer de mama por metilnitrosurea.
|
Grupo |
Principales hallazgos histopatológicos en los tumores extirpados |
Número de casos |
|
Control: MNU |
Adenocarcinoma ductal de mama con distintos patrones: sólido, papilar y quístico, respuesta estromal por fibrosis e infiltración de células inflamatorias con focos necróticos. |
10 |
|
MNU + biopolímero |
Adenocarcinoma ductal de mama con patrón papilar. |
1 |
|
MNU + tamoxifeno |
Adenocarcinoma ductal de mama con distintos patrones: sólido, papilar y quístico. |
1 |
|
Control: SF |
Glándula mamaria con características normales sin alteraciones histopatológicas. |
0 |
MNU: metilnitrosurea; SF: suero fisiológico
DISCUSIÓN
Los organismos marinos y sus metabolitos representan un enorme potencial de recursos y productos terapéuticos naturales sin explotar. Las proteínas bacterianas y los péptidos derivados de organismos marinos son un grupo prometedor de compuestos bioactivos y posibles fármacos antioncológicos; entre ellos, figuran los antibióticos anticancerígenos (actinomicina D, bleomicina, doxorrubicina, mitomicina C) y las toxinas bacterianas usadas en el tratamiento del cáncer, mientras que, otras sustancias se encuentran en ensayos clínicos o se analizaron en investigación in vitro (20,21).
Mediante el empleo de un modelo estándar inducido por MNU se ha podido reproducir el cáncer de mama en ratas; esto nos ha permitido explorar in vivo la actividad antitumoral de los biopolímeros extraídos del cultivo de la bacteria marina Vibrio sp. Según los resultados, el periodo de latencia de la aparición de tumoraciones en el grupo control fue siete semanas postinducción; mientras que en el grupo tratado con MNU + biopolímeros fue nueve semanas, similar al grupo tratado con tamoxifeno, lo que demostraría que los biopolímeros retrasarían la aparición de tumores inducidos por MNU. Además, destacamos que en los grupos tratados con biopolímeros solo el 7,7% de los animales desarrollaron tumores en contraste al grupo control donde el 77,9% de los animales presentaron tumores con un promedio de 2,93 por cada animal.
Aunque no se conoce el mecanismo de protección, otros autores postulan que en los tumores sólidos, los biopolímeros extraídos de bacterias marinas tendrían un efecto inmunomodulador, activando los mecanismos de lucha contra las células tumorales produciendo cierta regresión del tumor y, por consiguiente, una prolongación del periodo de latencia de aparición de tumores y de la vida de los animales (22).
Los estudios realizados con el género Vibrio aislado de especies marinas han mostrado que produce sustancias con actividad antagónica contra otras bacterias patógenas (16). Conde, et al. (12) evaluaron la actividad citotóxica y desreplicación de las fracciones extraídas del medio de cultivo de Vibrio diabolicus; los autores mostraron que las fracciones F4 y F6 eran citotóxicas contra la línea celular de cáncer epitelial del cuello uterino humano, SiHa con una CI50 de >100 µg/ml y 80 µg/ml, respectivamente. Por otro lado, la fracción F5 mostró una actividad citotóxica mayor con una CI50 de 28 µg/ml contra la misma línea celular. Además, ninguna de estas fracciones mostró inhibición de la línea celular no tumoral (CI50 >100 µg/ml).
Cao, et al. (23) investigaron los mecanismos moleculares del polisacárido EPS11 de origen bacteriano marino (Bacillus sp.) sobre la citotoxicidad en cáncer de pulmón de células pequeñas. Los autores descubrieron que el EPS11 afecta significativamente la proliferación celular y bloquea la adhesión en las células tumorales. Además, la expresión de varias proteínas asociadas a la adhesión celular está regulada negativamente y las estructuras filiformes de las células de cáncer de pulmón se destruyen después del tratamiento con EPS11. Este mismo biopolímero también ha demostrado que inhibe el crecimiento celular del cáncer de hígado al bloquear la adhesión celular y atenuar la formación de la estructura filiforme, y detener la metástasis de las células cancerosas (24).
Los estudios de la acción de biopolímeros derivados de bacterias marinas en cáncer de mama solo han sido realizados en modelos in vitro de líneas celulares de carcinoma mamario. Mahgoub et al. (25) evaluaron el efecto de un biopolímero aislado de la cepa bacteriana marina Bacillus velezensis en las líneas celulares de cáncer de mama MCF-7. De acuerdo con los resultados publicados, este metabolito aumenta la apoptosis y dificulta la proliferación de células MCF-7 entre 5-80 μg/ml en comparación con el grupo control. Además, la apoptosis inducida se asocia con la activación de caspasa-3 que se presenta de una manera dependiente de la dosis y sin citotoxicidad contra las células normales; resultados similares fueron reportados por Sirpu et al. (26) con el extracto crudo parcialmente purificado (PPCEBS, por sus siglas en inglés) de Bacillus subtilis NMK17 marino en la línea celular de cáncer de mama humano MCF-7. Los hallazgos demostraron que el PPCEBS induce significativamente la apoptosis en la línea celular estudiada y provocaría un aumento de la expresión de caspasa-3 y Bax lo que reveló el posible mecanismo de la propiedad inductora de apoptosis. De igual modo, el PPCEBS también presentó actividades antibacterianas y antioxidantes.
Estos resultados sugirieron que los compuestos presentes en el PPCEBS en la bacteria marina B. subtilis NMK17 serían metabolitos citotóxicos que podrían ser candidatos para desarrollar un fármaco específico de apoptosis de células tumorales de la línea mamaria, con una toxicidad mínima. Sin embargo, otros autores observan que dos nuevos hexapéptidos cíclicos, venturamida A y B obtenidas de la cianobacteria marina Oscillatoria sp. solo presentan actividad leve cuando se probaron contra células cancerosas de mama MCF-7 con un valor CI50 de 13,1 y >54 µM, respectivamente (27). Asimismo, al aislar pitiprolamida, un depsipéptido cíclico derivado de la cianobacteria marina Lyngbya majuscule, solo se advirtió una débil actividad citotóxica contra el carcinoma colorrectal HCT116 y las líneas celulares de adenocarcinoma de mama MCF7 (CI50 33 µM para ambos) (28).
Además del efecto antitumoral, se observó que la ganancia de peso fue significativamente mayor para el grupo tratado con extracto crudo de biopolímeros derivado de la bacteria Vibrio sp. en relación con el grupo control (Figura 2). Estos resultados tienen una implicancia antitumoral positiva ya que, la pérdida ponderal en el cáncer obedece a una incrementada demanda calórica debido a la presencia del tumor (con la correspondiente competencia por los nutrientes entre las células del paciente y las del tumor) y la malnutrición debida a la anorexia provocada por las citoquinas procaquécticas liberadas durante la progresión de la enfermedad (29).
Por otro lado, solo un animal en el grupo tratado con biopolímeros presentó una tumoración, siendo el peso del tumor superior al peso promedio del control. Sin embargo, esto solo se observó en una tumoración y en un animal en una proporción 1/13 en contraste al grupo control donde se presentó un promedio de 2,2 tumores por animal y en una proporción 10/13; por lo que se podría considerar como un hecho aislado.
Se requiere realizar una ampliación del tamaño de muestra y la dosificación de biopolímeros a fin de obtener una curva dosis-respuesta. Además, es necesario ampliar el tiempo de observación, para evaluar el efecto de los biopolímeros en el curso natural de la enfermedad. A pesar que el modelo de cáncer mamario inducido por MNU replica muchas características fisiopatológicas de lo observado en la enfermedad en seres humanos, contribuiría mucho emplear un modelo in vivo con infiltración de una línea celular tumoral humana en animales de experimentación. Algunos mecanismos de acción del efecto antitumoral sugeridos podrían estar relacionados con la activación de la apoptosis de las células tumorales y activación del sistema inmune, tal como se ha observado en cultivos con otras bacterias (24,26).
La principal limitación del estudio es que no ha sido posible aislar, identificar ni realizar la caracterización química de los biopolímeros obtenidos y solo se ha evaluado su extracto crudo, por lo que sería necesario realizar fraccionamiento y pruebas farmacológicas para identificar la fracción con mejor actividad antitumoral. Si bien es cierto que se incluyeron tres grupos (un grupo control de animales sanos, un grupo con la enfermedad y otro grupo tratado con un fármaco estándar para tratamiento de cáncer de mama), nuestra limitación fue no incluir un grupo experimental tratado con el medio de cultivo libre de biopolímeros, además no realizamos ensayos de toxicidad aguda y crónica de los biopolímeros.
Los resultados muestran que el extracto crudo de la bacteria Vibrio sp. puede constituir una fuente de biopolímeros con actividad antitumoral por lo que se sugiere profundizar con la investigación en cáncer de mama, así como su posible mecanismo de acción y el metabolito activo. La extrapolación de los beneficios esperados con la aplicación de técnicas especiales de aislamiento del principio activo permitiría ser un candidato potencial en la prevención y el tratamiento de enfermedades neoplásicas.
Agradecimientos:
A la Dra. Rita Orozco Moreira del Laboratorio de Microbiología del Instituto del Mar del Perú y al Dr. Hernán Velarde del Instituto de Patología de la Facultad de Medicina de la UNMSM.
REFERENCIAS BIBLIOGRÁFICAS
1. Ministerio de Salud. Plan nacional para la prevención y control de cáncer de mama en el Perú 2017- 2021 [Internet]. MINSA; 2017 [citado el 2 de agosto de 2019]. Disponible en: http://bvs.minsa.gob.pe/local/MINSA/4234.pdf.
2. Smith BD, Jiang J, Shih YC, Giordano SH, Huo J, Jagsi R, et al. Cost and complications of local therapies for early-stage breast cancer. J Natl Cancer Inst. 2017;109(1):1-9. doi: 10.1093/jnci/djw178.
3. Giordano D, Costantini M, Coppola D, Lauritano C, Núñez Pons L, Ruocco N, et al. Biotechnological Applications of Bioactive Peptides From Marine Sources. Adv Microb Physiol. 2018;73:171-220. doi: 10.1016/bs.ampbs.2018.05.002.
4. Yun C, Kim H, Lee S. Therapeutic application of diverse marine-derived natural products in cancer therapy. Anticancer Res. 2019;39(10):5261-84. doi: 10.21873/anticanres.13721.
5. Suarez-Jimenez GM, Burgos-Hernandez A, Ezquerra-Brauer JM. Bioactive peptides and depsipeptides with anticancer potential: sources from marine animals. Mar Drugs. 2012;10(5):963-86. doi: 10.3390/md10050963.
6. Lazcano-Pérez F, Román-González SA, Sánchez-Puig N, Arreguin-Espinosa R. Bioactive peptides from marine organisms: a short overview. Protein Pept Lett. 2012;19(7):700-7. doi: 10.2174/092986612800793208.
7. Kobayashi J. Search for new bioactive marine natural products and application to drug development. Chem Pharm Bull. 2016;64(8):1079-83. doi: 10.1248/cpb.c16-00281.
8. Newman DJ, Cragg GM. Current status of marine-derived compounds as warheads in anti-tumor drug candidates. Mar Drugs. 2017;15(4):E99-118. doi: 10.3390/md15040099.
9. Kang HK, Choi MC, Seo CH, Park Y. Therapeutic properties and biological benefits of marine-derived anticancer peptides. Int J Mol Sci. 2018;19(3):E919-59. doi: 10.3390/ijms19030919.
10. Mayer A, Glaser KB, Cuevas C, Jacobs RS, Kem W, Little RD, et al. The odyssey of marine pharmaceuticals: a current pipeline perspective. Trends Pharmacol Sci. 2010;31(6):255-65. doi: 10.1016/j.tips.2010.02.005.
11. Nastrucci C, Cesario A, Russo P. Anticancer drug discovery from the marine environment. Recent Pat Anticancer Drug Discov. 2012;7(2):218-32. doi: 10.2174/157489212799972963.
12. Conde-Martínez N, Bauermeister A, Pilon AC, Lopes NP, Tello E. Integrating molecular network and culture media variation to explore the production of bioactive metabolites by Vibrio diabolicus A1SM3. Mar Drugs. 2019;17(4):196-225. doi: 10.3390/md17040196.
13. Sandy M, Han A, Blunt J, Munro M, Haygood M, Butler A. Vanchrobactin and anguibactin siderophores produced by Vibrio sp. DS40M4. J Nat Prod. 2010;73(6):1038-43. doi: 10.1021/np900750g.
14. Mansson M, Gram L, Larsen T. Production of bioactive secondary metabolites by marine Vibrionaceae. Mar Drugs. 2011;9(9):1440-68. doi: 10.3390/md9091440.
15. Fuentes F, Mendoza R, Rosales A, Cisneros R. Guía de manejo y cuidado de animales de laboratorio: Ratón [Internet]. Lima: INS; 2008 [citado el 2 de agosto de 2019]. Disponile en: http://www.ins.gob.pe/insvirtual/images/otrpubs/pdf/GUIA_ANIMALES_RATON.pdf.
16. Leon J, Liza L, Soto I, Torres M, Orosco A. Bacterias marinas productoras de compuestos antibacterianos aisladas a partir de invertebrados intermareales. Rev Peru Med Exp Salud Publica. 2010;27(2):215-21. doi: 10.1590/S1726-46342010000200009.
17. Gusterson BA, Williams JC. N-nitrosomethylurea-induced rat mammary tumours as models of human breast cancer. J R Soc Med. 1981;74(1):56-9.
18. Russo J, Russo IH. Atlas and Histologic Classification of Tumors of the Rat Mammary Gland. J Mammary Gland Biol Neoplasia. 2000;5(2):187-200. doi: 10.1023/a:1026443305758.
19. Close B, Banister K, Baumans V, Bernoth E, Bromage N, Bunyan J, et al. Recomendaciones para la eutanasia de los animales de experimentación [Internet]. Lab Anim (NY); 1997 [citado el 2 de agosto de 2019]. Disponible en: http://sea.umh.es/files/2011/07/eutanasia2.pdf.
20. Karpinski T, Adamczak A. Anticancer Activity of Bacterial Proteins and Peptides. Pharmaceutics. 2018;10(2):54-99. doi: 10.3390/pharmaceutics10020054.
21. Negi B, Kumar D, Rawat DS. Marine Peptides as Anticancer Agents: A Remedy to Mankind by Nature. Curr Protein Pept Sci. 2017;18(9):885-904. doi: 10.2174/1389203717666160724200849.
22. Pérez RM, Avila CAD, Cruz M, Miravet ME, Calderón CF, Montalvo M, et al. Actividad antitumoral en tumores experimentales; purificación y caracterización parcial de biopolímeros extraídos de fermentados de bacterias marinas. Rev Inst Nac Cancerol (Mex). 2000;46(3):160-6.
23. Cao R, Jin W, Shan Y, Wang J, Liu G, Kuang S, et al. Marine Bacterial Polysaccharide EPS11 Inhibits Cancer Cell Growth via Blocking Cell Adhesion and Stimulating Anoikis. Mar Drugs. 2018;16(3):85-114. doi: 10.3390/md16030085.
24. Wang J, Liu G, Ma W, Lu Z, Sun C. Marine Bacterial Polysaccharide EPS11 Inhibits Cancer Cell Growth and Metastasis via Blocking Cell Adhesion and Attenuating Filiform Structure Formation. Mar Drugs. 2019;17(1):50-65. doi: 10.3390/md17010050.
25. Mahgoub AM, Mahmoud MG, Selim MS, EL Awady ME. Exopolysaccharide from Marine Bacillus velezensis MHM3 Induces Apoptosis of Human Breast Cancer MCF-7 Cells through a Mitochondrial Pathway. Asian Pac J Cancer Prev. 2018;19(7):1957-63. doi: 10.22034/APJCP.2018.19.7.1957.
26. Sirpu Natesh N, Arumugam M, Karanam G. Apoptotic role of marine sponge symbiont Bacillus subtilis NMK17 through the activation of caspase-3 in human breast cancer cell line. Mol Biol Rep. 2018;45(6):2641-51. doi: 10.1007/s11033-018-4434-y.
27. Linington RG, González J, Ureña L-D, Romero LI, Ortega-Barría E, Gerwick WH. Venturamides A and B: Antimalarial Constituents of the Panamanian Marine Cyanobacterium Oscillatoria sp. J Nat Prod. 2007;70(3):397-401. doi: 10.1021/np0605790.
28. Montaser R, Abboud KA, Paul VJ, Luesch H. Pitiprolamide, a proline-rich dolastatin 16 analogue from the marine cyanobacterium Lyngbya majuscula from Guam. J Nat Prod. 2011;74(1):109-12. doi: 10.1021/np1006839.
29. Argilés JM, Busquets S, Stemmler B, López-Soriano FJ. Cancer cachexia: Understanding the molecular basis. Nat Rev Cancer. 2014;14(11):754-62. doi: 10.1038/nrc3829.
Citar como: Flores-Cortez D, Villalobos-Pacheco E, Chávez-Rojas D, Rodriguez-Tafur Dávila J, Palomino-Yamamoto M. Actividad antitumoral de biopolímeros aislados de Vibrio sp. en cáncer de mama inducido en ratas. Rev Peru Med Exp Salud Publica. 2020;37(2):246-52. doi: https://doi.org/10.17843/rpmesp.2020.372.4756
Fuentes de financiamiento: El proyecto fue financiado por el Vicerrectorado de Investigación de la UNMSM (Resolución Rectoral N.° 01414-R-12. Código del proyecto: 120114011).
Correspondencia: Daisy Flores Cortez; Av. Grau 755, Lima, Perú; dfloresc@unmsm.edu.pe
Contribuciones de los autores: DFC, EVP, DCR, MPY y JRTD han participado en la concepción, desarrollo de la investigación y redacción del artículo. DFC, EVP, MPY y JRTD realizaron la revisión crítica del artículo. DCR realizó el aislamiento y los biopolímeros de bacteria marina Vibrio sp. Todos los autores participaron en la evaluación de resultados, su interpretación, la aprobación de la versión final del manuscrito y asumen responsabilidad de los contenidos del artículo.
Conflictos de interés: Los autores no tienen ningún conflicto de interés que declarar.
Recibido: 20/08/2019
Aprobado: 13/04/2020
En línea: 12/06/2020