10.17843/rpmesp.2020.372.4772
ARTÍCULO ORIGINAL
Meningitis neonatal:
estudio multicéntrico en Lima, Perú
Neonatal meningitis: a
multicenter study in Lima, Peru
Daniel Guillén-Pinto
 1,2, Neurólogo/a pediatra
1,2, Neurólogo/a pediatra
Bárbara Málaga-Espinoza
 1, médica general
1, médica general
Joselyn Ye-Tay  1, médica general
1, médica general
María Luz Rospigliosi-López
 1,2, neonatóloga/o
1,2, neonatóloga/o
Andrea Montenegro-Rivera
 1, pediatra
1, pediatra
María Rivas
 4, Neurólogo/a pediatra
4, Neurólogo/a pediatra
María Luisa Stiglich
 4, Neurólogo/a pediatra
4, Neurólogo/a pediatra
Sonia Villasante-Valera
 4, neonatóloga/o
4, neonatóloga/o
Olga Lizama-Olaya
 7, neonatóloga/o
7, neonatóloga/o
Alfredo Tori  7, Neurólogo/a pediatra
7, Neurólogo/a pediatra
Lizet Cuba
 5, médica general
5, médica general
Luis Florián  5, neonatóloga/o
5, neonatóloga/o
Leidi Vilchez-Fernández
 6, neuróloga
6, neuróloga
Oscar Eguiluz-Loaiza
 6, neonatóloga/o
6, neonatóloga/o
Carmen Rosa Dávila-Aliaga
 3, neonatóloga/o
3, neonatóloga/o
Pilar Medina-Alva
 1,3, Neurólogo/a pediatra
1,3, Neurólogo/a pediatra
1 Universidad
Peruana Cayetano Heredia, Lima, Perú.
2 Hospital Cayetano Heredia, Lima, Perú.
3
Instituto Nacional Materno Perinatal, Lima, Perú.
4 Hospital
Nacional Docente Madre Niño San Bartolomé, Lima, Perú.
5
Hospital Nacional Arzobispo Loayza, Lima, Perú.
6 Hospital
Nacional Daniel Alcides Carrión, Lima, Perú.
7 Hospital
Nacional Guillermo Almenara Irigoyen, Lima, Perú.
RESUMEN
Objetivo: Determinar
la incidencia y las características clínicas, bacteriológicas y del líquido
cefalorraquídeo de la meningitis neonatal en hospitales de Lima.
Materiales y métodos: Se
realizó un estudio observacional, multicéntrico en seis hospitales de la ciudad
de Lima, con una vigilancia epidemiológica durante un año.
Resultados: La
incidencia acumulada hospitalaria fue de 1,4 casos por mil nacidos vivos. Fueron
incluidos 53 casos de meningitis neonatal, 34% (18/53) fueron tempranos y 66%
(35/53) tardíos. Los factores maternos asociados fueron líquido amniótico
meconial e infección de tracto urinario. El 58,8% (30/51) presentó controles
prenatales insuficientes. El factor neonatal más asociado fue sepsis. Los
principales síntomas fueron fiebre, irritabilidad, hipoactividad y dificultad
respiratoria. En el líquido cefalorraquídeo (LCR) se destacó la pleocitosis, sin
predominio de polimorfonucleares (PMN), hipoglucorraquia y proteinorraquia. Los
patógenos aislados con mayor frecuencia fueron Escherichia coli y
Listeria monocytogenes.
Conclusiones: La
incidencia hospitalaria de meningitis neonatal fue de 1,4 por mil nacidos vivos,
siendo diez veces mayor en prematuros. La dificultad respiratoria fue el síntoma
más frecuente en la forma temprana, mientras que la fiebre e irritabilidad en la
forma tardía. El LCR mostró pleocitosis sin predominio de PMN. Los gérmenes más
frecuentes fueron Escherichia coli y Listeria monocytogenes.
La ventriculitis e hidrocefalia fueron las complicaciones neurológicas más
comunes.
Palabras clave:
Meningitis; Neonato; Prematuro; Líquido Cefalorraquídeo; Perú (fuente: DeCs
BIREME).
ABSTRACT
Objective: To
determine the incidence and the clinical, bacteriological and cerebrospinal
fluid characteristics of neonatal meningitis in Lima hospitals.
Materials and methods:
An observational, multicenter study was conducted in six hospitals in the city
of Lima during 1 year of epidemiological surveillance.
Results: The cumulative
hospital incidence was 1.4 cases per 1000 live births. A total of 53 cases of
neonatal meningitis were included, 34% (18/53) were early and 66% (35/53) late.
The associated maternal factors were meconium-stained amniotic fluid and urinary
tract infection. Insufficient prenatal check-ups were found in 58.8% (30/51).
The most associated neonatal factor was sepsis. The main symptoms were fever,
irritability, hypoactivity and respiratory distress. Pleocytosis in
cerebrospinal fluid (CSF) was significant, without predominance of
polymorphonuclear lymphocytes (PMN), hypoglycorrhagia and proteinorrhagia. The
most frequent pathogens isolated were Escherichia coli and Listeria
monocytogenes.
Conclusions: The
hospital incidence of neonatal meningitis was 1.4 per 1000 live births, being
ten times higher in preterm infants. Breathing difficulty was the most frequent
symptom in the early stage, while fever and irritability in the late stage. CSF
showed pleocytosis without predominance of PMN. The most frequent germs were
Escherichia coli and Listeria monocytogenes. Ventriculitis and
hydrocephalus were the most common neurological complications.
Keywords:
Meningitis; Newborn; Premature; Cerebrospinal Fluid; Peru (source: MeSH
NLM).
INTRODUCCIÓN
La meningitis neonatal (MN)
es una enfermedad devastadora conocida desde hace más de un siglo. En las
primeras publicaciones se destacaba su rareza clínica y engorroso proceso
diagnóstico (1,2).
Sin embargo, con el tiempo se ha reportado en todos los continentes, y a
pesar de los avances científicos y tecnológicos, sigue siendo un problema de
salud pública (3).
La
incidencia varía considerablemente. En los países desarrollados, se estima
alrededor de 0,3 casos por mil nacidos vivos; mientras que, en los países en
desarrollo esta incidencia puede llegar hasta 6,1 casos por mil nacidos
vivos (3). Con los nuevos métodos la detección ha mejorado y la
mortalidad ha disminuido; no obstante la morbilidad se mantiene elevada
(20‑60%) (4).
En el
Perú, Oliveros informó 0,47 casos por mil nacidos vivos en 1993 (6).
No obstante, en los últimos años se viene observando una tendencia
ascendente que oscila entre 0,9 y 1,5 casos por mil nacidos vivos (5-7).
Incidencia que podría ser mayor en nuestra población por la gran frecuencia
de factores materno-perinatales, tales como control prenatal insuficiente,
sepsis, inmadurez por prematuridad y factores inherentes al cuidado
intensivo neonatal (5).
La MN se
clasifica en temprana y tardía (8). La MN temprana inicia dentro
de las primeras 72 horas y se relaciona con la contaminación a través del
canal del parto con bacterias tales como Escherichia coli, Streptococcus
grupo B y Listeria monocytogenes (9,10). Después de las 72
horas, la MN tardía se relaciona con gérmenes del ambiente hospitalario,
como el Staphylococcus coagulasa negativo y bacilos gramnegativos (Escherichia
coli, Klebsiella pneumoniae, Enterobacter spp.) (9-11).
La MN
constituye una emergencia de salud, y tan pronto se sospeche, debe indicarse
tratamiento antibiótico empírico (12). Sin embargo, el
diagnóstico resulta complejo debido a la baja especificidad de los signos y
síntomas y la dificultad para aislar los gérmenes por cultivo, quedando como
único recurso la sospecha clínica ante la presencia de los factores de
riesgo (2,8).
Dada la
escasa información sobre MN en nuestro país, como su frecuencia, impacto en
la morbimortalidad y la prevalencia de los patógenos involucrados
(9,12), resulta de suma importancia conocer el perfil epidemiológico y
clínico de la enfermedad. Por tal razón, el objetivo del estudio fue estimar
la incidencia, factores asociados, características clínicas y del líquido
cefalorraquídeo (LCR), etiología y complicaciones de la MN en hospitales de
la ciudad de Lima.
|
MENSAJES CLAVE |
|
Motivación para realizar
el estudio: La frecuencia de meningitis neonatal en algunos hospitales y
la ausencia de un protocolo de manejo motivaron un estudio de vigilancia
epidemiológica en Lima.
Principales hallazgos:
Se encontró una incidencia de 1,4 casos por mil nacidos vivos, con mayor
proporción en prematuros. Los síntomas fueron inespecíficos, destacando la
dificultad respiratoria en la forma temprana, y la fiebre e irritabilidad en
la tardía. El líquido cefalorraquídeo mostró pleocitosis moderada con
hipoglucorraquia e hiperproteinorraquia. Predominaron Eschericha coli
y Listeria monocytogenes.
Implicancias: Se
requiere uniformizar los criterios diagnósticos y de manejo de MN. Asimismo,
continuar la vigilancia epidemiológica en las unidades neonatales de nuestro
país.
|
MATERIALES Y MÉTODOS
Diseño y población
Se realizó un estudio
de serie de casos, multicéntrico, entre el 2017 y el 2018, con el
objetivo de hacer una vigilancia epidemiológica hospitalaria de MN por
12 meses consecutivos en hospitales de Lima, sin intervenir en los
procesos de diagnóstico y tratamiento.
Para ser
incluidos en el estudio, los hospitales debían contar con unidades
neonatales, médicos neonatólogos, personal de enfermería especializado,
especialistas en neurología o neuropediatría, recursos de neuroimagen y
laboratorio clínico apto para el procesamiento de análisis generales y
examen citoquímico y bacteriológico del LCR. Con este propósito, se
seleccionaron 12 hospitales, de los cuales se incluyeron seis que cumplieron
los criterios de inclusión: Hospital Cayetano Heredia (HCH), Hospital
Nacional Docente Madre Niño San Bartolomé (HNDMNSB), Hospital Nacional
Arzobispo Loayza (HNAL), Instituto Nacional Materno Perinatal (INMP),
Hospital Nacional Guillermo Almenara Irigoyen (HNGAI) y el Hospital Nacional
Daniel Alcides Carrión (HNDAC). Todos fueron establecimientos de salud nivel
III.
Se
organizó un equipo de investigación con médicos representantes de los seis
hospitales, que se capacitaron en el proceso de inclusión, seguimiento y
toma de datos clínicos y laboratoriales. Todos los centros contaron con un
neonatólogo y un neurólogo. Se desarrollo un sistema de alerta de caso
nuevo. Los responsables de cada hospital, confirmaron la posibilidad de
caso, se registró, comunicó y se realizó el seguimiento y recolección de
datos hasta el egreso. Se creó una ficha clínica ad hoc, donde se
registraron los datos de filiación, sexo, edad, edad gestacional, datos
prenatales, natales y posnatales, del LCR y bacteriológicos. No hubo
interferencia en las decisiones de manejo. En todos los hospitales se
presentaron los objetivos del proyecto al equipo médico pediátrico.
Con la
finalidad de estimar las incidencias hospitalarias, se registraron el número
de nacimientos durante el periodo de observación, según el registro
perinatal y oficina de estadística de cada hospital. Finalmente, se
registraron los nacimientos prematuros por edad gestacional y sexo.
Variables
Ingresaron al estudio todos
los neonatos a termino menores de 28 días o prematuros menores de 44 semanas
de edad corregida. Los criterios de inclusión para todos los casos de MN
fueron neonatos sintomáticos o con riesgo de infección; pleocitosis ≥ 30
leucocitos/µL en LCR, diagnóstico y atención en el hospital donde nació. El
seguimiento hospitalario concluyó con el egreso del paciente. Fueron
excluidos los neonatos con malformaciones cerebrales severas y disrafías
espinales.
La MN se
categorizó como confirmada (germen identificado), probable (gran sospecha
bacteriana) y posible (baja sospecha bacteriana) (5,11). Se
definió como MN confirmada cuando se identificó el germen en el LCR, por
cultivo, reacción en cadena de polimerasa (PCR, por sus siglas en inglés),
coaglutinaciones o por hemocultivo. La MN probable se definió con
hipoglucorraquia (glucorraquía ≤50% de la sérica o glucorraquía absoluta de
≤40 mg/dL) e hiperproteinorraquia (proteinorraquía ≥60 mg/dL) (5,8).
Los casos de MN posibles tuvieron cualquier nivel de glucorraquía o
proteinorraquía o bioquímica normal. Los virus se identificaron por reacción
en cadena de polimerasa (PCR) o inmunofluorescencia indirecta viral (IFI
viral) en el LCR. Los hongos se identificaron por cultivo/PCR del LCR. Para
las punciones lumbares (PL) traumáticas se descontó un leucocito por cada
500 hematíes en LCR.
Se
consideró MN temprana cuando los casos confirmados, probables o posibles, se
diagnosticaron antes de las 72 horas de edad. Mientras que MN tardía, a
aquellos casos cuyo diagnóstico fue a partir de las 72 horas de edad
(5,8). Las complicaciones neurológicas tempranas se definieron dentro
de los siete primeros días de detectada la enfermedad. Las complicaciones
consideradas fueron hidrocefalia, ventriculitis, efusión subdural e infarto
cerebral, identificadas por ecografía cerebral o resonancia magnética
cerebral.
Con la
finalidad de medir la carga de enfermedad, se registraron los casos
extrahospitalarios, definidos como casos de MN nacidos en otros hospitales y
admitidos durante el periodo de estudio.
Se
registraron y analizaron un conjunto de variables prenatales, natales y
posnatales. Numéricas (edad materna, control prenatal, edad gestacional,
peso de nacimiento) y categóricas (infección urinaria materna, fiebre
materna, corioamnionitis, presencia de líquido amniótico meconial,
preeclampsia / eclampsia, asfixia, hemorragia intraventricular, sepsis,
anemia, aspiración meconial, fiebre, dificultad respiratoria, hipoactividad,
irritabilidad, vómitos). Asimismo, características del LCR y frecuencias de
los gérmenes, tratamiento, complicaciones y letalidad.
Consideraciones éticas
La identidad de los
pacientes se protegió mediante códigos numéricos. Asimismo, el proyecto fue
aprobado por el Comité Institucional de Ética de la Universidad Peruana
Cayetano Heredia y por los comités de ética de cada uno de los hospitales
participantes.
Análisis estadístico
La información fue
recolectada y almacenada en una base de datos en el programa Excel Microsoft
2016 ©. Posteriormente, fue exportada al programa STATA© versión 13. Se
determinó la incidencia acumulada durante un año de observación en cada
hospital, el inicio del proyecto fue en varios meses sucesivos en el 2017 y
concluyó secuencialmente en el 2018. La incidencia acumulada fue estimada
con la suma de los casos confirmados, casos probables y posibles entre el
número de nacidos vivos. Para el cálculo de la incidencia no se consideraron
los casos extrahospitalarios.
Se
muestran las frecuencias de las variables clínicas y de laboratorio para MN
temprana, tardía y extrahospitalaria. Las variables numéricas se resumieron
con medianas y su rango intercuartílico. Se realizó regresión logística para
determinar la influencia de algunos factores sobre la meningitis temprana
respecto a la meningitis tardía analizado con todos los casos. La
homogeneidad se determinó con las pruebas de Levene y de Forsythe-Browne.
Solo hubo datos perdidos en la variable controles prenatales, por lo que no
fue necesario ninguna técnica de reemplazo.
RESULTADOS
Enrolamiento de
pacientes
El proyecto se inició
en el 2017. Dado que el enrolamiento de los hospitales fue sucesivo, el
estudio concluyó en el 2018. Durante este periodo se registraron un
total de 38 513 neonatos vivos en los seis hospitales, de los cuales
fueron incluidos 51 pacientes que desarrollaron 53 casos de MN, un
paciente presentó tres episodios de MN. El 41,5% (22/53) fueron neonatos
que habiendo egresado del mismo hospital en buenas condiciones
reingresaron por sospecha de un proceso infeccioso. Durante el periodo
de estudio fueron admitidos siete casos extrahospitalarios (Figura
1), considerados solo para el perfil de análisis clínico, etiológico
y de laboratorio.
MN: meningitis neonatal
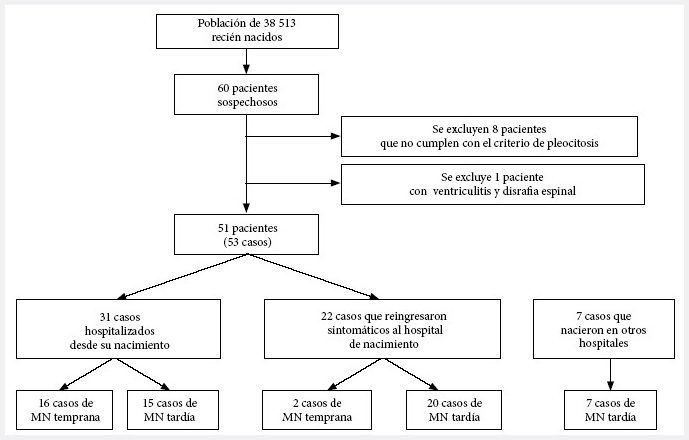
Figura 1. Flujograma
de los pacientes.
El
promedio de la edad materna fue 27,2 años y la paridad fue de 2,3
gestaciones por mujer. Asimismo, los controles prenatales fueron
insuficientes en 58,8% (30/51) de las madres. El 54,7% (29/53) nacieron
prematuros menores de 37 semanas. La población estudiada fue homogénea entre
los hospitales incluidos.
Características
epidemiológicas
La incidencia
hospitalaria fue de 1,4 casos por mil nacidos vivos, con una amplia
variación entre los hospitales, de 0 a 3,2 casos por mil nacidos vivos.
El HCH y el HNDMNSB tuvieron la mayor incidencia. En prematuros menores
de 37 semanas, la incidencia de MN fue de 7,5 casos por mil nacidos
vivos, y de 0,7 casos por mil nacidos vivos a término (Tabla
1).
Tabla 1. Incidencia
acumulada de meningitis neonatal por mil nacidos vivos según sede hospitalaria.
|
Institución |
Total |
Prematuros |
|
Nacidos vivos |
Casos |
Incidencia acumulada
(por mil nacidos vivos) |
Nacidos vivos |
Casos |
Incidencia acumulada
(por mil nacidos vivos) |
|
Hospital Nacional Cayetano Heredia |
4436 |
14 |
3,2 |
826 |
7 |
8,5 |
|
Hospital Nacional Docente Madre
Niño San Bartolomé |
6155 |
20 |
3,2 |
395 |
8 |
20,3 |
|
Instituto Nacional Materno Perinatal |
18 138 |
17 |
0,9 |
1634 |
13 |
8,0 |
|
Hospital Nacional Arzobispo Loayza |
2765 |
1 |
0,4 |
226 |
0 |
0,0 |
|
Hospital Nacional Daniel Alcides Carrión |
3915 |
1 |
0,3 |
481 |
1 |
2,1 |
|
Hospital Guillermo Almenara Irigoyen |
3104 |
0 |
0,0 |
280 |
0 |
0,0 |
|
Total |
38 513 |
53 |
1,4 |
3842 |
29 |
7,5 |
Vigilancia por el periodo de un
año
La razón
varón/mujer fue de 1,4. Los varones fueron 58,3% (35/60) y las mujeres 41,7%
(25/60). La mayoría de los pacientes eran de Lima Norte con 42% (25/60),
destacando los distritos de San Martín de Porres y Los Olivos; luego
siguieron los distritos de Lima Este con 15% (9/60). En la
Figura 2, se observa que los casos procedían de zonas aledañas a los
hospitales.
HCH: Hospital Cayetano Heredia
HSB: Hospital San Bartolomé
HNAL: Hospital Nacional Arzobispo Loayza
HDAC: Hospital Daniel Alcides Carrión
INMP: Instituto Nacional Materno Perinatal

Figura 2. Distribución de casos de meningitis neonatal según distrito de
procedencia (Lima Metropolitana)
Se
registró un 34% (18/53) de casos de la forma temprana y un 66% (35/53) de
casos de la tardía. Los casos de MN confirmada fueron 58,5% (31/53), de los
cuales 25,8% (8/31) fueron tempranos y 74,2% (23/31) tardíos. La MN
bacteriana se dio en el 87,1% (27/31) y la MN viral, en el 12,9% (4/31), la
MN probable fue 22,6% (12/53) y de MN posible 18,9% (10/53). Con respecto a
los pacientes extrahospitalarios, cuatro tuvieron MN confirmada, dos MN
probable y una posible.
Características clínicas
Para la MN temprana,
los factores prenatales asociados fueron el líquido amniótico meconial
(38,9%), la infección de tracto urinario (33,3%), fiebre materna (27,8)
y corioamnionitis (22,2%). Sin embargo, en la forma tardía estos
factores no parecieron tener mayor influencia (Tabla 2).
Tabla 2. Características
prenatales, natales y posnatales, según tipo de meningitis
|
Característica |
MN temprana (n = 18) |
MN tardía (n = 35) |
MN extrahospitalaria (n = 7) |
|
n (%) |
n (%) |
n (%) |
|
Parto por cesárea |
11 (61,1) |
18 (51,4) |
3 (42,9) |
|
Controles prenatales |
|
|
|
|
<6 |
10 (55,5) |
17 (54,8) |
3 (42,9) |
|
6 o más |
4 (22,3) |
14 (45,2) |
3 (42,9) |
|
Factores prenatales y natales |
|
|
|
|
Medicamentos en el embarazo |
0 (0,0) |
1 (2,9) |
1 (14.3) |
|
Fiebre materna |
5 (27,8) |
1 (2,9) |
0 (0,0) |
|
Ruptura prematura de membranas >18 h |
3 (16,7) |
9 (25,7) |
0 (0,0) |
|
Infección del tracto urinario |
6 (33,3) |
7 (20,0) |
2 (28,6) |
|
Infección vaginal |
0 (0,0) |
2 (5,7) |
1 (14,3) |
|
Cirugía pélvica-uterina |
1 (5,6) |
0 (0,0) |
0 (0,0) |
|
Líquido amniótico meconial |
7 (38,9) |
9 (25,7) |
1 (14,3) |
|
Corioamnionitis |
4 (22,2) |
5 (14,3) |
0 (0,0) |
|
Parto prolongado |
2 (11,1) |
1 (2,9) |
0 (0,0) |
|
Preeclampsia/eclampsia |
2 (11,1) |
5 (14,3) |
1 (14,3) |
|
Restricción de crecimiento intrauterino |
0 (0,0) |
2 (5,7) |
0 (0,0) |
|
Sexo masculino |
11 (61,1) |
20 (57,1) |
4 (57,1) |
|
Edad gestacional (semanas) |
|
|
|
|
<37 |
11 (61,1) |
18 (51,4) |
3 (42,9) |
|
≥37 |
7 (38,9) |
17 (48,6) |
4 (57,1) |
|
Peso (gramos) |
|
|
|
|
<1500 |
4 (22,2) |
9 (25,7) |
2 (28,6) |
|
1500 a 2499 |
7 (38,9) |
10 (28,6) |
1 (14,3) |
|
≥2500 |
7 (38,9) |
16 (45,7) |
4 (57,1) |
|
Edad de inicio de síntomas (días)
a |
0,9 (1,8) |
18,6 (20,1) |
11,9 (11,6) |
|
Factores posnatales |
|
|
|
|
Sepsis |
9 (50,0) |
7 (20,0) |
3 (42,9) |
|
Asfixia |
1 (5,6) |
0 (0,0) |
2 (28,6) |
|
Aspiración meconial |
0 (0,0) |
1 (2,9) |
1 (14,3) |
|
Hemorragia intraventricular |
4 (22,2) |
2 (5,7) |
1 (14,3) |
|
Anemia |
0 (0,0) |
1 (2,9) |
0 (0,0) |
|
Neumonía connatal |
1 (5,6) |
0 (0,0) |
0 (0,0) |
|
Ictericia patológica |
0 (0,0) |
0 (0,0) |
1 (14,3) |
|
Síntomas |
|
|
|
|
Fiebre |
7 (38,9) |
19 (54,3) |
5 (71,4) |
|
Irritabilidad |
7 (38,9) |
20 (57,1) |
3 (42,9) |
|
Hipoactividad |
7 (38,9) |
17 (48,6) |
4 (57,1) |
|
Dificultad respiratoria |
13 (72,2) |
10 (28,6) |
3 (42,9) |
|
Succión débil |
4 (22,2) |
12 (34,3) |
3 (42,9) |
|
Vómitos |
1 (5,6) |
2 (5,7) |
4 (57,1) |
|
Ictericia |
4 (22,2) |
4 (11,4) |
5 (71,4) |
|
Apnea |
5 (27,8) |
7 (20,0) |
1 (14,3) |
|
Convulsiones |
2 (11,1) |
6 (17,1) |
1 (14,3) |
|
Fontanela abombada |
3 (16,7) |
2 (5,7) |
3 (42,9) |
|
Hipotonía |
5 (27,8) |
6 (17,1) |
3 (42,9) |
|
Hipertonía |
3 (16,7) |
2 (5,7) |
2 (28,6) |
|
Hiperreflexia |
1 (5,6) |
3 (8,6) |
1 (14,3) |
|
Hiporreflexia |
2 (11,1) |
1 (2,9) |
2 (28,6) |
|
Letalidad |
1 (5,6) |
1 (2,9) |
0 (0,0) |
MN: meningitis neonatal
a
Media (DE)
La
sepsis fue el factor más importante con relación a la MN, siendo 50% (9/18)
en meningitis temprana, 20% (7/35) en meningitis tardía y 42,9 (3/7) en
meningitis extrahospitalaria. La edad de inicio de los síntomas en los casos
tempranos fue a los 0,9 días; en la forma tardía, a los 18,6 días; y en los
casos extrahospitalarios, a los 11,9 días. Los síntomas fueron más
frecuentes en la forma temprana, con mayor frecuencia de la dificultad
respiratoria. En la forma tardía predominaron la fiebre, irritabilidad e
hipoactividad (Tabla 2). En la Tabla 5,
se observan los factores asociados con el riesgo de meningitis temprana
respecto a la MN tardía.
Tabla 5. Factores
asociados a la meningitis neonatal temprana respecto a la meningitis neonatal
tardía
|
Factor |
OR |
Valor de p |
IC 95% |
|
Fiebre materna |
18,51 |
0,021 |
1,56-219,87 |
|
Sepsis |
5,10 |
0,040 |
1,08-24,07 |
|
Dificultad respiratoria |
4,59 |
0,043 |
1,05-20,11 |
|
Parto por cesárea |
4,12 |
0,079 |
0,85-20,01 |
OR: Odds Ratio, IC 95%:
intervalo de confianza al 95%
Características
citoquímicas y bacteriológicas del LCR
En promedio, para los casos
de MN temprana y tardía se realizaron 2,5 y 2 PL, respectivamente. En la
mayoría de los casos de MN temprana, la PL se realizó durante el primer día
de hospitalización; y en los casos de MN tardía, pudo demorar hasta el
tercer día de enfermedad.
En la
Tabla 3, se presentan las características citoquímicas del LCR. La
mediana de la pleocitosis fue de 225 leucocitos/µL para la MN temprana y de
202 leucocitos/µL para la MN tardía, con una mediana de polimorfonucleares
(PMN) de 57% y 30%, respectivamente. La hipoglucorraquía fue similar en
ambas formas de meningitis y la hiperproteinorraquía fue mayor en la MN
temprana. En la forma extrahospitalaria se observa menor pleocitosis y mayor
glucorraquía (Tabla 3).
Tabla 3. Características
del líquido cefalorraquídeo, según tipo de meningitis
|
|
MN temprana (n = 18) |
MN tardía
(n = 35) |
MN extrahospitalaria (n = 7) |
|
Mediana |
RIC |
Mediana |
RIC |
Mediana |
RIC |
|
Leucocitos (células/μL) |
225 |
130-1912 |
202 |
45-530 |
150 |
32-866 |
|
PMN (%) |
57 |
30-70 |
30 |
10-52 |
60 |
35-60 |
|
Glucosa (mg/dL) |
36 |
24-42 |
32 |
25-44 |
43 |
34-46 |
|
Proteínas (mg/dL) |
188 |
115-499 |
125 |
81-201 |
139 |
62-266 |
|
Hematíes (células/μL) |
100 |
10-500 |
3 |
0-100 |
32 |
5-50 |
MN: meningitis neonatal, RIC:
rango intercuartil (percentiles 25 y 75), PMN: polimorfonucleares
Se
identificaron 35 gérmenes, entre bacterias, virus y un caso de Candida
albicans. En todas las formas clínicas predominaron Escherichia coli
y Listeria monocytogenes. En el 17,1% (6/35) de los casos se aisló el
germen tanto en hemocultivo como en el LCR, Escherichia coli en
cuatro casos, Streptococcus grupo B y Staphylococcus coagulasa
negativo, un caso cada una. Por inmunofluorescencia indirecta
(IFI) se identificaron casos de influenza B, coronavirus y adenovirus. En un
solo caso se realizó reacción en cadena a la polimerasa (PCR) aislando
Herpes virus VI (Tabla 4).
Tabla 4. Aislamiento del
agente infeccioso según tipo de meningitis
|
Agente infeccioso |
Fluido
cultivado |
MN
temprana |
MN
tardía |
MN
extrahospitalaria |
Total |
|
Escherichia coli |
LCR |
3/18 |
2/35 |
0/7 |
10/60
a |
|
Sangre |
2/18 |
7/35 |
0/7 |
|
Listeria monocytogenes |
LCR |
1/18 |
2/35 |
0/7 |
8/60 |
|
Sangre |
3/18 |
2/35 |
0/7 |
|
Staphylococcus
coagulasa negativo |
LCR |
0/18 |
1/35 |
1/7 |
3/60
a |
|
Sangre |
1/18 |
1/35 |
0/7 |
|
Streptococcus
grupo B |
LCR |
0/18 |
1/35 |
1/7 |
2/60
a |
|
Sangre |
0/18 |
0/35 |
1/7 |
|
Enterococo faecium |
LCR |
0/18 |
0/35 |
0/7 |
2/60 |
|
Sangre |
1/18 |
1/35 |
0/7 |
|
Staphilococus epidermidis |
LCR |
0/18 |
0/35 |
0/7 |
2/60 |
|
Sangre |
0/18 |
2/35 |
0/7 |
|
Serratia marcescens |
LCR |
0/18 |
0/35 |
0/7 |
1/60 |
|
Sangre |
0/18 |
1/35 |
0/7 |
|
Serratia liquecies |
LCR |
0/18 |
0/35 |
0/7 |
1/60 |
|
Sangre |
0/18 |
1/35 |
077 |
|
Staphilococus hominis |
LCR |
0/18 |
0/35 |
0/7 |
1/60 |
|
Sangre |
0/18 |
0/35 |
1/7 |
|
Influenza B (IFI) |
LCR |
0/18 |
1/35 |
0/7 |
1/60 |
|
Adenovirus (IFI) |
LCR |
0/18 |
1/35 |
0/7 |
1/60 |
|
Coronavirus (IFI) |
LCR |
0/18 |
1/35 |
0/7 |
1/60 |
|
Herpes virus VI (PCR) |
LCR |
0/18 |
1/35 |
0/7 |
1/60 |
|
Candida albicans
(PCR) |
LCR |
0/18 |
0/35 |
0/7 |
1/60 |
|
Sangre |
0/18 |
0/35 |
1/7 |
MN: meningitis neonatal, LCR:
líquido cefalorraquídeo; PCR: reacción en cadena a la polimerasa; IFI:
inmunofluorescencia indirecta
a
Aislamiento del germen tanto en sangre como LCR
El total representa la carga de enfermedad atendida entre todos los hospitales.
Tratamiento y
condiciones especiales
Los esquemas de tratamiento
fueron muy variables. La duración media en los casos de MN temprana fue de
21 días y de meningitis tardía fue de 19,5 días. El 62% de niños recibieron
antibióticos antes que la primera PL fuera realizada. En general, los
medicamentos más usados fueron ampicilina (60%), cefotaxima (38%),
vancomicina (28%), meropenem (33%) y gentamicina (22%), en diferentes
esquemas.
En el
análisis específico de la meningitis tardía, sin incluir los pacientes
extrahospitalarios, se diferenciaron dos grupos (Figura 1).
En el primer grupo, el 86,7% (13/15) de los pacientes fueron pretérmino,
46,6% (7/15) cursaron con dificultad respiratoria, a la mayoría se
diagnosticó a los siete días de edad, y su LCR se caracterizó por una mayor
pleocitosis. En el segundo grupo, el 75% (15/20) fue a término, fiebre e
irritabilidad fueron los síntomas más frecuentes y el diagnóstico se realizó
dentro de los dos primeros días de hospitalización.
Tres
pacientes tuvieron presentaciones especiales: uno con pleocitosis menor y
bacteremia de foco urinario por Escherichia coli; otro con
citoquímica inicial normal, pero con cultivo de LCR positivo a
Escherichia coli que posteriormente desarrolla pleocitosis; y otro que
presenta tres episodios de meningitis (recurrente) por Escherichia coli
betalactamasa de espectro extendido.
Complicaciones y
letalidad
El 25% (15/60) de los casos
desarrollaron al menos una complicación neurológica. De estos, el 73,3%
(11/15) fueron en pretérminos. Las complicaciones neurológicas mediatas y
tardías fueron ventriculitis e hidrocefalia respectivamente.
La
mayoría de los casos tardíos egresaron con evolución favorable con 95,2%
(40/42), con menor expectativa los casos tempranos con 77,8% (14/18). Cuatro
casos fueron referidos a otro centro hospitalario de mayor complejidad.
Fallecieron dos neonatos (3,3%), uno en la forma temprana y otro en la forma
tardía.
DISCUSIÓN
La MN tuvo una incidencia
hospitalaria de 1,4 casos por mil nacidos vivos, con mayor riesgo en
prematuros que en neonatos a término. La amplia variabilidad de incidencias
hace sospechar que los protocolos de diagnóstico de MN no fueron uniformes
en los diferentes hospitales. Asimismo, se identificó una variedad de
gérmenes causales, mayoritariamente bacterias, llamando la atención la
frecuencia de
Eschericha coli y Listeria monocytogenes.
Presentamos un mayor escenario clínico de la MN a las conocidas: forma
temprana relacionada con las condiciones de nacimiento y la forma tardía
relacionada con la estancia prolongada de los prematuros en las unidades
neonatales (9). Aportamos la visión de una nueva forma, derivada
de la comunidad, la que ocurre más en neonatos a término, hacia la segunda
semana, relacionada con mayor proporción de agentes virales.
La
meningitis neonatal es una enfermedad prevalente que se encuentra
subdiagnosticada y subregistrada en nuestro país (5,13). En el
2016, Zea et al., hicieron notar que la PL se difiere con frecuencia
en sepsis confirmada (14). Asimismo, en una población semejante
se ha observado que el criterio médico puede variar dependiendo del nivel de
especialización médica (15).
Presentamos un estudio de vigilancia epidemiológica respetando los
protocolos de manejo de cada hospital. La incidencia de 1,4 por mil nacidos
vivos se encuentra en rangos intermedios a nivel mundial (3), y
de momento constituye una cifra referencial, que deberá ajustarse en el
futuro cuando se uniformicen los criterios de diagnóstico. No obstante, la
gran incidencia en los prematuros, alerta sobre su vigilancia en las
unidades neonatales (2,16).
Este
estudio se caracterizó por incluir casos con definida pleocitosis a fin de
asegurar el criterio inflamatorio de la meningitis clasificada en casos
confirmados, probables y posibles, según la definición de sepsis neonatal.
De esta forma, se observó mayor aislamiento en hemocultivo, luego tanto en
hemocultivo como en cultivo de LCR y pocos casos solo en LCR. Consideramos
que con la PCR se hubiera podido disminuir los casos probables y posibles, y
tal vez identificar casos de pleocitosis como solo un fenómeno inflamatorio
(8,9,17).
Todos
los factores de riesgo conocidos para sepsis neonatal, se relacionan con la
MN (12,18). Para la forma temprana se encontraron los factores
fiebre periparto y controles prenatales incompletos, que sugieren el riesgo
de invasión microbiana procedente de la flora vaginal, la subsecuente
respuesta inflamatoria placentaria, inicio de labor de parto y por
consecuencia sepsis y meningitis (8). No obstante, es posible
haya otros factores clínicos y socioculturales no considerados.
Clásicamente la MN se divide en temprana y tardía según su mecanismo de
contaminación (12,16,19). Sin embargo, hemos identificado un
tercer grupo de pacientes, que proceden de sus hogares, del propio ambiente
de la comunidad, son neonatos a término, febriles e irritables con menor
pleocitosis, contaminados con agentes comunes de las vías respiratorias,
tanto bacterianos como virales, y otros casos por gérmenes que colonizan las
secreciones maternas.
La edad
de inicio de los síntomas para ambas formas de MN se encontró entre los
rangos esperados, 0,9 días para los casos tempranos y 18,6 días en los casos
tardíos, de acuerdo con otras series, y que claramente se asociaron con el
nacimiento y la estancia en la unidad neonatal (12,16,20). El
grupo de niños de origen extrahospitalario se comportó también como MN
tardía con 11,9 días.
La
sintomatología fue más frecuente en la forma temprana que tardía, siendo los
síntomas muy inespecíficos y relacionados con la sepsis. Entre ellos, la
dificultad respiratoria destacó en el 70% de casos tempranos, tal vez por la
inmadurez pulmonar del grupo prematuro o por acidosis respiratoria
(3,12,16). En la forma tardía se observaron más síntomas de
localización cerebral (1,3). Sin embargo, su identificación
depende de la experiencia del examinador (14,21). Se pudo
determinar que tres factores tuvieron un mayor riesgo para desarrollar MN
temprana respecto a la MN tardía, estos fueron la fiebre materna, la sepsis
y la dificultad respiratoria. Probablemente, generados por las infecciones
maternas, infecciones urinarias y corioamnionitis (1,8). Quedará
para futuros estudios asegurar el diagnóstico de corioamnionitis por examen
patológico de la placenta.
En la
mayoría de los casos, se realizó más de una PL, siguiendo los lineamientos
internacionales. Dado que la MN es una enfermedad de difícil diagnóstico,
plurisintomática y causada por muchos gérmenes agresivos, las guías
recomiendan realizar la PL previo al uso de antibióticos y hacer un nuevo
control dentro de las 48-72 horas, especialmente si no hay mejoría clínica y
con la finalidad de asegurar la reducción de la carga bacteriana o la
esterilización del LCR (14,21,22).
En ambas
formas clínicas, se destacó la pleocitosis moderada sin predominio de PMN,
con hipoglucorraquia y proteínorraquia. Esta característica particular ya ha
sido observada en otros estudios nacionales (6,7), tal vez,
puedan mediar factores bacteriológicos, procesamiento de la muestra y
condiciones inmunológicas del paciente. En las MN bacterianas, la
hipoglucorraquia y proteínorraquia son hallazgos habituales explicados por
el consumo de glucosa y aumento del detritus, su persistencia por más de dos
semanas se ha asociado con mal pronóstico (23). No obstante,
estos indicadores pudieran agravarse por la presencia de hemorragia
intracraneal. Asimismo, en raras ocasiones, puede que la primera PL no
demuestre pleocitosis, siendo necesario una segunda muestra entre 12 a 24
horas siguientes (21).
El
comportamiento microbiológico de las MN ha variado con respecto al tiempo y
a las diferentes zonas geográficas (2,3,16,24-26), en
general en los países desarrollados destaca el Streptococo agalactie
y en los países no desarrollados los gramnegativos (3,24). En
esta serie la Eschericha coli y la Listeria monocytogenes
fueron los gérmenes prevalentes en ambas formas de MN, seguidos de una
miscelánea de gramnegativos y grampositivos, y menos casos por virus y uno
por Candida albicans, todos descritos en diferentes series de casos.
La MN
por Eschericha coli es una enfermedad conocida desde hace muchas
décadas (1,2) como parte de una sepsis neonatal temprana, también
puede ser causa de la forma tardía, generalmente asociada a severas
complicaciones agudas y mediatas, como la hidrocefalia, efusiones
subdurales, infartos cerebrales y abscesos (2,27). En los últimos
años ha llamado la atención la mayor frecuencia de cepas de betalactamasas y
su resistencia antimicrobiana (24,26). Por tanto, su presencia en
esta serie alerta sobre la pronta identificación y tratamiento.
La
Listeria monocytogenes es un patógeno que ha cobrado mayor importancia
en las series peruanas de los últimos años (5,7), concordante con
algunos reportes internacionales, entre 5-20% (26), se ha
observado en las formas tempranas y tardías, generalmente como enfermedad
moderada a severa. Sin embargo, no está claramente identificado su mecanismo
infeccioso, pero se entiende que la invasión es por vía genitourinaria y
relacionado con la flora intestinal de la madre.
La tasa
de letalidad por MN en los reportes nacionales ha ido disminuyendo con el
tiempo. En 1993, Oliveros, et al. reportaron 20% de fallecidos en una
serie de 24 casos (6), y en el 2017, Lewis en una serie de 53
pacientes reportó 3,8% (5), relacionado con el diagnóstico y
tratamiento oportuno. No obstante, la frecuencia de complicaciones
neurológicas fue del 25%, y destaca la gran morbilidad en prematuros (75%)
(28,29). En consecuencia, en los prematuros es muy importante el uso
del ultrasonido cerebral como herramienta diagnóstica de la hidrocefalia,
ventriculitis e infartos cerebrales (30).
Las
limitaciones del estudio fueron no haber incluido ciertas variables como el
uso de corticoides prenatales, infecciones intrauterinas, corioamnionitis
histológica, procedimientos invasivos, registro de los casos de sepsis sin
meningitis, sensibilidad y resistencia antimicrobiana, contactos en
comunidad, y no haber contado con la participación de más hospitales. Sin
embargo, las fortalezas fueron demostrar que la MN es frecuente, que los
prematuros tienen mayor riesgo, que la enfermedad puede tener varias formas
de presentación y que existe un amplio espectro de agentes infecciosos. Con
estas consideraciones, contribuimos al conocimiento nacional de la
enfermedad.
En
conclusión, la incidencia hospitalaria de MN fue 1,4 casos por mil nacidos
vivos, siendo mayor en prematuros. La dificultad respiratoria fue el síntoma
más frecuente de la meningitis temprana, mientras que la fiebre y la
irritabilidad lo fueron de la MN tardía. En el LCR se destacó la pleocitosis
moderada, con hipoglucorraquia y proteinorraquia. Los patógenos aislados con
mayor frecuencia fueron Eschericha coli y Listeria monocytogenes y
las complicaciones neurológicas más comunes fueron ventriculitis e
hidrocefalia. Se plantea un nuevo escenario patogénico de la MN, con tres
formas: vertical por gérmenes de flora vaginal; nosocomial por contaminación
en las unidades neonatales; y de la comunidad por gérmenes comunes.
Se
recomienda realizar un estudio nacional de vigilancia epidemiológica
estandarizado de MN, uniformizando los criterios de diagnóstico (clínico,
citoquímico, cultivos, reacción cadena a la polimerasa), de neuroimagen
(ultrasonido y resonancia) e identificación de los factores de riesgo
perinatal.
REFERENCIAS
BIBLIOGRÁFICAS
1. Bell WE, McCormick
WF, Murillo PL. Meningitis neonatales. Infecciones neurológicas en el
niño. 2a ed. Barcelona: Salvat; 1979.
2. Ziai M, Haggerty RJ.
Neonatal meningitis. N Engl J Med. 1958;259(7):314-20. doi:
10.1056/NEJM195808142590702.
3. Ku LC, Boggess KA,
Cohen-Wolkowiez M. Bacterial Meningitis in the Infant. Clin Perinatol.
2015;42(1):29–45. doi: 10.1016/j.clp.2014.10.004.
4. Holt DE. Neonatal
meningitis in England and Wales: 10 years on. Arch Dis Child - Fetal
Neonatal Ed. 2001;84(2):85F-89.
5. Lewis G, Schweig M, Guillén-Pinto D, Rospigliosi ML.
Meningitis neonatal en un hospital general de Lima, Perú, 2008 al 2015. Rev
Peru Med Exp Salud Pública. 2017; 34:233-8. doi:
10.17843/rpmesp.2017.342.2297.
6. Oliveros Donohue MA,
Ramos Pianezzi R, León Cueto JL, Mazzini Pérez-Reyes J, Van Oordt,
Bellido J, Livia Becerra C. Meningitis neonatal en la UCI del Hospital
Edgardo Rebagliati Martins (IPSS) 1986-88. Diagnóstico.
1993;32(4/6):73-7.
7. Lazo E, Guillén D, Zegarra J. Meningitis neonatal
en el Hospital Nacional Cayetano Heredia. Rev Peru Pediatr.
2008;61(3):157-164.
8. Volpe J. Bacterial and Fungal Intracranial
Infections. Neurology of the Newborn. Fifth Edition. Philadelphia:
Saunders Elsevier; 2013.
9. Devi U, Bora R,
Malik V, Deori R, Gogoi B, Das JK, Mahanta J. Bacterial aetiology of
neonatal meningitis: A study from north-east India. Indian J Med Res.
2017 Jan;145(1):138-143. doi: 10.4103/ijmr.IJMR_748_15.
10. Pérez RO, Lona JC,
Quiles M, Verdugo MÁ, Ascencio EP, Benítez EA. Sepsis neonatal temprana,
incidencia y factores de riesgo asociados en un hospital público del
occidente de México. Rev Chil Infectol. 2015;32(4):447-452.
11. Zea-Vera A, Turin CG, Ochoa TJ. Unificando los
criterios de sepsis neonatal tardía: propuesta de un algoritmo de
vigilancia diagnóstica. Rev Peru Med Exp Salud Pública.
2014;31(2):358-63.
12. Perlman JM, Cilio M. Neonatal Meningitis: Current
Treatment Options. Neurology. Neonatology Questions and Controversies.
Third Edition. Phyladelphia: Elsevier; 2019.
13. Medina, María del Pilar. Frecuencia de enfermedad
neurológica en recién nacidos. Rev Peru Pediatr. 2007;60(1):11-9.
14. Zea-Vera A, Turín CG, Rueda MS, Guillén-Pinto D.
Uso de la punción lumbar en la evaluación de sepsis neonatal tardía en
recién nacidos de bajo peso. Rev Peru Med Exp Salud Pública.
2016;33(2):278-282.
15. Vera S.
Variabilidad del criterio para indicar la punción lumbar en las unidades
de cuidados intensivos neonatales [tesis de bachiller]. Lima: Facultad
de Medicina, Universidad Peruana Cayetano Heredia; 2018.
16. Coto GD, López JB,
Fernández B, Fraga JM, Fernández JR, Reparaz R, et al. Meningitis
neonatal. Estudio epidemiológico del Grupo de Hospitales Castrillo. An
Pediatr. 2002;56(6):556-63.
17. Marcilla C, Martínez A, Carrascosa M, Baquero M,
Alfaro B. Meningitis víricas neonatales. Importancia de la reacción en
cadena de la polimerasa en su diagnóstico. Rev Neurol. 2018; 67:484-490.
18. Shane AL, Sánchez
PJ, Stoll BJ. Neonatal sepsis. Lancet. 2017;390(10104):1770-80. doi:
10.1016/S0140-6736(17)31002-4.
19. Zhao Z, Yu J-L,
Zhang H-B, Li J-H, Li Z-K. Five-Year Multicenter Study of Clinical Tests
of Neonatal Purulent Meningitis. Clin Pediatr (Phila).
2018;57(4):389–97. doi: 10.1177/0009922817728699.
20. Olmedo I, Pallas
CR, Miralles M, Simón de las Heras R, Rodriguez J, Chasco A. Meningitis
neonatal: Estudio en 56 casos. An Esp Pediatr. 1997; 46:189-194.
21. Garges HP. Neonatal
Meningitis: What Is the Correlation Among Cerebrospinal Fluid Cultures,
Blood Cultures, and Cerebrospinal Fluid Parameters? Pediatrics.
2006;117(4):1094–100.
22. Greenberg RG, Benjamin DK, Cohen-Wolkowiez M,
Clark RH, Cotten CM, Laughon M, et al. Repeat lumbar punctures in
infants with meningitis in the neonatal intensive care unit. J
Perinatol. 2011;31(6):425–429. doi: 10.1038/jp.2010.142.
23. Tan J, Kan J, Qiu G, Zhao D, Ren F, Luo Z, Zhang
Y. Clinical Prognosis in Neonatal Bacterial Meningitis: The Role of
Cerebrospinal Fluid Protein. PLoS One. 2015 Oct 28;10(10):e0141620. doi:
10.1371/journal.pone.0141620.
24. Collaborative Study
Group for Neonatal Bacterial Meningitis. A multicenter epidemiological
study of neonatal bacterial meningitis in parts of South China. Zhonghua
Er Ke Za Zhi Chin J Pediatr. 2018;56(6):421–428. doi:
10.3760/cma.j.issn.0578-1310.2018.06.004.
25. Berardi A , Lugli L
, Rossi C , China MC , Vellani G , Contiero R , et al. Infezioni
da Streptococco B Della Regione Emilia Romagna . Neonatal bacterial
meningitis. Minerva Pediatr. 2010;62(3 Suppl 1):51-4.
26. Bentlin MR,
Ferreira GL, Rugolo LMS de S, Silva GHS, Mondelli AL, Rugolo Júnior A.
Neonatal meningitis according to the microbiological diagnosis: a decade
of experience in a tertiary center. Arq Neuropsiquiatr.
2010;68(6):882–887.
27. Zhu M-L, Mai J-Y, Zhu J-H, Lin Z-L. Clinical
analysis of 31 cases of neonatal purulent meningitis caused by
Escherichia coli. Zhongguo Dang Dai Er Ke Za Zhi Chin J Contemp
Pediatr. 2012;14(12):910–912.
28. Ouchenir L, Renaud C, Khan S, Bitnun A, Boisvert
A-A, McDonald J, et al. The Epidemiology, Management, and
Outcomes of Bacterial Meningitis in Infants. Pediatrics.
2017;140(1):1-8. Pediatrics. 2017 Jul;140(1). doi:
10.1542/peds.2017-0476.
29. Krebs VLJ, Costa
GAM. Clinical outcome of neonatal bacterial meningitis according to
birth weight. Arq Neuropsiquiatr. 2007;65(4b):1149–1153.
30. Gupta N, Grover H, Bansal I, Hooda K, Sapire JM,
Anand R, Kumar Y. Neonatal cranial sonography: ultrasound findings
in neonatal meningitis-a pictorial review. Quant Imaging Med Surg. 2017
Feb;7(1):123-131. doi: 10.21037/qims.2017.02.01.
Citar como:
Guillén-Pinto D, Málaga-Espinoza B, Ye-Tay J, Rospigliosi-López ML,
Montenegro-Rivera A, Rivas M, et al. Meningitis neonatal: estudio
multicéntrico en Lima, Perú. Rev Peru Med Exp Salud Publica.
2020;37(2):210-9. doi: https://doi.org/10.17843/rpmesp.2020.372.4772
Correspondencia:
Daniel Guillén Pinto; Av. Honorio Delgado 430, Urb. Ingeniería, San Martín
de Porres, Lima, Perú;
dguillenpinto@gmail.com
Contribuciones de los
autores: DGP participó en la concepción. DGP, BM y JY participaron en el
diseño, la redacción y el análisis de datos del estudio. BM y JY
participaron en el enrolamiento y la recolección de datos. MLR, AM, MR, MLS,
SV, OL, AT, LC, LF, LV, OE, CD y PM participaron en la recolección de datos.
Todos los autores revisaron y aprobaron el artículo.
Agradecimiento: A
todos los médicos y las enfermeras de los servicios de neonatología de los
hospitales participantes.
Financiamiento:
Todos los costos de la investigación fueron autofinanciados.
Conflicto de interés:
Los autores declaran no tener conflictos de interés.
Recibido: 30/08/2019
Aprobado: 29/04/2020
En línea: 15/06/2020

