Gustavo Adolfo Vásquez-Tirado
Martha Genara Asmat-Rubio
CARTA AL EDITOR
Enfermedad del suero secundaria a suero antiofídico
Serum illness secondary
to antiophidic serum
Edinson Dante Meregildo-Rodriguez
![]() 1,2
Médico internista, maestro en
Medicina
1,2
Médico internista, maestro en
Medicina
Gustavo Adolfo Vásquez-Tirado ![]() 3 médico internista e intensivista
3 médico internista e intensivista
Martha Genara
Asmat-Rubio ![]() 2 químico farmacéutico, especialista en Farmacia
Clínica
2 químico farmacéutico, especialista en Farmacia
Clínica
1 Universidad
Señor de Sipán, Chiclayo, Perú.
2 Hospital
Regional Lambayeque, Lambayeque, Perú.
3 Hospital
Regional Docente de Trujillo, La Libertad, Perú.
Sr. Editor: La enfermedad del suero ocurre tras inyectar suero o proteínas extrañas que desencadenan una
respuesta de anticuerpos IgG contra proteínas heterólogas (1-5). Tras una búsqueda en las principales
bases de datos, encontramos solo un reporte de caso en Perú de ES secundaria a
suero antiofídico (6). Esta comunicación tiene como objetivo alertar a los
profesionales de la salud de un evento adverso y raro del suero antiofídico,
como la enfermedad del suero y discutir criterios clínicos
para el diagnóstico de ES secundaria a suero antiofídico (ESSA).
El caso corresponde a un varón
de 68 años, procedente del caserío de Callanca,
distrito de Monsefú, provincia de Chiclayo, sin
antecedentes de relevancia. Ingresa al servicio de Emergencia del Hospital
Regional Lambayeque, el 27 de junio de 2018, tras sufrir la mordedura, en la
mano izquierda, de una serpiente que él identifica como «macanche» (Bothrops barnetti). Se le
administraron dos viales de suero antibotrópico
polivalente 40 mg/10mL (Instituto Nacional de Salud), y al día siguiente fue
dado de alta con evolución favorable. El 5 de julio de 2018, el paciente inicia
con cefalea, malestar, fiebre, artromialgias, rash morbiliforme
pruriginoso asociado a habones y ampollas con contenido serohemático
y edema con fóvea, por lo que cinco días después reingresa a emergencia (Figura
1). El paciente negó el uso de alguna otra sustancia antes de su reingreso. El
paciente recibió clorfenamina 10 mg y dexametasona 4 mg, vía intravenosa, cada seis horas,
presentó mejoría clínica y fue dado de alta una semana después. La biopsia
cutánea mostró hallazgos histopatológicos sugestivos de vasculitis leucocitoclástica.
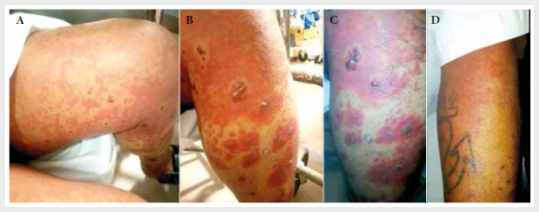
Figura
1.
Imágenes del ingreso del paciente a emergencia. Se observa rash
eritematoso pruriginoso generalizado con predominio de extremidades (A a D), asociado a lesiones papulares,
placas sobreelevadas además vesículas y flictenas con
contenido serohemático (B, C), edema blando con
fóvea.
Las características clínicas
cardinales de la ES son dermatitis rash,
fiebre, poliartralgias/poliartritis,
y malestar general; que se inician una a dos semanas después de la primera
exposición al agente responsable. La ES es causada
por inmunización del huésped humano por proteínas heterólogas
no humanas. La reacción requiere la presencia de antígenos, anticuerpos contra
estos antígenos y la formación subsecuente de inmunocomplejos
antígeno-anticuerpo (1-6).
Entre el 5,6% al 29% de
pacientes desarrollan ES tras administración de suero antiofídico (4,5).
Se ha descrito también el desarrollo de ES con otros tipos de sustancias como
sueros antiarácnidos, antitoxinas microbianas (contra
difteria, rabia, botulismo), anticuerpos monoclonales e inmunomoduladores
(infliximab, rituximab,
globulina antitimocítica, etc.), proteínas fibrinolíticas (estreptocinasa),
entre otras (1-5).
Virtualmente todos los
pacientes con ES tienen fiebre (>38,5° C), pero los escalofríos son
inusuales. Las manifestaciones cutáneas de la ES son variables. Casi todos
tienen rash pruriginoso, que suele ser
la manifestación clínica más precoz. El rash
suele ser urticarial, maculopapular,
vasculítico (púrpura palpable), erupciones morbiliformes, pápulas o maculopápulas
(1-6),
tal como se muestra en la Figura 1 (fotografías tomadas con autorización del
paciente). Las mucosas no se ven afectadas, lo cual es un dato clínico útil
para distinguir la ES de cuadros clínicos similares como el Síndrome de
Stevens-Johnson y la necrólisis epidérmica tóxica. El
rash, frecuentemente, surge alrededor
del sitio de la inyección, pero puede aparecer en otros lugares (tronco, ingle,
abdomen, etc.) (1-5). La mayoría de estas características se presentaron
en el paciente y, con menor frecuencia, se puede encontrar edema, linfadenopatías, cefalea, visión borrosa, esplenomegalia,
uveítis anterior, neuropatía periférica, nefropatía, y vasculitis sistémica (1-5).
El diagnóstico de la ES
usualmente es clínico, basado en el patrón característico de inicio agudo o
subagudo de las manifestaciones clínicas cardinales, que se presenta una o dos
semanas después de la exposición al agente causal. No existe un consenso
respecto a los criterios requeridos para el diagnóstico de la ESSA (1-6).
Una definición práctica y que podría aplicarse en el país es el propuesto por Ryan y col. (4), que define ESSA por la presencia de
tres o más de los siguientes criterios: fiebre, rash
eritematoso/ urticarial, mialgias/artralgias,
cefalea, malestar, náuseas/vómitos, que se presentan cinco a 20 días después de
la administración del antiveneno (4).
Ninguna de las series publicadas recientemente incluye la biopsia cutánea como
criterio de ES (1-5).
La biopsia cutánea no es útil
para confirmar el diagnóstico, dado que los hallazgos histopatológicos son
variables e inespecíficos. En el presente reporte, dado el antecedente de
exposición a suero heterólogo, y la presentación
clínica muy característica, el diagnóstico no representó dificultad.
El pronóstico de la ES fue
bueno, ya que se autolimita en una o dos semanas
después de la suspensión del agente causal (1,2). En conclusión, la ESSA es
una reacción de hipersensibilidad rara, cuyo diagnóstico es eminentemente
clínico, por lo que la biopsia cutánea deberá realizarse sólo en caso de duda
diagnóstica.
REFERENCIAS BIBLIOGRÁFICAS
1. Wener MH, Adkinson Jr. NF. Serum sickness and serum sickness-like reactions. Feldweg AM, ed. UpToDate. Waltham, MA: UpToDate Inc. Retrieved from http://www.uptodate.com.
Last accessed Oct 10, 2019.
2. de Silva HA, Ryan NM,
de Silva HJ. Adverse reactions to snake
antivenom, and their prevention and treatment. Br
J Clin Pharmacol. 2016;
81(3):446–452. doi: 10.1111/bcp.12739.
3. Ryan NM, Downes MA, Isbister GK. Clinical features of serum sickness after Australian snake antivenom. Toxicon. 2015; 108:181-3. doi: 10.1016/j.toxicon.2015.10.012.
4. Ryan NM, Kearney RT,
Brown SG, Isbister GK. Incidence
of serum sickness after the administration
of Australian snake antivenom (ASP-22). Clin Toxicol (Phila). 2016;
54(1):27-33. doi: 10.3109/15563650.2015.1101771.
5. Mong R, Ng VCH, Tse ML. Safety profile of snake antivenom (use) in Hong Kong - a review
of 191 cases from 2008 to 2015. Clin
Toxicol (Phila). 2017;
55(10):1066-1071. doi:
10.1080/15563650.2017.1334916.
6. Paucar K, Del Solar M,
Bravo F, Salomón M, Puell M, Feria K, Ramos C, Giglio P. Enfermedad del suero. Folia Dermatol
Peru. 2011; 22(2): 91-94.
Fuentes de financiamiento: Autofinanciado.
Citar como: Meregildo-Rodriguez ED, Vásquez-Tirado GA, Asmat-Rubio
MG. Enfermedad del suero secundaria a suero antiofídico. Rev
Peru Med Exp Salud Publica. 2020;37(1):176-7. Doi: https://doi.org/10.17843/rpmesp.2020.371.4883.
Correspondencia: Edinson Dante Meregildo Rodriguez; dante_meregildo@hotmail.com
Contribuciones de los autores: EDMR y GAVT contribuyeron en la concepción,
redacción, revisión y aprobación final del manuscrito. MGAR se encargó del
reporte y seguimiento del paciente, y la revisión y aprobación final del
manuscrito.
Conflictos de interés: Los autores reportan no tener conflictos de
interés.
Recibido:
13/10/2019
Aprobado:
15/01/2020
En línea:
19/03/2020