Stefany Fiorella Infante Varillas
Heli Jaime Barrón Pastor
Yesica Llimpe Mitma
Doris Huerta Canales
Paolo Alberto Wong Chero
César Gutierrez
Silvia Suarez Cunza
10.17843/rpmesp.2020.373.4918
ORIGINAL BREVE
Respuesta inmunológica y bioquímica de ancianos con infección urinaria frente factores de virulencia en Escherichia coli uropatógenas
Immunological and biochemical response from older adults with urinary tract infection to uropathogenic Esherichia coli virulence factors
Arturo Octavio Gonzales-Rodriguez
![]() 1, Tecnólogo médico en Laboratorio Clínico, bachiller en Tecnología
Médica en Laboratorio clínico y Anatomía Patológica
1, Tecnólogo médico en Laboratorio Clínico, bachiller en Tecnología
Médica en Laboratorio clínico y Anatomía Patológica
Stefany Fiorella Infante Varillas
![]() 1, bióloga-microbióloga, magister en Investigación Biomédica
1, bióloga-microbióloga, magister en Investigación Biomédica
Heli Jaime Barrón Pastor
![]() 2, tecnólogo médico en Laboratorio Clínico, doctor en Ecología
Evolutiva y Genética
2, tecnólogo médico en Laboratorio Clínico, doctor en Ecología
Evolutiva y Genética
Yesica Llimpe Mitma
![]() 2, biólogo, doctora en Ciencias Biológicas
2, biólogo, doctora en Ciencias Biológicas
Doris Huerta Canales
![]() 2, biólogo, doctora en Ciencias Biológicas
2, biólogo, doctora en Ciencias Biológicas
Paolo Alberto Wong Chero
![]() 1, médico cirujano
1, médico cirujano
César Gutierrez
![]() 1, médico cirujano, magíster en Epidemiología
1, médico cirujano, magíster en Epidemiología
Silvia Suarez Cunza
![]() 2, químico farmacéutico, doctor en Farmacia y Bioquímica
2, químico farmacéutico, doctor en Farmacia y Bioquímica
1 Universidad de
Piura, Lima, Perú.
2 Universidad Nacional Mayor de San Marcos, Lima, Perú.
RESUMEN
Con el objetivo de evidenciar diferencias en la respuesta inmunológica y bioquímica de ancianos con infección del tracto urinario (ITU) por Escherichia coli (E. coli) frente a factores de virulencia de importancia en la patogenia de la ITU, se realizó un estudio descriptivo en el cual se evaluaron 24 muestras de orina de adultos mayores con ITU provenientes de centros de reposo gerontológicos. Se determinó la concentración de hierro, TNF-α, IL-1β y la capacidad antioxidante en la orina, encontrándose una relación entre una mayor concentración de hierro y de hematíes en la orina con la presencia del gen pap GII en la E. coli. Se concluye que los adultos mayores con ITU por E. coli portadoras del gen pap GII, presentan mayor daño tisular.
Palabras clave: Asilos de Ancianos; Ancianos; Escherichia coli Uropatogénica; Biomarcadores; Factores de Virulencia; Infecciones Urinarias; Inmunología; Orina; Antioxidantes; Citoquinas (Fuente: DeCs BIREME).
ABSTRACT
Descriptive study in which 24 urine samples from older adults with urinary tract infection (UTI), from nursing homes, were evaluated; in order to identify differences in the immune and biochemical response from older adults with UTI by Escherichia coli (E. coli) to major virulence factors in the pathogenesis of UTI. Iron concentration, TNF-α, IL-1β and antioxidant capacity in urine were determined. A relation was found between, an increase in iron and red blood cell concentration in urine, and the presence of the pap GII gene found in E. coli. It is concluded that older adults, with UTIs by E. coli with the gene pap GII, have increased tissue damage.
Keywords: Nursing Homes; Elderly; Uropathogenic Escherichia coli; Biomarkers; Virulence Factors, Urinary Tract Infections, Immunology, Urine, Antioxidants, Cytokines (Source: MeSH NLM).
INTRODUCCIÓN
La Escherichia coli (E. coli) es el agente causal más frecuente de bacteriemias en el hombre (1), siendo el tracto urinario la principal forma de ingreso en pacientes geriátricos (2). En forma parcial esto se debe a que la población adulta mayor (PAM) presenta características inmunológicas particulares, con un estado subclínico de inflamación crónica, conocida como inmunosenescencia, donde el linaje polimorfonuclear (principal línea de defensa en las infecciones del tracto urinario [ITU]) (3) se encuentra limitado en su función (4). Por otro lado, se han descrito diversos factores de virulencia en E. coli,asociados con bacteriemias y sepsis, en los que se incluyen moléculas de adhesión celular, sistemas de captación del hierro y exotoxinas que configuran un sistema proteico que le permite eludir o injuriar al sistema inmune del paciente en detrimento de su salud (5,6).
La interacción entre el sistema inmunológico de los pacientes con ITU y la capacidad genética que tiene la bacteria de formar factores de virulencia determina el aclaramiento bacteriano en el tracto urinario (6), por lo que es necesario explorar la diferencia en la respuesta inmunológica y bioquímica que tiene el adulto mayor con ITU ante los diversos factores de virulencia asociados a sepsis en E. coli uropatógenas (UPEC, por sus siglas en inglés).
| MENSAJES CLAVE |
|
Motivación para realizar el estudio: Los adultos mayores presentan un sistema inmunológico inmunosenescente por lo que es conveniente identificar los factores de virulencia en la bacteria que alteran su respuesta inmunológica. Principales hallazgos: Las Escherichia coli portadoras del gen pap GII inducen un mayor daño tisular, lo que incrementa la concentración de hierro y hematíes. Además, existe la presencia generalizada del gen nanA, de importancia en estadios de sepsis. Implicancias: Los hallazgos contribuyen al estudio de la respuesta inmunológica en adultos mayores con ITU; además, es el primer reporte en el Perú de la frecuencia de factores de virulencia en Escherichia coli uropatógenas en centros de reposo gerontológicos. |
EL ESTUDIO
Entre abril y julio del 2018, se evaluó la orina de 24 adultos mayores con ITU, de ambos sexos, residentes en centros de reposo gerontológicos privados de Lima. El criterio diagnóstico de ITU se definió a partir de un recuento microscópico mayor a cinco leucocitos por campo de 400 aumentos, la conversión de nitritos por el método de Griess y un recuento mayor a 100 000 unidades formadoras de colonias en el medio de cultivo agar sangre. Se estandarizó el análisis de sedimento urinario conforme a las recomendaciones del Instituto de Salud de Chile (7).
Se identificó el agente etiológico con métodos bioquímicos tradicionales y se preservaron las bacterias identificadas como E. coli en caldo tripticasa de soya y glicerol al 20%. Los cultivos polimicrobianos fueron excluidos del estudio. Posteriormente, se extrajo el ADN bacteriano utilizando el kit GeneJet Genomic (Thermo Scientific®, Massachusetts, EE. UU.) y se evaluó la presencia de 11 genes de virulencia: aer, α-hly, cnf-1, sfa, chuA, TcpC, nanA, pap GI, GII, GIII y iucC mediante reacción en cadena de polimerasa de punto final.
Las muestras de orina fueron centrifugadas a 3000 g (Sigma, 3-30KS) por 10 minutos, preservando el sobrenadante. Se determinó la concentración del TNF-α, IL-1β y hierro; además, se evaluó la capacidad antioxidante total en la orina por los métodos de ABTS.+ y FRAP como marcador de la respuesta inmunológica a través del aumento de sustancias reactivas al oxígeno (ROS, por sus siglas en inglés). Todos los analitos fueron medidos empleando el espectrofotómetro Multiskan Go (Thermo Scientific®, Massachusetts, EE. UU.).
El análisis estadístico se realizó con el programa Epidat versión 4.1. La descripción de las variables cualitativas se realizó a través de tablas de frecuencia. Se aplicó la prueba de normalidad de Shapiro Wilk para determinar la distribución de las variables cuantitativas y la prueba de homogeneidad de varianza de Levene. Las variables cuantitativas con distribución normal fueron analizadas mediante la prueba de T de Student. Los valores p < 0,05 se consideraron significativos.
El presente estudio obtuvo la aprobación del Comité de Ética de la Facultad de Medicina de la Universidad Nacional Mayor de San Marcos, acta 1812 con código de proyecto 0013.
HALLAZGOS
Se analizaron 24 muestras de orina de adultos mayores, provenientes de centros de reposo gerontológicos, con ITU por E. coli. Los genes de virulencia más frecuentes fueron el gen nanA, pap GII, aer, chuA e iucC. También se encontraron, en una baja proporción, genes α-hly y cnf-1, pero no se hallaron genes TcpC, pap GI, pap GIII y sfa (Figura 1).
Met: Metabolismo
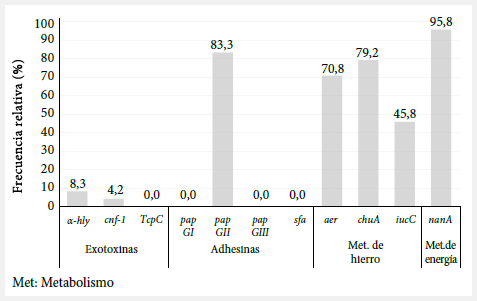
Figura 1. Frecuencia relativa de genes de virulencia en Escherichia coli uropatógenas en adultos mayores de centros de reposo.
En relación con la respuesta inmunológica y bioquímica de los adultos mayores ante los diversos genes de virulencia evaluados, se observó una concentración de 37,6 hematíes/uL y de 193,4 ug/L de hierro en los pacientes portadores del gen pap GII, significativamente mayor en los pacientes infectados con E. coli, pero sin este gen. Además, en los pacientes con cepas portadoras del gen pap GII se evidenció una tendencia positiva de tener una mayor capacidad antioxidante en la orina con respecto a la prueba ABTS.+ (1348,7 vs. 634,8 Eq-Vit C real ug/mL) (Tabla 1). Por otro lado, se observó una tendencia a presentar mayor concentración de leucocitos (p = 0,070) en los pacientes infectados con E. coli, portadores de los tres genes relacionados al metabolismo del hierro evaluados (iucC, aer y chuA) (Tabla 2).
Tabla 1. Marcadores inmunológicos y bioquímicos en comparación con la presencia del gen pap GII.
|
Marcadores inmunológicos y bioquímicos |
Presencia de pap GII a |
Ausencia de pap GII a |
Valor de p b |
|
Leucocitos/uL |
270,1 ± 240,7 |
225,8 ± 126,0 |
0,729 |
|
Hematies/uL |
37,6 ± 37,4 |
12 ± 8,2 |
0,010 |
|
Hierro (ug/L) |
193,4 ± 139,6 |
85,3 ± 26,2 |
0,004 |
|
IL-1β (pg/mL) |
375 ± 293,2 |
147 ± 98,8 |
0,144 |
|
TNF- α (pg/mL) |
65,2 ± 35,0 |
94,5 ± 61,5 |
0,195 |
|
ABTS Eq-Vit C real (ug/mL) |
1348,7 ± 1455,7 |
634,8 ± 299,0 |
0,059 |
|
FRAP (mM) |
1,006 ± 0,416 |
0,801 ± 0,332 |
0,366 |
a media ±
desviación estándar; b prueba T de Student
FRAP: Recuperación de fluorescencia después de photobleaching, ABTS: Ácido
2,2’-azino-di-(3-etilbenzotiazolina)-6-sulfónico.
Tabla 2. Marcadores inmunológicos y bioquímicos en comparación con la presencia de los genes iucC+aer+chuA
|
Marcadores inmunológicos y bioquímicos |
Presencia de iucC+aer+chuA a |
Ausencia de iucC+aer+chuA a |
Valor de p b |
|
Leucocitos/uL |
391,7 ± 226,6 |
209,6 ± 206,5 |
0,070 |
|
Hematies/uL |
35,3 ± 36 |
32,6 ± 36,4 |
0,903 |
|
Hierro (ug/L) |
210,6 ± 140,2 |
160,9 ± 132,6 |
0,418 |
|
IL-1β (pg/mL) |
421,1 ± 280,5 |
302,4 ± 284,4 |
0,359 |
|
TNF - α (pg/mL) |
82,8 ± 24,2 |
64,9 ± 45 |
0,332 |
|
ABTS Eq-Vit C real (ug/mL) |
1763,7 ± 2349,6 |
1009,9 ± 626,8 |
0,435 |
|
FRAP (mM) |
0,957 ± 0,307 |
0,978 ± 0,447 |
0,911 |
a media ±
desviación estándar; b prueba T de Student
FRAP: Recuperación de fluorescencia después de photobleaching, ABTS: Ácido
2,2’-azino-di-(3-etilbenzotiazolina)-6-sulfónico
DISCUSIÓN
El presente estudio evaluó la respuesta inmunológica y bioquímica en la orina de pacientes adultos mayores institucionalizados, infectados por UPEC (el principal agente etiológico de las ITU). Entre los principales hallazgos se encontró que la presencia del gen pap GII indujo hematuria y una mayor concentración de hierro en la orina. También se evaluó la frecuencia de los genes de virulencia importantes en el proceso de patogenicidad en las ITU y entre los principales hallazgos se tiene que el 95,8% de las UPEC albergaron al gen nanA.
El ácido N-acetilneuramínico, sustrato importante en la producción energética de la E. coli, es escindido a través de la enzima N-acetilneuramínico liasa (nanA) en piruvato y N-acetil-D-manosamina (8). La presencia de la enzima nanA genera una alta competitividad en las UPEC productoras de bacteriemias; y aunque su función en la patogénesis de la ITU en modelos murinos es menos relevante (8), los resultados indican la existencia de un alto riesgo de desarrollar sepsis en los adultos mayores con bacteriemias.
Por otro lado, las exotoxinas tienen una función en la patogenia de la ITU. Los neutrófilos, principal línea de defensa en las ITU, son lisados por la α-hemolisina (HlyA) en dosis elevadas y, además, las células de la vejiga en bajas dosis son exfoliadas (9), lo cual deteriora las dos principales líneas de defensa del cuerpo (3). No obstante, en las UPEC estudiadas obtuvimos una frecuencia de 8,3%, resultado menor al encontrado en otros estudios realizados en población geriátrica (10,11). Asimismo, las exotoxinas, como el factor citotóxico necrotizante tipo 1 (CNF1) relacionado genéticamente a la HlyA, inducen un rearreglo del citoesqueleto de los neutrófilos mediante la activación de las enzimas de tipo Rho GTPasa (9). En concordancia con lo reportado por la α-hly se encontró una UPEC portadora del gen cnf-1.
En relación con la proteína TcpC recientemente descrita como interferente en la producción de citoquinas proinflamatorias en la ITU (12), no fue encontrada en ninguna de las UPEC evaluadas, lo cual puede reflejar la ausencia de la isla de patogenicidad tipo IV, dependiente de su transferencia horizontal, o la reciente adquisición evolutiva del gen en las E. coli extraintestinales (12).
En relación con la respuesta inmunológica y bioquímica observada en los adultos mayores, el hierro, escaso en el fluido urinario, es indispensable en el metabolismo bacteriano (13,14), los microorganismos que infectan el tracto urinario deben tener la capacidad de captar y competir por su asimilación (14). Las UPEC tienen tres sistemas de captación de hierro (sideróforos, hemóforos y captación directa de hierro en su estado ferroso) y se ha informado el aumento de su expresión in vivo (15). Por otro lado, la restricción del hierro es un mecanismo de defensa inmunitario utilizado por el hospedero para limitar la proliferación bacteriana (16). Aunque no pudimos encontrar diferencias significativas entre los marcadores inmunológicos y bioquímicos y los genes asociados al metabolismo del hierro, se puede observar que los pacientes con UPEC, portadores de los genes iucC, aer y chuA, tienden a presentar una mayor concentración de leucocitos, lo cual puede indicar un mayor estrés inmunológico. Además, la presencia del gen chuA y de otros sistemas sideróforos están altamente concentrados en cepas causantes de ITU recurrente (17), situación común en centros de reposo gerontológicos.
Finalmente, el gen pap GII es un factor de virulencia cuya función es procurar la adhesión de las UPEC al tejido renal. Se ha documentado la asociación del gen pap GII con estadios de pielonefritis (6), además, se ha postulado su ventaja competitiva durante estadios de bacteriemia por ITU (8). Cierta evidencia señala que su presencia no es determinante en estadios de pielonefritis, por lo tanto, su función aún no es concluyente en el proceso de infección en el tracto urinario (18).
En los resultados obtenidos se observa que los pacientes con UPEC positivas para el gen pap GII presentaron mayor concentración de hierro en comparación con los pacientes con UPEC negativas para el gen pap GII. Se ha encontrado que la interacción del pap GII con su receptor induce la transcripción rápida del gen airS en las UPEC en orina, el cual tiene un papel fundamental en la activación de los sistemas sideróforos (aerobactina/enterobactina) (19) al disminuir la concentración de hierro en la orina. En los resultados obtenidos no encontramos esta relación. Sin embargo, esto podría ser explicado por la mayor concentración de hematíes y hemolisis en este grupo de pacientes. La adhesión de la proteína pap GII activa la síntesis de citoquinas (20), ocasionando la ruptura de vasos sanguíneos ubicados en la lámina propia. Por otro lado, mediante la prueba ABTS.+ se describe que en los pacientes con UPEC pap GII positivos existe la tendencia de tener mayor capacidad antioxidante, lo cual podría deberse a la mayor concentración de hierro, lo que interfiriere con el ensayo, aunque también podría ser explicado por la deficiencia de los neutrófilos para producir sustancias reactivas al oxígeno. Recientes estudios han descrito que en la PAM existe un aumento de la subpoblación de neutrófilos CD16/CD62L, la cual presenta un menor nivel de respuesta ante el estímulo de citoquinas (4).
El presente estudio tiene una serie de limitaciones. En primer lugar, no se pudo registrar información de los pacientes referente a su condición clínica, estadio en la infección, uso de antibióticos, recurrencia de la infección. La segunda limitación fue el bajo número de muestras de orina analizadas, lo cual aumenta la probabilidad obtener un error de tipo II. La tercera limitación es que no complementamos nuestros estudios con análisis de expresión genética, por lo que no sabemos si los genes evaluados son ciertamente expresados por las bacterias.
En conclusión, las E. coli portadoras del gen pap GII pueden inducir un mayor daño tisular que, posiblemente, favorece una mayor concentración de hierro en la orina, lo cual estimula su incremento. Además, la tendencia positiva en los pacientes infectados con E. coli pap GII de tener una mayor capacidad antioxidante puede deberse a la deficiencia de neutrófilos reclutados en la PAM en la producción de ROS. Finalmente, la presencia generalizada del gen nanA es importante debido a su alta relevancia en estadios de sepsis.
REFERENCIAS BIBLIOGRÁFICAS
1. Nicolle LE. Urinary Tract Infections in the Older Adult. Clin Geriatr Med. 2016;32(3):523-38. doi: 10.1016/j.cger.2016.03.002.
2. Mylotte JM, Tayara A, Goodnough S. Epidemiology of Bloodstream Infection in Nursing Home Residents: Evaluation in a Large Cohort from Multiple Homes. Clin Infect Dis. 2002;35(12):1484-90. doi: 10.1086/344649.
3. Luna-Pineda VM, Ochoa S, Cruz-Córdova A, Cázares-Domínguez V, Vélez-González F, Hernández-Castro, R, et al. Infecciones del tracto urinario, inmunidad y vacunación. Bol Med Hosp Infant Mex. 2018; 75(2): 67-78. doi: 10.24875/BMHIM.M18000011.
4. Sauce D, Dong Y, Campillo-Gimenez L, Casulli S, Bayard C, Autran B, et al. Reduced oxidative burst by primed neutrophils in the elderly individuals is associated with increased levels of the CD16bright/CD62Ldim immunosuppressive subset. J Gerontol A Biol Sci Med Sci. 2017;72(2):163-72. doi: 10.1093/gerona/glw062.
5. Daga AP, Koga VL, Gabriel J, Soncini M, Matos CM De, Regina M, et al. Escherichia coli Bloodstream Infections in Patients at a University Hospital : Virulence Factors and Clinical Characteristics. Front Cell Infect Microbiol. 2019;9:191. doi: 10.3389/fcimb.2019.00191.
6. Johnson JR. Virulence factors in Escherichia coli urinary tract infection. Clin Microbiol Rev. 1991; 4(1):80-128. doi: 10.1128/cmr.4.1.80.
7. Gómez R, Pellegrini P. Recomendaciones para el Ánalisis del Sedimento urinario. Departamento Laboratorio Biomédico Nacional y de Referencia. Instituto Nacional de Salud Pública de Chile. 2013 [citado el 03 de mayo de 2020]. Disponible en: https://www.araucaniasur.cl/wp-content/uploads/2019/11/sedimento-urinario 10052013A.pdf.
8. Smith SN, Hagan EC, Lane MC, Mobley HLT. Dissemination and Systemic Colonization of Uropathogenic Escherichia coli in a Murine Model of Bacteremia. MBio. 2010;1(5):1–9. doi: 10.1128/mBio.00262-10.
9. Lüthje P, Brauner A. Virulence Factors of Uropathogenic E. coli and Their Interaction with the Host. Adv Microb Physiol. 2014;65:337-72. doi: 10.1016/bs.ampbs.2014.08.006.
10. Santo, E, Macedo C, Marin JM. Virulence factors of uropathogenic Escherichia coli from a University Hospital in Ribeirão Preto, São Paulo, Brazil. Rev Inst Med Trop Sao Paulo. 2006;48(4):185-88. doi: 10.1590/s0036-46652006000400002.
11. Croxall G, Hale J, Weston V, Manning G, Cheetham P, Achtman M, et al. Molecular epidemiology of extraintestinal pathogenic Escherichia coli isolates from a regional cohort of elderly patients highlights the prevalence of ST131 strains with increased antimicrobial resistance in both community and hospital care settings. J Antimicrob Chemother. 2011;66(11):2501-8. doi: 10.1093/jac/dkr349.
12. Xiao T, Waldhuber A, Svanborg C, Snyder G, Römmler F, Miethke T, et al. A Comparative Analysis of the Mechanism of Toll-Like Receptor-Dis-ruption by TIR-Containing Protein C from Uropathogenic Escherichia coli. Pathogens. 2016;5(1):25. doi: 10.3390/pathogens5010025.
13. Pfrimer K, Micheletto RF, Marchini JS, Padovan GJ, Moriguti J, Ferriolli E. Impact of Aging on Urinary Excretion of Iron and Zinc. Nutr Metab Insights. 2014;7:47-50 doi: 10.4137/NMI.S12977.
14. Alteri CJ, Smith SN, Mobley HLT. Fitness of Escherichia coliduring urinary tract infection requires gluconeogenesis and the TCA cycle. PLoS Pathog. 2009;5(5):e1000448. doi: 10.1371/journal.ppat.1000448.
15. Hagan EC, Lloyd AL, Rasko DA, Faerber GJ, Mobley HLT. Escherichia coli global gene expression in urine from women with urinary tract infection. PLoS Pathog. 2010; 11;6(11): e1001187. doi: 10.1371/journal.ppat.1001187.
16. Bullen JJ. The Significance of Iron in Infection. Clin Infect Dis. 1981;3(6):1127-38. doi: 10.1093/clinids/3.6.1127.
17. Ejrnæs K, Stegger M, Reisner A, Ferry S, Monsen T, Holm SE, et al. Characteristics of Escherichia coli causing persistence or relapse of urinary tract infections: Phylogenetic groups, virulence factors and biofilm formation. Virulence. 2011;2(6):528-37. doi: 10.4161/viru.2.6.18189.
18. Mobley HLT, Jarvis KG, Elwood JP, Whittle DI, Lockatell CV, Russell RG, et al. Isogenic P-fimbrial deletion mutants of pyelonephritogenic Escherichia coli: the role of alpha Gal(1-4) beta Gal binding in virulence of a wild-type strain. Mol Microbiol. 1993;10(1):143–55. doi: 10.1111/j.1365-2958.1993.tb00911.x.
19. Zhao R, Shi J, Shen Y, Li Y, Han Q, Zhang X, et al. Phylogenetic distribution of virulence genes among ESBL-producing uropathogenic escherichia coli isolated from long-term hospitalized patients. J Clin Diagnostic Res. 2015;9(7):1-4. doi: 10.7860/JCDR/2015/13234.6157.
20. Svensson M, Duan R, Svanborg C. Role of the Ceramide-sig-naling Pathway in Cytokinr Responses to P-fimbriated. J Exp Med. 1996;183(3):1037-44. doi: 10.1084/jem.183.3.1037.
Citar como: Gonzales-Rodriguez AO, Infantes Varillas SF, Barrón Pastor HJ, Llimpe Mitma Y, Huerta Canales D, Wong Chero PA, et al. Respuesta inmunológica y bioquímicade ancianos con infección urinaria frente factores de virulencia en Escherichia coli uropatógena. Rev Peru Med Exp Salud Publica. 2020;37(3):527-31. doi: https://doi.org/10.17843/rpmesp.2020.373.4918.
Correspondencia: Arturo Gonzales Rodriguez; calle Mártir José Olaya 162, Miraflores, Lima, Perú; arturo.gonzales@udep.edu.pe
Contribuciones de los autores: AGR, HJBP, YLLM y DVRC concibieron del artículo. AGR, CG, SFIV, PW, HJBP y YLLM recolectaron los datos e hicieron el análisis estadístico. AGR, PW, HJBP y SSC redactaron y aprobaron la versión final.
Conflictos de interés: Los autores declaran no tener conflictos de interés con la publicación de este artículo.
Fuentes de financiamiento: Financiamiento para grupos de investigación de la Universidad Nacional Mayor de San Marcos (código de proyecto A17011681) y financiamiento interno de la Universidad de Piura.
Recibido: 24/10/2019
Aprobado: 06/05/2020
En línea: 14/07/2020