Katherine Alvis-Chirinos
Luis Aguilar-Esenarro
William Bautista-Olórtegui
Patricia Velarde-Delgado
Adolfo Aramburu
10.17843/rpmesp.2020.373.4919
ARTÍCULO ORIGINAL
Ganancia de peso gestacional como predictor de macrosomía y bajo peso al nacer: revisión sistemática
Gestational weight gain as a predictor of macrosomia and low birth weight: a systematic review
Gabriela Santos-Antonio
![]() 1, Obstetra
1, Obstetra
Katherine Alvis-Chirinos
![]() 1, nutricionista
1, nutricionista
Luis Aguilar-Esenarro
![]() 1, nutricionista
1, nutricionista
William Bautista-Olórtegui
![]() 1, nutricionista
1, nutricionista
Patricia Velarde-Delgado
![]() 1, nutricionista,
1, nutricionista,
Adolfo Aramburu
![]() 1, nutricionista,
magíster en Salud Pública
1, nutricionista,
magíster en Salud Pública
1 Instituto Nacional de Salud, Lima, Perú.
RESUMEN
Objetivos: Evaluar la capacidad predictiva de las recomendaciones de ganancia de peso gestacional respecto del bajo peso al nacer (BPN) y la macrosomía neonatal, propuestas por el Institute of Medicine (IOM) y el Centro Latinoamericano de Perinatología (CLAP).
Materiales y métodos: La búsqueda bibliográfica se realizó en PubMed, Embase (vía Ovid), Cochrane Library, EBSCOhost, Scopus, LILACS y SciELO. La calidad metodológica se evaluó utilizando QUADAS 2.
Resultados: Se obtuvieron 1192 artículos, cinco cumplieron los criterios de inclusión, ningún estudio evaluó las recomendaciones CLAP. La sensibilidad y especificidad para predecir el BPN y la macrosomía variaron largamente según el país de realización del estudio. En las cohortes de América Latina, la sensibilidad para predecir el BPN varió entre 62,8% y 74%, y la especificidad, entre 61,7% y 68%, mientras que la sensibilidad para predecir macrosomía fue 28,8%, y la especificidad, 43,8%. En la mayoría de estudios el valor predictivo positivo fue inferior al 25%, y el valor predictivo negativo, superior al 90%. La mayoría de los estudios tuvo alto riesgo de sesgo y problemas de aplicabilidad en la selección de pacientes.
Conclusiones: La limitada calidad metodológica y representatividad de las cohortes estudiadas, probables factores de confusión no ajustados y modestos valores de sensibilidad y especificidad sugieren la necesidad de desarrollar estudios para establecer recomendaciones que se ajusten a las características epidemiológicas de la población peruana.
Palabras clave: Ganancia de Peso Gestacional; Sensibilidad y Especificidad; Recién Nacido de Bajo Peso; Macrosomía Fetal (fuente: DeCS BIREME).
ABSTRACT
Objectives: To evaluate the predictive capacity of gestational weight gain recommendations regarding low birth weight (LBW) and neonatal macrosomia, proposed by the Institute of Medicine (IOM) and the Latin American Center of Perinatology (CLAP).
Materials and methods: The bibliographic search was performed in PubMed, Embase (via Ovid), Cochrane Library, EBSCOhost, Scopus, LILACS and SciELO. Methodological quality was evaluated using QUADAS 2.
Results: A total of 1,192 articles were identified, only 5 articles met the inclusion criteria, no study evluated the CLAP recomendations. Sensitivity and specificity to predict LBW and macrosomia varied widely depending on which country the study took place. In the Latin American cohorts, the sensitivity for predicting LBW ranged from 62.8% to 74% and the specificity from 61.7% to 68%, while the sensitivity for predicting macrosomia was 28.8% and the specificity 43.8%. In most studies the positive predictive value was less than 25%, and the negative predictive value was more than 90%. Most studies had high risk of bias and applicability problems in patient selection.
Conclusions: The limited methodological quality and representativeness of the studied cohorts, probable unadjusted confounding factors and modest values of sensitivity and specificity suggest the need to develop studies aimed at providing recommendations that fit the epidemiological characteristics of the Peruvian population.
Keywords: Gestational Weight Gain; Sensitivity and Specificity; infant, Low birth weight; Fetal Macrosomia (source: MeSH NLM).
INTRODUCCIÓN
La ganancia de peso durante la gestación representa un importante predictor de los desenlaces del recién nacido (1). La ganancia insuficiente incrementa el riesgo de nacimientos pretérmino y con bajo peso al nacer (BPN) (2,3), mientras que la ganancia excesiva incrementa el riesgo de macrosomía neonatal (4). A su vez, tanto el BPN como la macrosomía incrementan la mortalidad y morbilidad neonatal (1), los desenlaces adversos maternos (2), el riesgo de enfermedades crónicas durante la vida adulta (2,5) significa una importante carga económica para los servicios de salud y la sociedad (6).
Durante las décadas de 1970 y 1980, en la mayoría de países se recomendaba una ganancia de peso gestacional única de 12,5 kg, sin considerar el peso y estatura pregestacional (7). En 1983, el Centro Latinoamericano de Perinatología (CLAP) de la Organización Panamericana de la Salud elaboró patrones de ganancia de peso cuando se desconocía el peso pregestacional (8), mientras que en 1990, el Institute of Medicine (IOM) de Estados Unidos publicó recomendaciones de ganancia de peso durante la gestación, adoptadas por la mayoría de países a nivel mundial, y fueron actualizadas en el 2009 (1).
En el Perú, en ausencia de un patrón nacional de ganancia de peso durante la gestación, las recomendaciones del CLAP y del IOM son comúnmente utilizadas. Sin embargo, ambas presentan limitaciones que afectan su precisión diagnóstica, como la procedencia y antigüedad de los datos epidemiológicos de base, la representatividad de la población de referencia, y aspectos metodológicos como la inclusión y fuente de información de datos sobre el índice de masa corporal (IMC) pregestacional. Por esta razón, se desarrolló una revisión sistemática con el objetivo de evaluar la capacidad de ambas recomendaciones para predecir el BPN y la macrosomía neonatal.
| MENSAJES CLAVE |
|
Motivación para realizar el estudio: Las recomendaciones sobre ganancia de peso gestacional del Institute of Medicine (IOM) y del Centro Latinoamericano de Perinatología (CLAP) se utilizan ampliamente; no obstante, presentan limitaciones metodológicas que podrían afectar su capacidad para predecir el bajo peso al nacer (BPN) y la macrosomía. Principales hallazgos: Las recomendaciones del IOM mostraron baja sensibilidad y especificidad para predecir el BPN y macrosomía, especialmente en cohortes procedentes de América Latina. Ningún estudio evaluó las recomendaciones del CLAP. Implicancias: Se requieren estudios con adecuada calidad metodológica para establecer recomendaciones ajustadas a las características epidemiológicas de la población peruana. |
MATERIALES Y MÉTODOS
La presente revisión sistemática busca evaluar el mejor parámetro de diagnóstico para la ganancia de peso de la gestante. El estudio se realizó siguiendo las recomendaciones de la declaración PRISMA (por sus siglas en inglés) (9), excepto en lo referente a la inscripción del protocolo en una base de datos, que se encuentra a disposición si así se solicita al autor corresponsal.
Estrategia de búsqueda bibliográfica
Se desarrolló una búsqueda sistemática de estudios observacionales, tipo cohorte prospectiva o retrospectiva, y estudios de casos y controles, en siete bases de datos electrónicas: PubMed, Embase (vía OVID), Cochrane Library, EBSCOhost, Scopus, LILACS y SciELO, utilizando una combinación de los términos de búsqueda: pregnancy, gestation, pregnant women, gestational weight gain, accuracy, sensitivity, specificity, predictive value. Se limitó la búsqueda de estudios a los publicados en español e inglés, sin restricción por fecha de publicación. La fecha de la última búsqueda fue el 3 de mayo de 2019. Las estrategias de búsqueda para cada base de datos consultada se encuentran en el material suplementario. Adicionalmente, se realizó una búsqueda manual en Google Scholar y se verificaron las listas de referencias de los estudios seleccionados con la finalidad de incluir cualquier referencia relevante.
Criterios de elegibilidad
Estudios que cumplieron con los siguientes criterios: a) tipo de participantes: gestantes aparentemente sanas de cualquier edad y condición gestacional (embarazo único o múltiple); b) pruebas índice: ganancia de peso gestacional total y/o por trimestres específicos, según lo recomendado por el CLAP y el IOM; c) estándar: diagnóstico de bajo peso al nacer y macrosomía neonatal, según criterios como bajo peso al nacer, inferior a los 2500 g, y macrosomía neonatal, superior a los 4000 g; d) tipos de medidas de desenlace: sensibilidad, especificidad, valor predictivo positivo o negativo.
Selección de estudios y extracción de datos
Los registros obtenidos en la estrategia de búsqueda fueron evaluados inicialmente con la lectura de títulos y resúmenes, luego se realizó la lectura del texto completo de los artículos seleccionados y se extrajo información sobre la metodología del estudio, los participantes, intervención, control y desenlaces informados en un formulario de extracción de datos diseñado en Microsoft® Excel 2010.
Síntesis de resultados
Las variables cuantitativas se presentan como promedios más desviación estándar. Las variables cualitativas se presentan como proporciones. Para ambos tipos de variables, y en caso de estar disponible, se presentan los intervalos de confianza al 95% y los valores de significancia estadística. Los valores de sensibilidad, especificidad, valor predictivo positivo o negativo en los estudios que no informaron estos desenlaces se calcularon a partir de los datos proporcionados por el estudio utilizando el software Review Manager versión 5.3 (The Cochrane Colaboration, Oxford, UK).
Evaluación de la calidad de los estudios
La calidad metodológica de cada estudio incluido se evaluó utilizando la herramienta Quality Assessment of Diagnostic Accuracy Studies 2 (QUADAS 2) (10). En cada etapa participaron dos revisores independientes. Cualquier desacuerdo fue resuelto mediante discusión o consenso grupal de los autores.
RESULTADOS
Se identificaron 2601 referencias. La revisión sistemática incluyó cinco estudios que cumplieron los criterios de selección previamente establecidos (11-15) (figura 1).
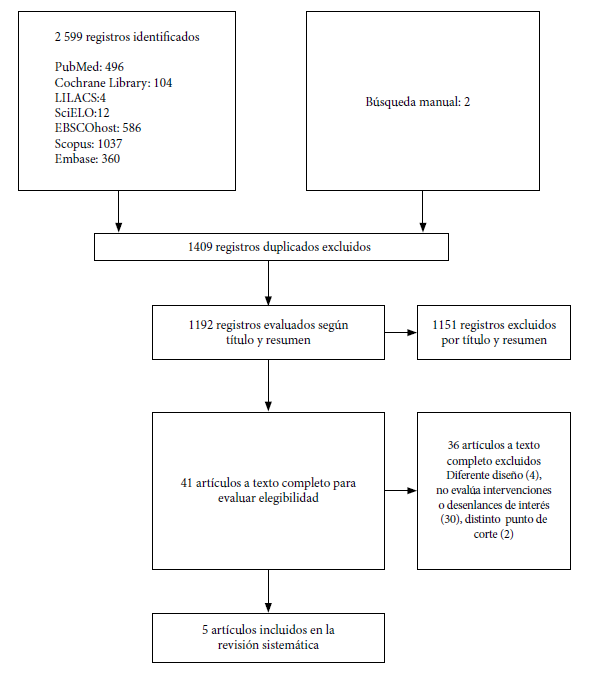
Figura 1. Flujograma de selección de estudios
Características de los estudios incluidos
Los estudios se desarrollaron en establecimientos de salud públicos de los Estados Unidos (12), Brasil (13,14), Italia (11) y China (15). Cuatro estudios utilizaron un diseño de cohorte retrospectiva (12,15) y uno de cohorte prospectiva (11). El periodo de recolección de datos varió entre siete meses y nueve años (tabla 1).
Tabla 1. Características de los estudios incluidos.
|
Autor, año |
País |
Diseño del estudio |
Criterios de inclusión |
Criterios de exclusión |
Periodo de recolección de datos |
Ámbito |
|
Alberico, 2014 (11) |
Italia |
Cohorte prospectiva |
Embarazos con registros completos de variables de interés. |
Embarazo múltiple, parto prematuro. |
18 meses |
Establecimientos de salud que atienden partos de bajo riesgo. |
|
Asplund, 2008 (12) |
Estados Unidos |
Cohorte retrospectiva |
Parto de un recién nacido vivo, con 37-42 semanas de gestación. |
Diabetes gestacional, embarazo múltiple, ingreso a la atención prenatal después del primer trimestre, parto prematuro, datos incompletos. |
7 meses (junio 2006 - diciembre 2006) |
Establecimiento de salud de las fuerzas armadas. |
|
Barros, 2014 (13) |
Brasil |
Cohorte retrospectiva |
Gestantes adolescentes con información del peso antes y al final del embarazo, estatura, edad gestacional al nacimiento, fecha de última regla, sin enfermedad crónica, embarazo de feto único. |
NR |
20 meses (julio 1999 - marzo 2001) |
Maternidades municipales. |
|
Carvalho Padilha, 2015 (14) |
Brasil |
Cohorte retrospectiva |
Gestantes >20 años, sin enfermedades crónicas, embarazo de feto único, acceso a atención prenatal, sin restricciones dietéticas. |
NR |
9 años (1999 - 2008) |
Hospital público de maternidad. |
|
Li, 2013 (15) |
China |
Cohorte retrospectiva |
Embarazos atendidos en un centro de salud urbano con registros obstétricos y neonatales completos. |
Muerte fetal, embarazo múltiple, madres multíparas, registros obstétricos y neonatales incompletos. |
23 meses (junio 2009 - mayo 2011) |
Centro de salud materno infantil. |
NR: no reportado
Un estudio fue desarrollado en adolescentes, con un promedio de edad de 17,6 años (13), y se desarrollaron cuatro estudios en adultas, entre 26,5 y 31,7 años en promedio (11,12,14,15). Dos estudios reportaron mayor predominancia de gestantes de raza blanca (12,13), y tres estudios no reportaron la raza de la población de estudio (11,14,15). En los dos estudios que reportaron el sexo del recién nacido, se observó una proporción similar entre varones y mujeres (11,15). Todos los estudios evaluaron la precisión diagnóstica de las recomendaciones de ganancia de peso gestacional sugeridas por el IOM (tabla 2).
Tabla 2. Características de la población de estudio.
|
Autor, año |
N inicial/ N incluido |
Edad promedio (años) (DE) |
Raza |
Estatura materna |
Peso/IMC pregestacional |
Patologías gestacionales |
Consumo de tabaco/ alcohol |
Sexo del recién nacido |
|
Alberico, 2014 (11) |
15 255/14 109 |
31,7 (5,2) |
NR |
<165 cm: 52,9% >165 cm: 47,1% |
Peso promedio: 62,1 kg |
Diabetes gestacional: 2,6% |
NR |
Femenino: 49,7% Masculino: 50,3% |
|
Asplund, 2008 (12) |
238/186 |
26,5 |
Blanca: 56,5% Negra: 25,8% |
NR |
IMC: Mujeres con RN con peso normal: 25,8 + 5,09 Mujeres con RN con macrosomía: 25,3 + 5,43 |
Exclusión |
NR |
NR |
|
Barros, 2014 (13) |
1968/826 |
17,6 (1,35) |
Caucásica: 50,2% |
NR |
IMC (OMS, 2007): Según edad Bajo peso: 2,5% Adecuado: 83,9% Sobrepeso: 11,5% Obesidad: 2,1% |
Diabetes gestacional: 1,3% |
NR |
NR |
|
Carvalho Padilha, 2015 (14) |
NR/827 |
27,6 (5,2) |
NR |
NR |
IMC (OMS, 1995): Bajo peso (<18,5): 10,9% Normal (18,5-24,99): 63,8% Sobrepeso/obesidad (>25): 25,3% |
NR |
NR |
NR |
|
Li, 2013 (15) |
43 854/33 973 |
27,6 |
NR |
NR |
IMC (WOGC, 2004): Bajo peso (<18,5): 11,2% Normal (18,5-23,9): 64,6% Sobrepeso (24-27,9): 18,2% Obesidad (>28): 6% |
Diabetes gestacional: 5,1% HTA inducida por el embarazo: 2,2% |
Tabaquismo <18,5: 1,2% 18,5-23,9: 1% 24-27,9: 1,2% >28: 2,2% |
Femenino: 51,7% Masculino: 48,3% |
HTA: hipertensión arterial; IMC: índice de masa corporal; NR: no reportado; RN: recién nacido; OMS: Organización Mundial de la Salud; WOGC: Working Group on Obesity in China; DE: desviación estándar.
Efecto de las intervenciones
Bajo peso al nacer
Los artículos de Barros (13), Carvallo (14) y Li (15) reportan que la prevalencia de BPN varió entre 2,2% y 10,8%. La sensibilidad varió entre 16,9% en población china (15), y 62,8% y 74% en población brasileña (13,14). La especificidad varió entre 61,7% y 68,3% en población brasileña (13,14), y un 90,3% en población china (15). El valor predictivo positivo varió entre 3,8% y 19,2%, mientras que el valor predictivo negativo, entre 6,1% y 98% (tabla 3).
Tabla 3. Resultados sobre la precisión diagnóstica
|
Autor, año |
Prevalencia del desenlace % |
Sensibilidad % (IC 95%) |
Especificidad % (IC 95%) |
Valor predictivo positivo % (IC 95%) |
Valor predictivo negativo % (IC 95%) |
|
Bajo peso al nacer |
|
|
|
|
|
|
Barros, 2014 (13) |
10,8 |
62,8 |
68,3 |
19,2 |
6,1 |
|
Carvalho Padilha, 2015 (14) |
4,6 |
74 |
61,7 |
10,4 |
97,5 |
|
Li, 2013 (15) |
2,2 |
16,9 (14,3-19,8) |
90,3 (90,0-90,6) |
3,8 (3,2-4,5) |
98 (97,8-98,1) |
|
Macrosomía neonatal |
|
|
|
|
|
|
Alberico, 2014 (11) |
7,6 |
48,5 (45,5-51,6) |
72,5 (71,7-73,2) |
12,6 (11,6-13,7) |
94,5 (94,1-95) |
|
Asplund, 2008 (12) |
15,6 |
51,7 (32,9-70,1) |
72,6 (64,8-79,3) |
25,9 (15,6-39,3) |
89,1 (82,0-93,7) |
|
Barros, 2014 (13) |
4 |
28,8 |
43,8 |
92,6 |
97,6 |
|
Li, 2013 (15) |
9,8 |
76 (74,5-77,4) |
44,9 (44,4-45,5) |
13 (12,5-13,5) |
94,5 (94,2-94,9) |
IC 95%: intervalo de confianza 95%.
Macrosomía neonatal
La prevalencia de macrosomía neonatal varió entre 4% y 15,6%. La sensibilidad varió entre 28,8% y 76%. La especificidad varió entre 43,8% y 72,6%. El valor predictivo positivo varió entre 12,6% y 92,6%, mientras que el valor predictivo negativo, entre 89,1% y 97,6% (Tabla 3). Las estimaciones correspondieron a cuatro estudios Alberico (11), Asplund (12), Barros (13) y Li (15).
Evaluación de la calidad
Todos los estudios presentaron alto riesgo de sesgo en los dominios de selección de pacientes y prueba de referencia, mientras que la mayoría de los estudios presentaron alto riesgo de sesgo en los dominios de prueba índice, y de flujo y tiempos. En relación a la aplicabilidad de los estudios, la mayoría de estos presentó alto riesgo en el dominio de selección de pacientes y bajo riesgo en la prueba de referencia; los resultados en el dominio de prueba índice fueron variables (tabla 4).
Tabla 4. Evaluación de la calidad de los estudios incluidos según QUADAS 2.
DISCUSIÓN
En la actualidad, existe una mayor comprensión sobre la interacción entre la dieta materna, el IMC pregestacional, la ganancia de peso durante la gestación, las comorbilidades maternas, y los desenlaces de salud inmediatos y a largo plazo (16). Sin embargo, el aumento óptimo de peso gestacional aún no se ha definido claramente y sigue siendo un tema controversial y crítico (17). Existen recomendaciones orientadas a la ganancia de peso del IOM y del CLAP, habitualmente empleadas en la atención prenatal. En ese contexto, el estudio tuvo como propósito evaluar las recomendaciones de ganancia de peso gestacional propuestas por el IOM y el CLAP en función a su capacidad para predecir el peso al nacer y la macrosomía neonatal sabiendo que se han relacionado con un incremento significativo del riesgo de desenlaces adversos maternos y neonatales (18).
Los hallazgos sugieren una influencia del país de procedencia del estudio para ambos desenlaces. Respecto al bajo peso al nacer, los hallazgos fueron consistentes, mostraron valores similares de sensibilidad y especificidad entre la cohorte brasileña de gestantes adultas (14) y la de gestantes adolescentes (13), siendo discrepantes a los obtenidos en una cohorte china, que presenta una menor sensibilidad y mayor especificidad (15). Estas diferencias también se observaron en el desenlace de macrosomía neonatal, donde la cohorte brasileña obtuvo menor sensibilidad y especificidad (13), en comparación con las cohortes italiana (11), estadounidense (12) y china (15).
Algunos estudios describen diferencias del estado nutricional pregestacional, la ganancia de peso durante el embarazo y la magnitud del riesgo de desenlaces adversos gestacionales y neonatales alrededor de poblaciones de diferentes continentes y etnias (19,20). En ese sentido, el propio IOM ha propuesto desarrollar estudios adicionales dirigidos a investigar si las recomendaciones de ganancia de peso durante la gestación difieren según grupo racial/étnico, sugiriendo que podrían reflejar no solo las diferencias biológicas entre los grupos, sino también la diferencia en sus condiciones socioeconómicas (1).
Por otro lado, los diferentes estudios incluidos en nuestra revisión reportaron proporciones más altas de valores predictivos negativos, en su mayoría superiores al 90%, en comparación con la proporción de valores predictivos positivos, en su mayoría inferiores al 25% para ambos desenlaces. Los valores predictivos positivos y negativos indican la probabilidad de que una prueba diagnóstica obtenga el diagnóstico correcto si resulta ser positiva o negativa, mientras que la sensibilidad y la especificidad valoran la probabilidad de obtener un resultado positivo o negativo, en función de la verdadera condición del paciente. En un escenario donde se desconoce a priori esta condición, los valores predictivos podrían resultar relevantes para apoyar las decisiones clínicas (21,22).
Sin embargo, la prevalencia de la enfermedad o condición que se quiere evaluar influye en los valores predictivos. Cuando esta es baja, mayor es el valor predictivo negativo y, en consecuencia, el valor predictivo positivo es más bajo (21,23). En este contexto la revisión reporta valores predictivos negativos más altos, lo que podría significar una característica importante y permitiría descartar con mayor seguridad y confianza la presencia de bajo peso al nacer y macrosomía neonatal en entornos donde ambas prevalencias son relativamente bajas.
El promedio de edad en las cohortes de gestantes adultas incluidas en nuestra revisión osciló entre los 26 y los 31 años. Esta característica epidemiológica difiere de la fecundidad de la mujer peruana, siendo la edad promedio del primer nacimiento a los 22,3 años, y el 12,6% de mujeres entre 15 y 19 años estuvieron embarazadas alguna vez (24), lo que incrementa el riesgo de desenlaces obstétricos y neonatales adversos ligados a la edad (25). No se ha determinado con exactitud el origen de esta relación, una hipótesis plantea que a mayor edad materna podría reflejarse también un mayor peso corporal antes del embarazo, por el incremento de peso acumulativo en la adultez (26), mientras que en gestantes añosas no se descarta la influencia del proceso natural de envejecimiento y la existencia de comorbilidades (25). De igual manera, está demostrado que el embarazo adolescente incrementa el riesgo obstétrico y neonatal relacionado con factores biológicos y sociales (27).
Tres estudios informaron las características del índice de masa corporal materno antes de la gestación (13-15). En estos tres estudios, de 2,5% a 11,2% presentó delgadez, y de 13,6% a 25,3% presentó sobrepeso u obesidad antes de la gestación. Ambas condiciones difieren de las características de la mujer en edad fértil en el Perú, donde la delgadez por IMC afecta a un 1,6% y el exceso de peso (sobrepeso u obesidad) afecta a un 62,2% (24). Consideramos que estas diferencias podrían explicarse en la antigüedad de las cohortes, entre 1999 y 2009. Estas discrepancias podrían influir en la exactitud de los resultados de nuestra revisión, dado que hay estudios que demuestran que la delgadez pregestacional se asocia con un incremento del riesgo de bajo peso al nacer (28,29), mientras que el sobrepeso y la obesidad pregestacional se asocia con un incremento del riesgo de macrosomía neonatal (29). Por esta razón, resulta importante que las recomendaciones sobre ganancia de peso durante la gestación consideren el índice de masa corporal pregestacional.
Tres estudios incluyeron gestantes con diabetes gestacional, con una prevalencia promedio de 1,3% a 2,6%, mientras que un estudio excluyó a las gestantes con esta condición. Dos estudios no refieren el control de esta variable. En todos los casos, esta situación limita la representatividad de los resultados, dado que la prevalencia estimada de diabetes gestacional afecta hasta 16% de las gestantes en Perú (30). La diabetes gestacional triplica el riesgo de nacimientos macrosómicos, mientras que, el tratamiento de esta enfermedad reduce la incidencia de macrosomía en el neonato. Los mecanismos fisiológicos postulados para explicar la relación entre la diabetes gestacional y la macrosomía se explican por la hiperinsulinemia fetal, mayor utilización de la glucosa y aumento del tejido adiposo fetal (31).
No existe un estándar de oro para evaluar el desarrollo fetal, que sea apropiado y cumpla las siguientes características: proporciona una clasificación sin errores de todos los sujetos evaluados, permite verificar todos los resultados de las pruebas índice, y puede realizarse dentro de un corto intervalo de tiempo que evite cambios de la condición objetivo (32). Las mediciones de crecimiento fetal por ultrasonido o resonancia magnética no cumplen con las características antes descritas (33,34), usándose la ganancia de peso gestacional como una medida aproximada del crecimiento fetal, de medición simple y bajo costo. Sin embargo, los errores de clasificación propios de un estándar imperfecto conllevan inevitablemente a un sesgo positivo o negativo en la precisión.
A nivel mundial, se estima que un 47% de gestantes tuvo una ganancia de peso gestacional mayor a las recomendaciones del IOM, y un 23%, una ganancia menor a dichas recomendaciones (18). En este contexto, se han identificado diferentes determinantes sociales que configuran una problemática compleja que va más allá de cuestiones únicamente biológicas. Dentro de este conjunto de determinantes sociales, se ha sugerido que la paridad puede influir en el índice de masa corporal pregestacional (35), los periodos intergenésicos menores a 18 meses y mayores a 59 meses podrían incrementar el riesgo de nacimientos con bajo peso al nacer (36), el bajo nivel educativo incrementa el riesgo de ganancia de peso insuficiente o excesivo durante el embarazo (37), que algunos factores psicológicos como el distrés emocional o la insatisfacción con la imagen corporal influyen en la ganancia de peso (38) o que un bajo nivel de actividad física durante la gestación incrementa el riesgo de tener una ganancia excesiva (39). Cada uno de estos determinantes sociales se acompaña de factores subyacentes que se interrelacionan para formar un modelo causal complejo.
Una revisión sistemática reportó que cuantificar el peso como intervención aislada en la atención prenatal no es eficaz en reducir el aumento de peso durante la gestación (40), por lo que se recomienda como parte de las intervenciones que el profesional de la salud trabaje en colaboración con las madres para lograr los objetivos de aumento de peso; monitorizar y brindar retroalimentación sobre su progreso (40), tener enfoques estandarizados y basados en evidencia científica (41), mejorar el conocimiento y las creencias sobre la ganancia de peso en mujeres en edad fértil (42), incorporar un enfoque holístico integrando no solo a la gestante, sino a la familia o su entorno social (43), proporcionar consulta nutricional sobre una alimentación saludable; con el objetivo orientado en las calorías, macronutrientes necesitados y niveles adecuados de actividad física (44), acompañar las actividades dietéticas con estrategias de cambios de comportamiento, principalmente en la provisión de información, entrevistas motivacionales, automonitoreo y recompensas contingentes (45), logrando brindar un cuidado prenatal con enfoque multidisciplinario (46,47). No se ha determinado con exactitud la duración, frecuencia, intensidad o el entorno óptimo para brindar estas intervenciones (48).
Dentro de las principales limitaciones de la presente revisión sistemática se considera que la mayoría de estudios incluidos fueron cohortes retrospectivas que utilizaron fuentes de información de registros médicos. Este tipo de estudios presenta algunas limitaciones, como la dificultad para controlar los factores de confusión (edad gestacional, edad de la madre, nivel socioeconómico, enfermedades preexistentes, entre otros), con frecuencia no existen variables que pudieran ajustar el análisis o se miden de forma imprecisa; adicionalmente, no asegurar un alto porcentaje de participación y seguimiento incrementa el riesgo de un probable sesgo de selección. Por ejemplo, los estudios incluidos tuvieron una pérdida de entre 20% y 40%, en su mayoría por datos faltantes en las variables de interés. Un solo estudio (13) analizó las características entre la población analizada y las pérdidas, y encontró diferencias significativas entre ambos grupos. La heterogeneidad en la metodología de medición de las variables de interés, pudieron no ser adecuadamente controladas, lo cual incrementó el riesgo de sesgo.
Nuestra revisión se enfocó en la capacidad de predecir el bajo peso al nacer y la macrosomía neonatal según recomendaciones del IOM sobre la ganancia de peso gestacional. Sin embargo, la inadecuada ganancia de peso gestacional también se relaciona con desenlaces maternos: la menor probabilidad de iniciar o continuar la lactancia materna (49), el incremento de la retención del peso posparto (50), el riesgo de obesidad, diabetes, enfermedades cardíacas, enfermedades endocrinas y enfermedades psiquiátricas en años posteriores (51). En tanto, en el recién nacido se asocia con un incremento del riesgo de obesidad, enfermedades metabólicas y cardiovasculares en los años de vida posteriores (52).
No se encontró ningún estudio que evaluara la capacidad de las recomendaciones de ganancia de peso del CLAP para predecir el BPN y la macrosomía neonatal. En cuanto a las recomendaciones del IOM, su sensibilidad y especificidad fue baja, especialmente en las cohortes procedentes de América Latina. No obstante, la baja calidad metodológica de los estudios, la limitada representatividad de las cohortes estudiadas y los probables factores de confusión no ajustados sugieren la necesidad de desarrollar en el futuro estudios con una adecuada calidad metodológica que permitan establecer recomendaciones que se ajusten a las características epidemiológicas de la población peruana. Asimismo, resulta indispensable prevenir la inadecuada ganancia de peso durante la gestación, proporcionando una atención prenatal de calidad, basada en un enfoque multidisciplinario, con intervenciones apoyadas en evidencias científicas y que considere las diferentes determinantes sociales involucradas en su desarrollo.
REFERENCIAS BIBLIOGRÁFICAS
1. Rasmussen KM, Yaktine AL, Institute of Medicine (US) and National Research Council (US) Committee to Reexamine IOM Pregnancy Weight Guidelines. IOM (Institute of Medicine) and NRC (National Research Council). Weight Gain During Pregnancy: Reexamining the Guidelines [Internet]. Washington, DC: The National Academies Press (US); 2009 [citado el 20 de junio de 2019]. Disponible en: https://www.ncbi.nlm.nih.gov/books/NBK32813/.
2. Kominiarek MA, Peaceman AM. Gestational weight gain. Am J Obstet Gynecol. 2017;217(6):642-51. doi: 10.1016/j.ajog.2017.05.040 .
3. Han Z, Lutsiv O, Mulla S, McDonald SD, Knowledge Synthesis Group. Maternal height and the risk of preterm birth and low birth weight: a systematic review and meta-analyses. J Obstet Gynaecol Can. 2012;34(8):721-46. doi: 10.1016/S1701-2163(16)35337-3.
4. Tian C, Hu C, He X, Zhu M, Qin F, Liu Y, et al. Excessive weight gain during pregnancy and risk of macrosomia: a meta-analysis. Arch Gynecol Obstet. 2016;293(1):29-35. doi: 10.1007/s00404-015-3825-8.
5. Law CM. Significance of birth weight for the future. Arch Dis Child Fetal Neonatal Ed. 2002;86(1):F7-8. doi: 10.1136/fn.86.1.f7.
6. Petrou S. Economic consequences of preterm birth and low birthweight. BJOG Int J Obstet Gynaecol. 2003;110(20):17-23.
7. Mardones F, García-Huidobro T, Ralph C, Farías M, Domínguez A, Rojas I, et al. Influencia combinada del índice de masa corporal pregestacional y de la ganancia de peso en el embarazo sobre el crecimiento fetal. Rev Med Chil. 2011;139(6):710-6. doi: 10.4067/S0034-98872011000600003.
8. Fescina R. Aumento de peso durante el embarazo. Método para su cálculo cuando se desconoce el peso habitual. Bol of Sanit Panam. 1983;95(2):156-62.
9. Hutton B, Salanti G, Caldwell DM, Chaimani A, Schmid CH, Cameron C, et al. The PRISMA extension statement for reporting of systematic reviews incorporating network meta-analyses of health care interventions: checklist and explanations. Ann Intern Med. 2015;162(11):777-84. doi: 10.7326/M14-2385.
10. Whiting PF, Rutjes AWS, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Ann Intern Med. 2011;155(8):529-36. doi: 10.7326/0003-4819-155-8-201110180-00009.
11. Alberico S, Montico M, Barresi V, Monasta L, Businelli C, Soini V, et al. The role of gestational diabetes, pre-pregnancy body mass index and gestational weight gain on the risk of newborn macrosomia: results from a prospective multicentre study. BMC Pregnancy Childbirth. 2014;14:23. doi: 10.1186/1471-2393-14-23.
12. Asplund CA, Seehusen DA, Callahan TL, Olsen C. Percentage change in antenatal body mass index as a predictor of neonatal macrosomia. Ann Fam Med. 2008;6(6):550-4. doi: 10.1370/afm.903.
13. Barros DC, Saunders C, Santos MM, Libera BD, Gama SG, Leal MdoC. The performance of various anthropometric assessment methods for predicting low birth weight in adolescent pregnant women. Braz J Epidemiol. 2014;17(3):761-74. doi: 10.1590/1809-4503201400030015.
14. Carvalho P, Barros DC, Campos ABF, Ayeta AC, Queiróz JA, Saunders C. Performance of an anthropometric assessment method as a predictor of low birthweight and being small for gestational age. J Hum Nutr Diet. 2015;28(3):292-9. doi: 10.1111/jhn.12235.
15. Li N, Liu E, Guo J, Pan L, Li B, Wang P, et al. Maternal prepregnancy body mass index and gestational weight gain on pregnancy outcomes. PloS One. 2013;8(12):e82310. doi: 10.1371/journal.pone.0082310.
16. Shenassa ED, Kinsey C, Moser M, Fahey J. Gestational Weight Gain: Historical Evolution of a Contested Health Outcome. Obstet Gynecol Surv. 2017;72(7):445-53. doi: 10.1097/OGX.0000000000000459.
17. Meštrović Z, Roje D, Vulić M, Zec M. Calculation of optimal gestation weight gain in pre-pregnancy underweight women due to body mass index change in relation to mother’s height. Arch Gynecol Obstet. 2017;295(1):81-6. doi: 10.1007/s00404-016-4218-3.
18. Goldstein RF, Abell SK, Ranasinha S, Misso M, Boyle JA, Black MH, et al. Association of Gestational Weight Gain With Maternal and Infant Outcomes: A Systematic Review and Meta-analysis. JAMA. 2017;317(21):2207-25. doi: 10.1001/jama.2017.3635.
19. Headen IE, Davis EM, Mujahid MS, Abrams B. Racial-ethnic differences in pregnancy-related weight. Adv Nutr Bethesda Md. 2012;3(1):83-94. doi: 10.3945/an.111.000984.
20. Goldstein RF, Abell SK, Ranasinha S, Misso ML, Boyle JA, Harrison CL, et al. Gestational weight gain across continents and ethnicity: systematic review and meta-analysis of maternal and infant outcomes in more than one million women. BMC Med. 2018;16(1):153. doi: 10.1186/s12916-018-1128-1.
21. Fernández P, Pértegas-Díaz S. Pruebas diagnósticas: Sensibilidad y especificidad. Cad Aten Primaria. 2003;10:120-4.
22. Bravo-Grau S, Cruz QJP. Estudios de exactitud diagnóstica: Herramientas para su Interpretación. Rev Chil Radiol. 2015;21(4):158-64. doi: 10.4067/S0717-93082015000400007.
23. Hernaez R, Thrift AP. High Negative Predictive Value, Low Prevalence, and Spectrum Effect: Caution in the Interpretation. Clin Gastroenterol Hepatol Off. 2017;15(9):1355-8. doi: 10.1016/j.cgh.2017.05.002.
24. Instituto Nacional de Estadística e Informática. Perú: Encuesta Demográfica y de Salud Familiar 2018 [Internet]. Lima, Perú: INEI; 2018 [citado el 20 de junio de 2019]. Disponible en: https://www.inei.gob.pe/media/MenuRecursivo/publicaciones_digitales/Est/Lib1656/index1.html .
25. Pinheiro RL, Areia AL, Mota Pinto A, Donato H. Advanced Maternal Age: Adverse Outcomes of Pregnancy, A Meta-Analysis. Acta Med Port. 2019;32(3):219-26. doi: 10.20344/amp.11057.
26. McKoy JN, Hartmann KE, Jerome RN, Andrews JC, Penson DF. Future Research Needs for Outcomes of Weight Gain in Pregnancy [Internet]. Rockville (MD): Agency for Healthcare Research and Quality (US); 2010 [citado 20 de junio de 2019]. Disponible en: http://www.ncbi.nlm.nih.gov/books/NBK51337/ .
27. Azevedo WF, Diniz MB, Fonseca ESVB, Azevedo LMR, Evangelista CB. Complications in adolescent pregnancy: systematic review of the literature. Einstein Sao Paulo Braz. 2015;13(4):618-26. doi: 10.1590/S1679-45082015RW3127.
28. Rahman MM, Abe SK, Kanda M, Narita S, Rahman MS, Bilano V, et al. Maternal body mass index and risk of birth and maternal health outcomes in low- and middle-income countries: a systematic review and meta-analysis. Obes Rev. 2015;16(9):758-70. doi: 10.1111/obr.12293.
29. Yu Z, Han S, Zhu J, Sun X, Ji C, Guo X. Pre-Pregnancy Body Mass Index in Relation to Infant Birth Weight and Offspring Overweight/Obesity: A Systematic Review and Meta-Analysis. PLoS ONE. 2013;8(4):1-1. doi: 10.1371/journal.pone.0061627.
30. Villena JE. Diabetes Mellitus in Peru. Ann Glob Health. 2015;81(6):765-75. doi: 10.1016/j.aogh.2015.12.018.
31. Kamana K, Shakya S, Zhang H. Gestational diabetes mellitus and macrosomia: a literature review. Ann Nutr Metab. 2015;66(2):14-20. doi: 10.1159/000371628.
32. Reitsma JB, Rutjes AWS, Khan KS, Coomarasamy A, Bossuyt PM. A review of solutions for diagnostic accuracy studies with an imperfect or missing reference standard. J Clin Epidemiol. 2009;62(8):797-806. doi: 10.1016/j.jclinepi.2009.02.005.
33. Kadji C, Cannie MM, Resta S, Guez D, Abi-Khalil F, De Angelis R, et al. Magnetic resonance imaging for prenatal estimation of birthweight in pregnancy: review of available data, techniques, and future perspectives. Am J Obstet Gynecol. 2019;220(5):428-39. doi: 10.1016/j.ajog.2018.12.031.
34. Milner J, Arezina J. The accuracy of ultrasound estimation of fetal weight in comparison to birth weight: A systematic review. Ultrasound Leeds Engl. 2018;26(1):32-41. doi: 10.1177/1742271X17732807.
35. Hill B, Bergmeier H, McPhie S, Fuller-Tyszkiewicz M, Teede H, Forster D, et al. Is parity a risk factor for excessive weight gain during pregnancy and postpartum weight retention? A systematic review and meta-analysis. Obes Rev. 2017;18(7):755-64. doi: 10.1111/obr.12538.
36. Conde-Agudelo A, Rosas-Bermúdez A, Kafury-Goeta AC. Birth spacing and risk of adverse perinatal outcomes: a meta-analysis. JAMA. 2006;295(15):1809-23. doi: 10.1001/jama.295.15.1809.
37. O’Brien EC, Alberdi G, McAuliffe FM. The influence of socioeconomic status on gestational weight gain: a systematic review. J Public Health Oxf Engl. 2018;40(1):41-55. doi: 10.1093/pubmed/fdx038.
38. Kapadia MZ, Gaston A, Van Blyderveen S, Schmidt L, Beyene J, McDonald H, et al. Psychological factors and trimester-specific gestational weight gain: a systematic review. J Psychosom Obstet Gynaecol. 2015;36(1):15-22. doi: 10.3109/0167482X.2014.993311.
39. Streuling I, Beyerlein A, Rosenfeld E, Hofmann H, Schulz T, von Kries R. Physical activity and gestational weight gain: a meta-analysis of intervention trials. BJOG Int J Obstet Gynaecol. 2011;118(3):278-84. doi: 10.1111/j.1471-0528.2010.02801.x.
40. Fealy SM, Taylor RM, Foureur M, Attia J, Ebert L, Bisquera A, et al. Weighing as a stand-alone intervention does not reduce excessive gestational weight gain compared to routine antenatal care: a systematic review and meta-analysis of randomised controlled trials. BMC Pregnancy Childbirth. 2017;17(1):36. doi: 10.1186/s12884-016-1207-2.
41. Flannery C, McHugh S, Kenny LC, O’Riordan MN, McAuliffe FM, Bradley C, et al. Exploring obstetricians’, midwives’ and general practitioners’ approach to weight management in pregnant women with a BMI ≥25 kg/m2: a qualitative study. BMJ Open. 2019;9(1):e024808. doi: 10.1136/bmjopen-2018-024808.
42. Hill B, Hayden M, McPhie S, Bailey C, Skouteris H. Preconception and antenatal knowledge and beliefs about gestational weight gain. Aust N Z J Obstet Gynaecol. 2019; doi: 10.1111/ajo.12942.
43. Hamilton EAA, Nowell AK, Harden A, Thangaratinam S. Conduct and reporting of acceptability, attitudes, beliefs and experiences of pregnant women in randomised trials on diet and lifestyle interventions: A systematic review. Eur J Obstet Gynecol Reprod Biol. 2018;225:243-54. doi: 10.1016/j.ejogrb.2018.05.008.
44. Shieh C, Cullen DL, Pike C, Pressler SJ. Intervention strategies for preventing excessive gestational weight gain: systematic review and meta-analysis. Obes Rev. 2018;19(8):1093-109. doi: 10.1111/obr.12691.
45. Hill B, Skouteris H, Fuller-Tyszkiewicz M. Interventions designed to limit gestational weight gain: a systematic review of theory and meta-analysis of intervention components. Obes Rev. 2013;14(6):435-50. doi: 10.1111/obr.12022.
46. Ghaffari N, Srinivas SK, Durnwald CP. The multidisciplinary approach to the care of the obese parturient. Am J Obstet Gynecol. 2015;213(3):318-25. doi: 10.1016/j.ajog.2015.03.001.
47. Hodnett ED, Fredericks S, Weston J. Support during pregnancy for women at increased risk of low birthweight babies. Cochrane Database Syst Rev. 2010;(6):CD000198. doi: 10.1002/14651858.CD000198.pub2.
48. Walker R, Bennett C, Blumfield M, Gwini S, Ma J, Wang F, et al. Attenuating Pregnancy Weight Gain-What Works and Why: A Systematic Review and Meta-Analysis. Nutrients. 2018;10(7). doi: 10.3390/nu10070944.
49. Huang Y, Ouyang Y-Q, Redding SR. Maternal Prepregnancy Body Mass Index, Gestational Weight Gain, and Cessation of Breastfeeding: A Systematic Review and Meta-Analysis. Breastfeed Med. 2019;14(6):366-374. doi: 10.1089/bfm.2018.0138.
50. Rong K, Yu K, Han X, Szeto IMY, Qin X, Wang J, et al. Pre-pregnancy BMI, gestational weight gain and postpartum weight retention: a meta-analysis of observational studies. Public Health Nutr. 2015;18(12):2172-82. doi: 10.1017/S1368980014002523.
51. Moll U, Olsson H, Landin-Olsson M. Impact of Pregestational Weight and Weight Gain during Pregnancy on Long-Term Risk for Diseases. PloS One. 2017;12(1):e0168543. doi: 10.1371/journal.pone.0168543.
52. Poston L. Gestational weight gain: influences on the long-term health of the child. Curr Opin Clin Nutr Metab Care. 2012;15(3):252-7. doi: 10.1097/MCO.0b013e3283527cf2.
Citar como: Santos-Antonio G, Alvis-Chirinos K, Aguilar-Esenarro L, Bautista-Olórtegui W, Velarde-Delgado P, Aramburu A. Ganancia de peso gestacional como predictor de macrosomía y bajo peso al nacer: revisión sistemática. Rev Peru Med Exp Salud Publica. 2020;37(3):403-11. doi: https://doi.org/10.17843/rpmesp.2020.373.4919.
Correspondencia: Gabriela Santos-Antonio; Jirón Tizón y Bueno 276, Jesús María, Lima 11, Perú; gsantos@ins.gob.pe
Contribuciones de los autores: GS, KA y PV concibieron la idea original del estudio. AA redactó la versión preliminar del protocolo, la cual fue revisada y aprobada por todos los autores. AA diseñó las estrategias y condujo la búsqueda sistemática de estudios. Todos los autores participaron en la selección y extracción de datos de los estudios. AA y GS redactaron la versión preliminar del manuscrito, cuya versión final fue revisada y aprobada por todos los autores. Todos los autores asumen responsabilidad de los contenidos del artículo.
Fuentes de financiamiento: Este estudio fue financiado por Instituto Nacional de Salud, Lima, Perú.
Conflictos de interés: Los autores declaran no tener conflictos de interés.
Material suplementario: Disponible en la versión electrónica de la RPMESP.
Recibido: 30/10/2019
Aprobado: 13/05/2020
En línea: 30/08/2020