ARTÍCULO ORIGINAL
Costo-utilidad de la vacuna contra el virus de papiloma humano en mujeres peruanas
Cost- utility of the vaccine against the human papiloma virus in peruvian women
Alfonso Gutiérrez-Aguado 1,2,a
1 Facultad de Ciencias Médicas, Universidad César Vallejo-Lima Norte. Lima, Perú.
2 Unidad de Análisis y Generación de Evidencias en Salud Pública, Centro Nacional de Salud Pública, Instituto Nacional de Salud. Lima, Perú.
a Médico, Especialista de Gestión en salud
RESUMEN
Objetivos. Estimar el costo-utilidad de la vacuna contra el Virus de Papiloma Humano (VPH) en las mujeres peruanas luego de la aplicación de la vacuna cuando tenían 10 años de edad. Materiales y métodos. Se realizó un análisis de costo-utilidad empleando el modelo oculto de Markov en una cohorte hipotética de mujeres peruanas, basado en la información de parámetros epidemiológicos, costos asociados al Cáncer de cuello uterino (CCU) y la eficacia y los costos de la vacunación contra el VPH. Los costos de la vacunación se estimaron desde la perspectiva del Ministerio de Salud de Perú y se compararon con los años de vida ajustados por calidad (AVAC) utilizando una tasa de descuento del 5 %. Resultados. El costo anual de la vacunación fue de USD 16 861 490, para el tamizaje con Papanicolau fue de USD 3 060 793 y los costos asociados al CCU fueron de USD 15 580 000. La razón de costo-utilidad incremental (RCUI) fue de 6775 USD/AVAC. Conclusiones. La vacunación contra el VPH puede resultar costo-útil comparada con el no vacunar.
Palabras clave: Vacunas contra papilomavirus; Neoplasias del cuello uterino; Inmunización; Costos y análisis de costo (fuente: DeCS BIREME).
ABSTRACT
Objetives. To estimate the cost-utility of the vaccine against the Human Papiloma Virus (HPV) in peruvian women after the application of the vaccine at 10 years of age. Materials and methods. A cost-utility analysis was performed using the Markov´s hidden model in a hypothetical cohort of peruvian women, based on the information on epidemiological parameters, costs associated to uterine cervical cancer (UCC) and the efficacy and costs of the vaccine against the HPV. The vaccination costs were estimated from the Peruvian Ministry of Health perspective and were compared against the quality-adjusted life years (QALYs), using a discount rate of 5%. Results. The annual cost of the vaccination was USD 16’861,490, for the Papanicoau screening it was USD 3’060,793 and the costs associated to the UCC were USD 15’580,000. The incremental cost utility ratio (ICUR) was 6,775 USD/QALY. Conclusions. Vaccination against HPV can be cost-utility compared to not vaccinating.
Key words: Papillomavirus vaccines; Uterine cervical neoplasms; Inmunization; Costs and cost analysis (source: MeSH NLM).
INTRODUCCIÓN
El cáncer de cuello uterino (CCU) es el tercer cáncer más común en las mujeres y el séptimo en comparación con todos los cánceres. El 2008, a nivel mundial, se registraron 530 000 casos (incidencia de 15,8 x 100 000 mujeres) y 275 000 muertes (mortalidad de 8,2 x 100 000 mujeres); sin embargo, más del 85 % de la carga de enfermedad se produce en países en vías de desarrollo. En Latinoamérica se registraron 47 881 casos (incidencia acumulada de 24,6 x 100 000 mujeres) y 21 836 muertes (mortalidad de 11,2 x 100 000 mujeres) (1).
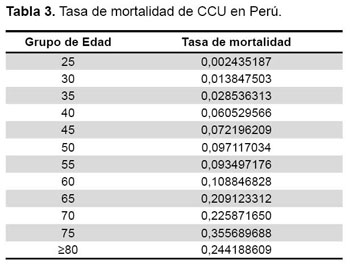
En el Perú, el CCU es la principal causa de muerte por cáncer en las mujeres, se estima que cada año se presentan alrededor de 5000 nuevos casos (incidencia acumulada de 30,9 x 100 000 mujeres) y representa 44 924 años de vida perdidos ajustados por discapacidad (2). En nuestro país se implementó el programa de tamizaje de papanicolau desde 1974; sin embargo, más de 2500 mujeres fallecen anualmente debido a esta enfermedad (mortalidad de 14,6 x 100 000 mujeres) (3).
La infección por el virus papiloma humano (VPH) es el principal factor de riesgo para desarrollar CCU (4); existen más de 100 genotipos, de los cuales los genotipos 16, 18, 31, 33, 45 y 52 son los más oncogénicos; los genotipos 11 y 6 son de bajo riesgo, pero son las principales causantes de los condilomas y verrugas genitales (5). En Perú, los genotipos más frecuentes son el VPH-16 (56,1 %), VPH-18 (12,2 %), VPH-31 (9,7 %) y VPH-52 (7,7 %) (6).
En la actualidad se comercializan ampliamente dos vacunas contra VPH en todo el mundo. Estas vacunas son la vacuna tetravalente, que fue autorizada por la Food and Drug Administration (FDA) en 2006 y que contiene partículas similares a virus de los genotipos de VPH 6, 11, 16 y 18; y la vacuna bivalente, que fue autorizada en 2007, y contiene partículas similares a virus de los tipos 16 y 18 del VPH (7). Ambas vacunas tienen autorización para usarlas en mujeres de 9 a 26 años de edad (33).
Aún existe la disyuntiva de ingresar la vacuna contra el VPH al esquema de vacunación, siendo pocos los países que la tienen en su esquema universal. Perú fue el primer país en incorporarla en Sudamérica, seguido por Argentina y Paraguay (8).
El ingreso de una vacuna dentro de un esquema de vacunación implica una serie de aspectos, dentro de ellos la decisión política, la cual debe estar respaldada por el sustento técnico debido, este sustento lo otorgan, en la mayoría de veces, las evaluaciones económicas, en las que los estudios de costo-efectividad y costo-utilidad son los más adecuados (9).
Las evaluaciones económicas son instrumentos cada vez más usados por los diferentes decisores en el ámbito de la salud. La Organización Mundial de la Salud (OMS) recomienda, en su “Informe sobre la salud en el mundo”, la realización de estudios de costo-efectividad, con el fin de identificar intervenciones orientadas a prevenir los principales riesgos que amenazan a la salud y, así, priorizar las intervenciones más costo-efectivas y accesibles (9).
Hay una cantidad considerable de información sobre costo-efectividad de la vacuna contra el VPH en países desarrollados (10), pero esta información disminuye considerablemente para los países en vías de desarrollo, como el nuestro.
Es por ello que el objetivo de este estudio fue realizar un análisis de costo-utilidad de la vacuna contra el VPH en mujeres peruanas, a quienes se vacunaría a los diez años de edad; para compararlo con el costo del tamizaje de Papanicolau, la vacunación bivalente y el no vacunar. Este trabajo se realizó desde la perspectiva del financiador, que sería el Ministerio de Salud de Perú, empleando un modelo de Markov que reproduce la historia natural de la enfermedad por CCU, con un horizonte temporal de 70 años.
MATERIALES Y MÉTODOS
Se realizó una evaluación económica tipo costo-utilidad estructurada sobre un modelo de Markov; empleando un cohorte hipotética compuesta por mujeres peruanas, que ingresaron cuando tenían diez años de edad. El tamaño de esta cohorte se basó en los datos que para el 2007 el Instituto Nacional de Estadística e Informática (INEI) informó, existiendo entonces 321 998 niñas de diez años de edad. Se decidió trabajar con una cohorte de esta edad tomando en consideración el esquema de vacunación peruano (8).
En nuestro modelo comparamos tres situaciones: el no vacunar y dos estrategias de prevención. La primera estrategia es la del tamizaje de Papanicolau y la segunda es la vacunación (vacuna bivalente). Para el caso del tamizaje de Papanicolau, se consideró a la población de 30-49 años, edad recomendada según normatividad del Instituto Nacional de Enfermedades Neoplásicas (INEN) (16). Se decidió por la vacuna bivalente porque esta es la que se usa en el esquema de vacunación peruano (8).
En el modelo de Markov, los estados de salud son: susceptible, infección por VPH, neoplasia intraepitelial cervical (NIC), cáncer cervical, muerte por cáncer cervical y muerte por otras causas. Se debe tener en cuenta que los estados del Modelo de Markov reproducen la historia natural de la enfermedad del CCU.
La transición entre estados tiene lugar en cada ciclo, la duración de cada ciclo es de un año. Se tomó un horizonte de temporalidad de 70 años. Se debe tener en cuenta que la población que se trabajó tenia una edad de diez años (para la intervención de no vacunar y vacunar) y de 30-49 años (para la intervención de tamizaje de Papanicolau).
Se generó así, un modelo de Markov empleando el programa TreeAge Pro versión 2009® (TreeAge Software, Inc).
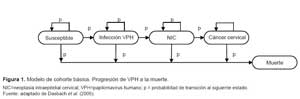
En cada una de las estrategias analizadas (no vacunar, vacunar y tamizaje de Papanicolau), se identificaron los principales caminos mutuamente excluyentes que un paciente en este contexto clínico puede transitar (Figura 1).
Cabe considerar que para nuestro modelo consideramos susceptible, desarrolla cáncer (Incluye a la infección por VPH, NIC 1-3 y cáncer de cuello uterino) y muerte. La representación gráfica del modelo de Markov usada para el cálculo del análisis costo-utilidad se presenta solo para la estrategia “vacunar”, cuya estructura es la misma que para la otra estrategia, y que se muestra en la Figura 2.
Dentro de los parámetros de estimación del modelo, se incluyeron las probabilidades de ocurrencia o transición, análisis de costos y utilidad.
PROBABILIDADES DE OCURRENCIA O DE TRANSICIÓN DE LOS ESTADOS
Las distintas probabilidades de transición han sido obtenidas de diversas fuentes de información (estudios epidemiológicos (11,25,30), registros de cáncer del INEN, estadísticas demográficas y opinión de expertos), mostrados en la Tabla 1 y Tabla 2.
ANÁLISIS DE COSTOS
Se realizó desde la perspectiva del financiador que, en este caso, sería el Ministerio de Salud de Perú, por ese motivo todos los costos están seleccionados en función del costo que el Ministerio de Salud debe asumir, tales como los costos directos (Costos directos médicos y no médicos tal como el de administración) (12). Los costos fueron ajustados al año 2010.
Se tomó en cuenta la estructura de costos de la vacunación contra VPH de la Estrategia Sanitaria Nacional de Inmunizaciones del MINSA y los costos de atención del paciente con infección VPH, NIC y CCU (13,14). Para ello se hizo un análisis de costo usando el documento técnico “Metodología para la estimación de costos estándar en establecimientos de salud” (15) y de las Normas Jefaturales del INEN (16,17): “Norma técnica oncológica para la prevención, detección y manejo de lesiones premalignas del cuello uterino a nivel nacional” y guía clínica en base a la guías del NCCN “Cáncer de cuello uterino”. Se generó así, una matriz de costos en Excel 2010. Para el análisis de costo se consideró un tipo de cambio equivalente a 1 USD = S/. 2,85.
EFECTIVIDAD Y UTILIDAD
Se tomó en consideración dos aspectos, la esperanza de vida y los años de vida ajustados por calidad (AVAC o QALY). Los datos para esperanza de vida para CCU se obtuvieron de la base de datos del estudio de carga de enfermedad desarrollada por Velásquez et al. (2).
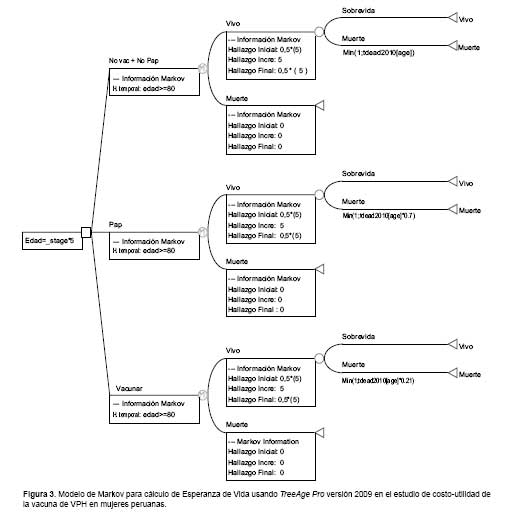
La representación gráfica del modelo de Markov usado para hallar la esperanza de vida (EV) de los nodos se presenta en la Figura 3.
Los datos de AVAC han sido obtenidos de diversas fuentes de información y se muestran en la Tabla 4 (25,30).

ANÁLISIS DE SENSIBILIDAD
La consistencia de las conclusiones se evaluó mediante un análisis de sensibilidad determinístico de tipo tornado. De esta forma se determinó cuáles fueron las variables críticas, es decir aquellas que tuviesen un rango de valores que, al modificarse, afectase los resultados globales del modelo. Este análisis se realizó tanto para las probabilidades calculadas, para los costos y para la utilidad. La tasa de descuento ha sido del 5 %, llevándola hasta el 0 %, para determinar la influencia de esta variable en el resultado final.
FUENTES DE INFORMACIÓN
Se recogieron datos para alimentar cada uno de los parámetros de estimación del modelo. La búsqueda incluyó estudios primarios y revisiones sistemáticas de la literatura en MEDLINE, TRIP Database, Science Direct, Registro Cochrane de Revisiones Sistemáticas y LILACS (2008-2010). Se utilizaron los siguientes términos MeSH y conectores “papilloma viruses” o “Cervical Cancer” y “cost effectiveness”, “cost-benefit analysis”, “bivalent vaccine”, “tetravalent vaccine” o su equivalente en español.
Se estableció como límites a los estudios realizados en niñas de 9 a 13 años de edad. Se consideraron estudios en idioma español e inglés y se hizo además una búsqueda secundaria, revisando las referencias bibliográficas de las fuentes ya obtenidas. Fueron excluidos los estudios que describían costos en moneda diferente al dólar (USD) y con medida de efecto distinta a los años de vida ajustados por calidad (AVAC).
RESULTADOS
ESPERANZA DE VIDA
Construyendo el modelo de Markov (Figura 3) y analizándolo se tuvo una expectativa de vida de 66 años para la población que no se vacuna y no se realiza tamizaje de Papanicolau; 69,3 años para las que se realizan tamizaje con Papanicolau y 76,3 años para las que se vacunan.
ANÁLISIS DE COSTO
Para la vacunación, el costo operativo en zona urbana era de USD 8,52, y en zona rural de USD 11,19. En regiones más alejadas, el costo total puede ser como máximo USD 31,13. Para el estudio se tomó un costo promedio ponderado en cada región del país de USD 9,86 y el costo del biológico del fondo rotatorio OPS de USD 54 (tres dosis), considerando la población de niñas para el 2007 (321 998) y con una cobertura de 82 %, se tiene un costo anual de la vacunación de USD 14 292 847, teniendo en cuenta el costo de la operación (33), el costo total era de USD 16 861 490.
Para el tamizaje de Papanicolau se obtuvo los siguientes costos, el costo unitario o por paciente del tamizaje por Papanicolau era de USD 2,78, en una población de 30- 49 años que según el INEI para el 2007 fue de 3563 122 mujeres y una cobertura de 30,9 % fue de USD 3060 793.
El costo que se tendría por no vacunar, que incluye el costo desde el diagnóstico, tratamiento y seguimiento de Infección con VPH, NIC y CCU, demandaría un gasto de USD 15 580 000 anualmente; todo ello se muestra en la Tabla 5 y Tabla 6.
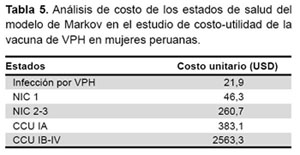
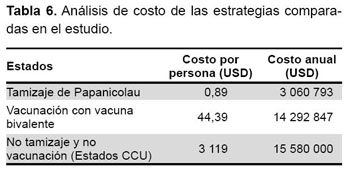
Al realizar el análisis de costo-utilidad entre la estrategia de vacunar y no vacunar, obtenemos una razón de costo-utilidad incremental (RCUI) de 6775 USD/AVAC. Este cálculo fue sin análisis de sensibilidad y se muestra en la Tabla 7.
ANÁLISIS DE SENSIBILIDAD
Se realizó el análisis de tornado, en el cual se puede observar la variación del resultado en relación a la variación individual de todos los parámetros de modo gráfico.
Al comparar la estrategia de vacunar y de no vacunar, teniendo en consideración un costo de la vacunación entre USD 20 y USD 60, se tendría una razón incremental de costo-utilidad (RCUI) entre 12000 USD/AVAC y 14000 USD/AVAC respectivamente. Al considerar la tasa de descuento de 0 % y de 5 %, se tendría un RCUI de 3000 USD/AVAC y 8000 USD/AVAC respectivamente (Figura 4).
Al comparar la estrategia de vacunar y del tamizaje con Papanicolau, teniendo en consideración un costo de la vacunación entre USD 20 y USD 60, se tendría una RCUI entre 16000 USD/AVAC y 18000 USD/AVAC res- pectivamente. Al considerar la tasa de descuento de 0 % y de 5 %, se tendría un RCUI de 3000 USD/AVAC y 9000 USD/AVAC respectivamente (Figura 5).
RESULTADOS DE FUENTES DE INFORMACIÓN
Se identificaron 29 estudios potencialmente relevantes y seleccionados para su localización; 19 estudios fueron excluidos por no cumplir con criterios de inclusión. Solamente se consideró diez estudios (cuatro revisiones sistemáticas (18-21) y seis estudios primarios (22-27)) de buena calidad metodológica y útiles para alimentar los nodos de probabilidad del modelo. Para ello se usó la QHES (Quality of Health Economic Analyses), recomendaciones del Instituto Nacional de Excelencia Clínica y Sanitaria del Reino Unido (NICE) y de Drummond (9), que se ven en la Tabla 8 y Tabla 9.
DISCUSIÓN
La limitación más importante del modelo es atribuible a la falta de datos específicos para el Perú en algunos parámetros epidemiológicos y de utilidad (AVAC), sin que esta falta vulnere la consistencia del modelo o la validez de los resultados, ya que se llevó a cabo una revisión que incluyó estudios primarios y revisiones sistemáticas. Otra limitación importante a considerar es la perspectiva del estudio, que es la del financiador, se debería tener en cuenta la perspectiva de la sociedad, que permitiría la inclusión de los costos indirectos (ausentismo del trabajo y costo de transporte del paciente).
Este estudio estimó que la expectativa de vida en el grupo de las mujeres vacunadas (76,3 años) fue mayor que las no vacunadas. Debemos acotar que la expectativa de vida en Perú es de 74,5 años en mujeres (3).
El costo anual de la vacunación contra el VPH se estimó alrededor de USD 16 millones, mientras que el costo de CCU de USD 15,5 millones. El costo del tamizaje con Papanicolau fue solo de USD 3 millones. Similar análisis de costo informó Solidoro et al (13) que estimó el impacto económico del cáncer de cuello uterino encontrando un costo de 12 millones para el 2004. La relación costoefectividad calculada bajo el escenario base de la vacunación fue de 6775 USD/AVAC, similar a lo descrito por Colantonio et al. (25) que informó una razón incremental de costo-efectividad (RCEI) de 4576 USD/AVAC para nuestro país.
Al someter este resultado a un análisis de sensibilidad, entre la estrategia de vacunación y el no vacunar, la RCUI osciló entre 3000 y 8000 USD/AVAC, con una tasa de descuento entre 0 y 5 %. Similar resultado se encontró al comparar la estrategia de vacunación y el tamizaje con Papanicolau, la RCUI osciló entre 3000 y 9000 USD/AVAC, con una tasa de descuento entre 5 y 0 %. Pero si tomamos en consideración el costo de la vacunación (USD 20 y USD 60), el RCUI oscilaría entre 12000 y 18000 USD/AVAC, tanto para el no vacunar como para la estrategia de tamizaje con Papanicolau.
Un patrón de referencia que ayuda a establecer si una intervención es costo-útil es el de la OMS. En su “Informe sobre la salud en el mundo”, la OMS sugiere que una intervención médica es considerada de alto costo-efectividad o costo-utilidad cuando la relación costo-efectividad calculada es menor o igual a tres veces el valor del PIB per cápita, respectivamente. Con un producto bruto interno per cápita (32) en USD 4200 en Perú, la vacuna contra el VPH puede ser considerada costo-útil, ya que la relación costo-utilidad calculada es menor al valor del PIB per cápita. Sin embargo, se debe tener en cuenta que al hacer el análisis de sensibilidad y teniendo en consideración el precio de la vacuna y no la tasa de descuento, los RCEI son altos, por ende, esta estrategia no sería costo-útil.
Los resultados obtenidos del análisis de costo-utilidad son consistentes con estudios similares notificados en otras publicaciones, en las que se presentan los resultados de la relación costo-efectividad para las dos intervenciones bajo diversos escenarios de cobertura, países y modelos de cohorte; de estos destacan el costo de la vacuna contra VPH (18-27). En Latinoamérica son pocos los estudios desarrollados, uno de ellos es el de Suárez (27) que realizó un análisis de costo-utilidad para la introducción de la vacuna en Chile, estimando un RCEI de 19 685 USD/AVAC. Colantonio describió algunos resultados en Argentina que fueron de 5 964 USD/AVAC; Brasil de 10 181 USD/AVAC; Chile en 17 666 USD/AVAC y en México fue de 10 134 USD/AVAC.
En conclusión, la estrategia de tamizaje con Papanicolau es más costo-útil que la vacunación contra VPH, sin embargo, su gran problema es la baja cobertura (29) (solamente 31 %). El incremento en la cobertura tendría un impacto en la morbilidad y en la mortalidad, por ende, tendría además un impacto económico.
Los resultados obtenidos para la vacunación contra VPH muestran que esta intervención genera un efecto presupuestario de consideración. El monto anual para la vacunación equivale aproximadamente al 10 % del presupuesto asignado por parte del Ministerio de Economía y Finanzas a la Estrategia Sanitaria Nacional de Inmunizaciones-MINSA (el presupuesto para el 2010 fue de 485 millones de soles).
Por ello, se recomienda negociar un precio de la vacuna adecuado y se debe de mejorar la cobertura nacional. Finalmente, se debería hacer un análisis de costo-utilidad o efectividad de la vacuna tetravalente, ya que esta vacuna incluye a genotipos no oncogénicos causantes de verrugas genitales, y podría tener un impacto económico considerable.
AGRADECIMIENTOS
Al Econ. Joaquín Mould, representante de Pfizer en Latinoamérica, por su apoyo y sugerencias para la realización del presente estudio. Al Dr. Seimer por su apoyo en el análisis de costos. Al equipo técnico del UNAGESP de Instituto Nacional de Salud por la revisión de artículos de investigación. Al Dr. Sobrevilla y al equipo técnico de Políticas de Salud de USAID-Perú por sus sugerencias.
Fuentes de financiamiento
Autofinanciado.
Conflictos de interés
El autor declara no tener conflictos de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. Ferlay J, Shin HR, Bray F, Forman D, Mathers C and Parkin DM. GLOBOCAN 2008, Cancer Incidence and Mortality Worldwide: IARC CancerBase No. 10 [Internet]. Lyon, France: International Agency for Research on Cancer; 2010.
2. Velásquez A, Seclén Y, Poquioma E, Cachay C, Espinoza R. Munayco C. La carga de enfermedad y lesiones en el Perú: Ajustado con datos nacionales de morbilidad y mortalidad. Lima: MINSA/USAID; 2009.
3. World Health Organization. Institut Català d’Oncologia. Human Papillomavirus and Related Cancers in Peru. WHO/ ICO Information Centre on HPV and Cervical Cancer. Barcelona: WHO/ICO HPV Information Centre; 2010.
4. Schiffman MH, Bauer HM, Hoover RN, Glass AG, Cadell DM, Rush BB, et al. Epidemiologic evidence showing that human papillomavirus infection causes most cervical intraepithelial neoplasia. J Natl Cancer Inst. 1993;85(12):958-64.
5. Muñoz N, Castellsagué X, de González AB, Gissmann L. Chapter 1: HPV in the etiology of human cancer. Vaccine. 2006;24 Suppl 3:S3/1-10.
6. Santos C. Virus del papiloma humano y Cáncer del Cuello Uterino en el Perú. Rev Per Ginecol Obstet. 2007;53(2):98- 100.
7. Castellsagué X, Bosch F. Vacunas frente al virus del papiloma humano, para la prevención del cáncer de cuello uterino. Rev Per Ginecol Obstet. 2007;53(2):101-9.
8. Ministerio de Salud del Perú. Norma Técnica de Salud que establece el esquema nacional de vacunación. RM N°070-2011/MINSA:NTS N° 080-MINSA/DGSP V.02. Lima: MINSA; 2011.
9. Drummond MF, Sculpher MJ, Torrance GW, O’Brien BJ, Stoddart GL. Methods for the economic evaluation of health care programmes. 3rd Edition. Oxford: Oxford University Press; 2005.
10. Techakehakij W, Feldman RD. Cost-effectiveness of HPV vaccination compared with Pap smear screening on a national scale: a literature review. Vaccine. 2008;26(49):6258- 65.
11. Dasbach EJ, Elbasha EH, Insinga RP. Mathematical models for predicting the epidemiologic and economic impact of vaccination against human papillomavirus infection and disease. Epidemiol Rev. 2006;28:88-100.
12. Meltzer MI. Introduction to health economics for physicians. Lancet. 2001;358(9286):993-8.
13. Solidoro A, Olivares L, Castellano C, Barriga O, Galdos R, Cáceres E. Cáncer de cuello uterino en el Perú: Impacto económico del cáncer invasor. Diagnóstico. 2004;43(1):29- 33.
14. Gutiérrez S. Cáncer: costos de tratamiento en Perú. Lima: Acción Internacional para la Salud, Oficina de Coordinación América Latina y el Caribe; 2009.
15. Ministerio de Salud del Perú. Metodología para la Estimación de Costos Estándar en los Establecimientos de Salud. RM N° 195-2009/MINSA: Documento Técnico. Lima: MINSA; 2009.
16. Instituto Nacional de Enfermedades Neoplásicas. Norma Técnico Oncológica para la Prevención, Detección y manejo de lesiones Pre-malignas del Cuello Uterino a nivel Nacional. RJ N°121-RJ-INEN-2008. Lima: INEN; 2008.
17. Instituto Nacional de Enfermedades Neoplásicas. Guía Clínica en base a la Guías del NCCN “Cáncer de Cuello Uterino”. RJ N°011-2011-J/INEN. Lima: INEN; 2011.
18. Ortega-Sanchez IR, Lee GM, Jacobs RJ, Prosser LA, Molinari NA, Zhang X, et al; Working Group on Leading Economic Issues for New Vaccine for Adolescents. Projected cost-effectiveness of new vaccines for adolescents in the United States. Pediatrics. 2008;121 Suppl 1:S63-78.
19. Puig-Junoy J, Lopez-Valcarcel BG. Economic evaluations of massive HPV vaccination: within-study and between study variations in incremental cost per QALY gained. Prev Med. 2009;48(5):444-8.
20. Marra F, Cloutier K, Oteng B, Marra C, Ogilvie G. Effectiveness and cost effectiveness of human papillomavirus vaccine: a systematic review. Pharmacoeconomics. 2009;27(2):127-47.
21. Armstrong EP. Prophylaxis of cervical cancer and related cervical disease: a review of the cost-effectiveness of vaccination against oncogenic HPV types. J Manag Care Pharm. 2010;16(3):217-30.
22. Rogoza RM, Ferko N, Bentley J, Meijer CJ, Berkhof J, Wang KL, et al. Optimization of primary and secondary cervical cancer prevention strategies in an era of cervical cancer vaccination: a multi-regional health economic analysis. Vaccine. 2008;26 Suppl 5:F46-58.
23. Sinanovic E, Moodley J, Barone MA, Mall S, Cleary S, Harries J. The potential cost-effectiveness of adding a human papillomavirus vaccine to the cervical cancer screening programme in South Africa. Vaccine. 2009;27(44):6196- 202.
24. Mennini FS, Giorgi Rossi P, Palazzo F, Largeron N. Health and economic impact associated with a quadrivalent HPV vaccine in Italy. Gynecol Oncol. 2009;112(2):370-6.
25. Colantonio L, Gómez JA, Demarteau N, Standaert B, Pichón-Rivière A, Augustovski F. Cost-effectiveness analysis of a cervical cancer vaccine in five Latin American countries. Vaccine. 2009;27(40):5519-29.
26. Anonychuk AM, Bauch CT, Merid MF, Van Kriekinge G, Demarteau N. A cost-utility analysis of cervical cancer vaccination in preadolescent Canadian females. BMC Public Health. 2009;9:401.
27. Suárez E, Smith JS, Bosch FX, Nieminen P, Chen CJ, Torvinen S, et al. Cost-effectiveness of vaccination against cervical cancer: a multi-regional analysis assessing the impact of vaccine characteristics and alternative vaccination scenarios. Vaccine. 2008;26 Suppl 5:F29-45.
28. Jumaan A, LaMontagne D, Winkler J, Levin C, Ramos I. Vacuna contra el VPH en el Perú: Resumen de la experiencia y evaluación del proyecto piloto de la vacuna contra el VPH en el Perú. Lima: PATH-MINSA; 2009.
29. Paz S, Lee F, Carcamo C, Holmes K, Garnett G, Garcia P. Who is getting Pap smears in urban Peru?. Int J Epidemiol. 2008;37(4):862-9.
30. Goldie SJ, Diaz M, Constenla D, Alvis N, Andrus JK, Kim SY. Mathematical models of cervical cancer prevention in Latin America and the Caribbean. Vaccine. 2008;26 Suppl 11:L59-72.
31. Almonte M, Ferreccio C, Winkler JL, Cuzick J, Tsu V, Robles S, et al. Cervical screening by visual inspection, HPV testing, liquid-based and conventional cytology in Amazonian Peru. Int J Cancer. 2007;121(4):796-802.
32. El Banco Mundial [Internet]. Washington, DC: El Banco Mundial; c2011 [citado el 15 de julio del 2011]. Disponible en: http://datos.bancomundial.org/pais/peru
33. Organización Panamericana de la Salud. Introducción e implementación de nuevas vacunas: Guía práctica. Publicación Científica y Técnica Nº 632. Washington, DC: OPS; 2009.
Correspondencia: Dr. Alfonso Gutiérrez-Aguado
Dirección: Av. Alfredo Mendiola 6232, Lima 39, Perú.
Teléfono: (511) 2024342
Correo electrónico: agutierreza@ucvlima.edu.pe; alfonso2805@gmail.com
Recibido: 17-08-11
Aprobado: 14-09-11