Rufino Cabrera
Carlos A. Álvarez
Irene Uribe-Vilca
Silvia Guerrero-Quincho
Jenny Ancca-Juárez
Bryan Cabrera-Campos
Adela Celis-Trujillo
Margarita Zuñiga-Saca
Miguel Bernal-Fiestas
Richard Oriundo-Palomino
10.17843/rpmesp.2021.381.6286
ORIGINAL BREVE
Características clínicas y epidemiológicas de casos de enfermedad de Chagas aguda en la cuenca amazónica peruana, 2009-2016
Clinical and epidemiological characteristics of cases of acute Chagas disease in the peruvian amazon basin, 2009-2016.
Silvia Vega ![]() 1, Bióloga
1, Bióloga
Rufino
Cabrera ![]() 2,3, biólogo
2,3, biólogo
Carlos A.
Álvarez ![]() 4, médico epidemiólogo
4, médico epidemiólogo
Irene
Uribe-Vilca ![]() 5, licenciada en Enfermería
5, licenciada en Enfermería
Silvia
Guerrero-Quincho ![]() 6, Bióloga
6, Bióloga
Jenny
Ancca-Juárez ![]() 1, Bióloga
1, Bióloga
Bryan
Cabrera-Campos ![]() 1, bachiller en Genética y
Biotecnología
1, bachiller en Genética y
Biotecnología
Adela
Celis-Trujillo ![]() 7, licenciada en Enfermería
7, licenciada en Enfermería
Margarita
Zuñiga-Saca ![]() 8,Bióloga
8,Bióloga
Miguel
Bernal-Fiestas ![]() 9, biólogo
9, biólogo
Richard
Oriundo-Palomino ![]() 10, biólogo microbiólogo
10, biólogo microbiólogo
1 Laboratorio de Chagas, Centro Nacional de Salud Pública, Instituto
Nacional de Salud, Lima, Perú.
2 Centro Nacional de Epidemiología, Prevención y Control de
Enfermedades, Ministerio de Salud, Lima, Perú.
3 Escuela de Medicina, Universidad Peruana de Ciencias de la Salud,
Lima, Perú.
4 Dirección Regional de Salud Loreto, Iquitos, Perú.
5 Red de Salud San Francisco, Dirección Regional de Salud Ayacucho,
San Francisco, La Mar, Perú.
6 Laboratorio de Referencia Regional, Dirección Regional de Salud
Ayacucho, Huamanga, Perú.
7 Dirección Regional de Salud Huánuco, Huánuco, Perú.
8 Laboratorio de Referencia Regional, Dirección Regional de Salud
Huánuco, Huánuco, Perú.
9 Red de Salud Condorcanqui, Dirección Regional de Salud Amazonas,
Perú.
10 Centro de Salud Santa Rosa, Red de Salud San Francisco, Dirección
Regional de Salud Ayacucho, Ayacucho, Perú.
RESUMEN
Los casos de la enfermedad de Chagas aguda (ECA) se reportan en forma esporádica en el Perú. En este artículo se describe las características clínicas y epidemiológicas de ocho nuevos casos de ECA detectados por el sistema de vigilancia en la cuenca amazónica, entre 2009 y 2016. La media de la edad fue 12,7 ± 13,7 años, rango de 1 a 44 años y 4/8 casos fueron varones. Un caso se asoció a enfermedad diarreica aguda, otro a leptospirosis y dos a infección del tracto urinario. La tasa de letalidad global fue 12,5% (1/8). La detección tardía es una característica frecuente relacionada a una escasa sospecha diagnóstica en pacientes con historial de fiebre. Se identificó el linaje TcI y TcIV del agente etiológico de la enfermedad de Chagas. Se reporta ocho nuevos casos de ECA, de los cuales siete fueron menores de edad.
Palabras clave: Enfermedades Transmitidas por Vectores; Enfermedades Desatendidas; Enfermedad de Chagas; Informes de Casos; Leptospirosis; Fiebre; Coinfección; Perú (fuente: DeCS BIREME).
ABSTRACT
Acute Chagas disease (ACD) cases are reported sporadically in Peru. In this report we describe the clinical and epidemiological characteristics of eight new ACD cases detected by the surveillance system in the Amazon basin, between 2009 and 2016. The average age was 12,7 ±13.7 years, range between 1 to 44 years and 4/8 cases were men. One case was associated with acute diarrheal disease, another with Leptospirosis, and two with urinary tract infection. The global case fatality-rate was 12.5% (1/8). Late detection is a frequent characteristic related with low diagnostic suspicion in patients with a history of fever. The TcI and TcIV lineage was identified as the etiological agent of Chagas disease. Eight new cases of ACDs are reported, of which seven were children.
Keywords: Vector Borne Diseases; Neglected Diseases; Chagas Disease; Case Reports; Leptospirosis; Fever; Coinfection; Peru (source: MeSH NLM).
INTRODUCCIÓN
La enfermedad de Chagas es causada por Trypanosoma cruzi, trasmitida por triatominos hematófagos infectados con el parásito, transfusión sanguínea, vía congénita, alimentos o bebidas contaminadas y por otras formas (1). Tiene una fase aguda y otra crónica. Las personas infectadas en la fase aguda pueden presentar síntomas como fiebre, chagoma de inoculación, malestar general, hepatoesplenomegalia y linfadenopatía (1,2) y el 95% son asintomáticos (2). El diagnóstico de esta fase se basa en la demostración del parásito en los exámenes directos de gota gruesa o microconcentración (1-2).
En el Perú, entre el 2006 y el 2010, se había reportado siete casos de enfermedad de Chagas aguda (ECA), uno en el distrito de Pevas y los otros seis en distritos de la provincia de Datem del Marañón, departamento de Loreto (3,4); dos de ellos estaban relacionados, por lo que la infección podría deberse a una fuente común (brote) (4). Los reportes de ECA en los últimos 20 años han sido esporádicos (4). A pesar de ser de notificación obligatoria (5), existen escasas descripciones clínicas y epidemiológicas. Uno de los objetivos de la vigilancia es detectar los casos agudos e investigar la forma de transmisión para su tratamiento oportuno (5).
El objetivo de este reporte es describir las características clínicas y epidemiológicas de ocho casos de enfermedad de Chagas aguda en la Amazonía peruana, detectadas entre 2009 y 2016.
|
MENSAJES CLAVE |
|
Motivación para realizar el estudio: Existe limitada información sobre las características clínicas y epidemiológicas de los pacientes con enfermedad de Chagas aguda (ECA) en el Perú. Principales hallazgos: La mayoría de los casos fueron niños o niñas menores de 11 años, tres tuvieron, además, otra enfermedad. El diagnóstico es tardío. La fiebre y el malestar general se presentó en todos. Tres casos de ECA proceden de Loreto y dos de Ayacucho. Una niña de cuatro meses murió debido a la enfermedad. Implicancias: En los febriles, principalmente, de áreas rurales de la Amazonía peruana, se debe sospechar de la enfermedad de Chagas. |
EL ESTUDIO
Se realizó un estudio de serie de casos, mediante revisión de historias clínicas y fichas clínico-epidemiológicas de los casos confirmados por el Instituto Nacional de Salud (INS) del Perú y reportados al sistema de vigilancia epidemiológica, entre 2009 y 2016. Los casos de ECA se identificaron mediante la definición de caso probable —paciente con fiebre como síntoma principal, con al menos uno de los siguientes sintomas: hepato-esplenomegalia, adenomegalia, chagoma, signo de Romaña, malestar general, rash, meningoencefalitis, miocarditis, miocardiopatía (5), que proceda de la cuenca amazónica— y se confirmaron por la demostración del parásito.
La información se obtuvo mediante: a) entrevistas a los casos o familiares (3,4,5); b) estudios parasitológicos: examen directo, microcentración y hemocultivo (6); c) identificación de Trypanosoma cruzi por PCR convencional con la amplificación de una secuencia de ADN satélite nuclear de 188 pb y de un fragmento de 330 pb derivado de la región variable de los minicírculos (7,8); d) las unidades discretas de tipificación (UDT) fueron identificadas mediante amplificación de tres regiones: intergénica del gen miniexon, del dominio variable del gen codificante para el ARNr 18S y del dominio divergente D7 del gen codificante para el ARNr 24S (9), la nomenclatura siguió la recomendación descrita por Zingales et al (10); e) encuestas serológicas a los colaterales familiares o comunitarios para la detección de anticuerpos IgG anti T. cruzi por inmunofluorescencia indirecta, ELISA e inmunoblot (3,6) (Figura 1) y f) investigación entomológica (3).
Figura 1. Flujograma en la detección de los casos de enfermedad de Chagas aguda e investigación epidemiológica (2009-2016).
Las variables demográficas, clínicas y epidemiológicas se muestran en la Tabla 1. La media de la edad (años) de los casos y del tiempo entre inicio de síntomas y diagnóstico parasitológico en días fue calculada con el programa MS-Excel.
Tabla 1. Características demográficas, clínicas y epidemiológicas de los casos de enfermedad de Chagas aguda en el Perú (2009-2016).
UDT: Unidades Discretas de Tipificación
PCR: Reacción en cadena de polimerasa
Los datos se recogieron durante la vigilancia epidemiológica de la ECA en el Perú (5). Los datos de los pacientes se han omitido para evitar su identificación.
HALLAZGOS
La media de la edad fue 12,7 ± 13,7 años, rango entre 1 a 44 años y 4 casos fueron varones. Un caso de ECA se asoció a enfermedad diarreica aguda (EDA), dos a infección del tracto urinario (ITU) y un tercero a leptospirosis. La letalidad global fue 12,5% (1/8). Entre el 2009 al 2016, tres casos de ECA proceden de Loreto, dos de Ayacucho, uno de Huánuco, uno de San Martín y uno de Amazonas. Los síntomas y/o signos predominantes fueron: fiebre y malestar general (8/8), chagoma de inoculación (4/8) y signo de Romaña (3/8). Todos fueron positivos a los exámenes parasitológicos (Tabla 1).
Caso 1
Varón de 15 años, residente en una comunidad a una hora de distancia por vía fluvial de Puerto Inca (Tabla 1). En su primera admisión fue diagnosticado de infección del tracto urinario (ITU) y síndrome febril. Por persistencia de los síntomas fue transferido al Hospital Regional de Pucallpa, donde se informó gota gruesa positiva a Plasmodium falciparum, además, presentó náuseas, vómitos y dos episodios de epistaxis. El examen de orina mostró turbidez, hematíes (0 -1/campo), leucocitos (2- 4/campo) y bacterias. Inició tratamiento para malaria e ITU. Los controles parasitológicos fueron negativos los primeros tres días. Ninguno de los familiares fue positivo a Plasmodium y no se encontraron Anopheles en la vivienda. El control de calidad de la gota gruesa en el Laboratorio de Referencia Regional de Ucayali reportó positivo a T. cruzi. La seroprevalencia de infección por T. cruzi entre los colaterales familiares y comunitarios fue 1,5% (1/65) (Figura 1). No refirió transfusión sanguínea. Se informó que el paciente dormía sin mosquitero en un ambiente con techo de hojas de palma cuidando una granja de cerdos. En el gallinero se encontraron ninfas de triatominos hematófagos (Figura 1). Recibió tratamiento con nifurtimox (10 mg/kg de peso por día durante 60 días) (11) (Tabla 1).
Caso 2
Lactante de 0,3 años, hija de una adolescente de 17 años que laboraba en una ladrillera, residente en una comunidad a una altitud de 700 msnm (selva alta) (Tabla 1). Acudió al centro de salud de Santa Rosa, departamento de Ayacucho por presentar fiebre hace una semana. Se le diagnosticó ITU y recibió tratamiento. Debido a su estado irritable y persistencia de fiebre fue atendida por emergencia. La gota gruesa para Plasmodium y el frotis para Bartonella fueron negativos, pero se observaron trypomastigotes de Trypanosoma. Fue referida al Hospital de Apoyo de San Francisco para su confirmación y recibir tratamiento. A su ingreso presentó 37 ºC de temperatura, pulso de 122/min, respiraciones de 60/min y saturación de oxígeno de 95%. En la anamnesis presentó mal estado general, tiraje subcostal, aleteo nasal, irritabilidad, anuria, respiración rápida, piel seca, evidencia de taquicardia y rigidez de nuca. Se agregó distrés respiratorio, cianosis distal y se observó un diámetro pupilar de 1,5 cm en ambos lados. La concentración de hemoglobina fue de 8,9 mg/dL. La radiografía mostró cardiomegalia. Se produjo falla multiorgánica y falleció. Se confirmó T. cruzi en la gota gruesa. El diagnóstico fue meningoencefalitis por enfermedad de Chagas. No tenía antecedentes de transfusión sanguínea. La madre refirió una lesión papular eritematosa (chagoma de inoculación) de 2 x 2 cm2 en el tercio medio de la cara media del muslo derecho por la posible picadura de un triatomino, una semana antes del inicio de los síntomas. El padre resultó seropositivo a anticuerpos contra T. cruzi (Figura 1).
Caso 3
Varón de un año que reside en una comunidad a tres horas del distrito de Mazán, departamento de Loreto. Acudió al establecimiento de salud, por presentar episodios de EDA acuosa y fiebre (Tabla 1). La gota gruesa fue negativa a Plasmodium y el control de calidad en el Laboratorio de Referencia Regional de Loreto, informó la presencia de T. cruzi. Los padres manifestaron historia de fiebre durante casi tres meses desde el inicio de síntomas. También refirieron que el menor era llevado al campo de cultivo, a actividades de maderería y pesca dentro de su comunidad junto a su familia. Ningún miembro familiar fue positivo a T. cruzi (Figura 1). No hay antecedentes de transfusión. Fue trasladado al Hospital de Apoyo de Iquitos, donde el diagnóstico fue ECA y recibió nifurtimox (11) (Tabla 1).
Caso 4
Mujer de 44 años, residente en una zona urbana del distrito de Morales que se dedicaba a actividades agrícolas en Cacatachi, una zona rural del departamento de San Martín. Refirió que, al quedarse dormida sobre un árbol, sintió prurito facial y olor característico de una chinche. A los dos días de presentar fiebre (Tabla 1), acudió a un consultorio privado. Debido a la persistencia de fiebre fue admitida en el Hospital de Tarapoto, con diagnóstico de dengue, sin signos de alarma. Al persistir el cuadro, acudió a un centro de salud, donde la prueba rápida para dengue fue negativa y la prueba de Widal fue reactiva recibiendo tratamiento para fiebre tifoidea. Debido a la persistencia de la fiebre fue atendida en el Hospital Nacional Arzobispo Loayza en Lima con diagnóstico de síndrome febril, asociado en los últimos tres días a edema facial y de miembros inferiores, aparición de rash en cara, tórax y piernas; además, tos con rasgos hemoptoicos y epistaxis, por lo que es hospitalizada. El hemograma, perfil hepático, perfil renal, radiografía de tórax y ecografía abdominal fueron normales.
El INS informó gota gruesa positiva a T. cruzi, positivo para detección de anticuerpos IgG contra T. cruzi (Tabla 1). Asimismo, presentó IgM y microaglutinación (MAT) positivos contra Leptospira e IgG positiva para el virus dengue. La evaluación cardiológica reveló escaso derrame pericárdico (100 mL) y el electrocardiograma y las enzimas cardiacas fueron normales, descartando miocarditis. Los colaterales familiares fueron seronegativos para T. cruzi (Figura 1). Se informó que la paciente cría animales en su vivienda y ocasionalmente consume jugos. Recibió nifurtimox para la enfermedad de Chagas (Tabla 1) y doxiciclina por vía oral para leptospirosis.
Casos 5, 6, 7 y 8
El caso 5 (varón de 6 años) fue admitido en el Centro de Salud de Saramiriza (Loreto), por presentar fiebre, tos, ganglios inflamados y otros síntomas (Tabla 1). En la lámina de gota gruesa tomada para malaria se observaron formas sanguíneas de T. cruzi (Figura 2). Refirió haber visto «chinches» en su casa. El caso 6 (mujer de 5 años) provino de una comunidad a 15 minutos de Sivia (Ayacucho). Acudió al hospital local por presentar fiebre, pérdida del apetito, entre otros síntomas. El hemograma mostró una hemoglobina de 10,8 mg/dL y hallazgo de T. cruzi en la lámina de gota gruesa. El caso 7 (varón de 8 años) acudió a un puesto de salud por presentar fiebre, disminución de apetito, entre otros síntomas y signos (Tabla 1), con sospecha diagnóstica de dengue sin signos de alarma. Debido a la persistencia del cuadro acudió a un hospital de EsSalud (Seguro Social) de Iquitos, con temperatura de 40 ºC, frecuencia respiratoria de 110/min y saturación de oxígeno de 98%. Al examen físico se percibió ruidos rítmicos sin soplo, y evidencia de hepatomegalia. En la evaluación neurológica no tenía evidencia de signos meníngeos. Tuvo hemograma normal y recibió tratamiento. Otros datos de los casos 5, 6, 7 y 8 se muestran en la Tabla 1 y en la Figura 3.
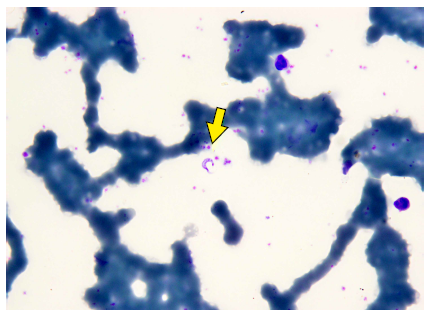
Figura 2. Trypomastigote sanguíneo de Trypanosoma cruzi en una lámina de gota gruesa coloreada con giemsa a 1000 X del caso 5 (la flecha amarilla indica el parásito).

Figura 3. Vivienda del caso 8 en la comunidad nativa Yahuahua, Nieva, departamento de Amazonas.
DISCUSIÓN
En esta serie se identificaron ocho casos de ECA, los síntomas y signos más frecuentes fueron fiebre y malestar general, los menos frecuentes fueron chagoma de inoculación, signo de Romaña, mialgia, hepatomegalia, esplenomegalia, meningoencefalitis, edema de extremidades bajas y rash. Éstos son similares a los encontrados en una serie en niños de comunidades nativas de Loreto (Perú), en cuanto a la fiebre, mialgia y esplenomegalia, pero difiere en la hepatomegalia, edema de extremidades bajas y malestar general (4). Estas diferencias podrían ser explicadas por el recojo incompleto de los datos en este estudio y probablemente, por el linaje del parásito. El signo de Romaña y el chagoma de inoculación, también fueron infrecuentes en las series de ECA en Brasil (12) y Colombia (13).
En seis casos de este reporte se observó fiebre por más de una semana, tal como se ha descrito previamente (3-5,14-16). Solo el caso 4, a pesar de presentar coinfección con Leptospira, presenta una similitud con el patrón clínico de la transmisión oral de ECA por ser un adulto. Generalmente, los casos de ECA por transmisión vectorial son niños (1). Además, se observó edema de miembros inferiores y rash, que es más frecuente en la transmisión oral (12). Más del 57% y el 27% de los 233 casos de ECA de la Amazonía brasilera presentaron edema de miembros y cara, y rash, respectivamente (12). El edema y el rash en leptospirosis son infrecuentes (17). Una característica de los casos de ECA por transmisión oral es la presentación infrecuente de los signos de puerta de entrada (12) o la ausencia de ella. En esta serie, 5 de 8 casos tienen puertas de entrada y en la investigación epidemiológica del caso 1, no se evidencia antecedente de transmisión oral; por ello, 6 de 8 casos probablemente son de transmisión vectorial.
Es probable que el primer caso de ECA adquirió dengue en Puerto Inca, ya que además de fiebre, presentó signos de alarma (vómitos y sangrado). En ese momento la incidencia de dengue era más de 30 casos/100 mil habitantes (18). Uno de los casos de ECA fue diagnosticado erróneamente como malaria por P. falciparum, en dos casos se sospechó de fiebre tifoidea, uno se asoció a EDA y otro se asoció a leptospirosis. Es necesario fortalecer el reconocimiento de T. cruzi ante el diagnóstico erróneo de Plasmodium en el nivel local (3,4,14), incorporándolo al Plan Malaria Cero (19). Asimismo, en dos casos se confirmó ITU. Igual que en un caso de ECA reportado en la selva central que inicialmente tuvo la sospecha de ITU (15).
El tiempo desde el inicio de los síntomas hasta la confirmación parasitológica tiene una media de 27,4 días. Esto podría deberse a que la enfermedad de Chagas en zonas de trasmisión esporádica o activa no es una opción diagnóstica en los febriles; asimismo, algunos microscopistas en el primer nivel no reconocen al parásito en las láminas de gota gruesa. También, podría explicarse por la baja sensibilidad de la técnica, que varía según la fecha de obtención de la muestra en relación con el inicio de la infección y la demora de acceso a los servicios de salud, 2 a 23 días después de iniciados los síntomas. La media del tiempo de diagnóstico de ECA en esta serie es más baja que la descrita en niños de comunidades nativas de Perú (4).
En esta serie, la letalidad global fue 12,5%. La única defunción probablemente esté asociada a una miocarditis chagásica y ocurrió rápidamente —nueve días desde el inicio de los síntomas— , tal como está descrito (1). La detección tardía podría ser un factor de riesgo para morir en niños nativos amazónicos (4).
Existe una tendencia al incremento en el número de casos de ECA reportados en Perú, similar a lo descrito en otros países amazónicos (20); además, de la existencia de un subregistro. La seroprevalencia para anticuerpos IgG contra T. cruzi entre los colaterales fue superior a 1%; sin embargo, la muestra no es representativa y no ha sido seleccionada en forma aleatoria.
Dos casos de ECA tienen como agente etiológico al linaje TcI y otros dos a TcIV. El primero está asociado a reservorios silvestres como roedores, didélfidos y a vectores silvestres como Rhodnius, Panstrongylus y el segundo, es un agente esporádico de la enfermedad de Chagas (21). Es la primera vez, que se identifica el linaje de T. cruzi en los casos de ECA en las áreas de la Amazonía donde fueron detectados. Se ha descrito que TcI infecta a P. geniculatus, un vector silvestre y TcIV circula en P. herrreri (22).
Entre las limitaciones de este estudio se debe mencionar que no se logró acceder a todas las historias clínicas y fichas clínico-epidemiológicas de los casos; además, las entrevistas en algunos pacientes se realizaron varios días/semanas después de la fecha de inicio de síntomas, lo que pudo ocasionar cierto sesgo de memoria. Asimismo, en esta serie no se incluyen los resultados de los vectores.
Se reporta ocho nuevos casos de ECA en la Amazonía peruana, asociados en su mayoría a otras coinfecciones. Los distritos de Santa Rosa y Sivia (Ayacucho), serían nuevas zonas de trasmisión activa, en los que podrían estar involucrados vectores de hábitos silvestres.
Agradecimiento: Al Dr. Mario Grandez-Armas del Hospital Nacional Arzobispo Loayza y al Dr. Omar Rodríguez por participar en la identificación o seguimiento de algunos de los casos que se presenta en esta serie.
REFERENCIAS BIBLIOGRÁFICAS
1. Pérez-Molina JA, Molina I. Chagas disease. Lancet. 2018;391(10115):82-94. doi: 10.1016/S0140-6736(17)31612-4.
2. Teixeira AR, Nitz N, Guimaro MC, Gomes C, Santos-Buch CA. Chagas disease. Postgrad Med J. 2006;82(974):788-98. doi: 10.1136/pgmj.2006.047357.
3. Cabrera R, Vega S, Cáceres AG, Ramal CA, Álvarez C, Ladera P, et al. Epidemiological investigation of an acute case of Chagas disease in an area of active transmission in Peruvian Amazon region. Rev Inst Med Trop. São Paulo 2010; 52:269-272.
4. Cabrera R, Vega S, Valderrama Y, Cabanillas CK, Fernández C, Rodríguez O, et al. New focus of active transmission of Chagas disease in indigenous populations in Peruvian Amazon Basin. Rev Soc Bras Med Trop. 2013;46(3):367-72. doi: 10.1590/0037-8682-1195-2013.
5. Cabrera CR. Enfermedad de Chagas o Trypanosomiasis Americana. En: Suárez OL, Beingolea ML, Nakamoto TI, Cabrera CR, eds. Protocolos de vigilancia epidemiológica. Parte I. Segunda edición. Lima: Dirección General de Epidemiología, Ministerio de Salud. 89-114; 2006.
6. Vega CS. Manual de procedimientos de laboratorio para el diagnóstico de la trypanosomiasis americana (enfermedad de Chagas). Lima: Instituto Nacional de Salud; 1999. Serie de Normas Técnicas Nº 26.
7. Moser DR, Kirchhoff LV, Donelson JE. Detection of Trypanosoma cruzi by DNA amplification using the polymerase chain reaction. J Clin Microbiol. 1989;27(7):1477-1482. doi:10.1128/JCM.27.7.1477-1482.1989.
8. Vallejo GA, Guhl F, Chiari E, Macedo AM. Species specific detection of Trypanosoma cruzi and Trypanosoma rangeli in vector and mammalian hosts by polymerase chain reaction amplification of kinetoplast minicircle DNA. Acta Trop. 1999;72(2):203-12. doi: 10.1016/s0001-706x(98)00085-0.
9. Brisse S, Verhoef J, Tibayrenc M. Characterisation of large and small subunit rRNA and mini-exon genes further supports the distinction of six Trypanosoma cruzi lineages. Int J Parasitol. 2001;31(11):1218‐1226. doi:10.1016/s0020-7519(01)00238-7.
10. Zingales B, Andrade SG, Briones MR, Campbell DA, Chiari E, Fernandes O, et al. Second Satellite Meeting. A new consensus for Trypanosoma cruzi intraspecific nomenclature: second revision meeting recommends TcI to TcVI. Mem Inst Oswaldo Cruz. 2009;104(7):1051-4. doi: 10.1590/s0074-02762009000700021.
11. Ministerio de Salud. Doctrina, normas y procedimientos para el control de la Tripanosomiasis o enfermedad de Chagas en el Perú. Lima: Dirección General de Salud de las Personas, MINSA; 1998.
12. Pinto AYN, Valente SAS, Valente VC, Ferreira GAJR, Rogrigues CJ. Fase aguda da doença de Chagas na Amazônia brasileira. Estudo de 233 casos do Pará, Amapá e Maranhão observados entre 1988 e 2005. Rev Soc Bras Med Trop. 2008;41:602-14.
13. Nichols RS, Cucunubá ZM, Knudson A, Flores AC, Montilla M. Enfermedad de Chagas aguda en Colombia, una entidad poco sospechada. Informe de 10 casos presentados en el periodo 2002 a 2005. Biomédica.2007;27(Supl.1):8-17.
14. Asayag CR, Garay CR, Sanchez GM, Angeles CC, Baca CJ, Evans C, et al. Eight year old with fever, hepatomegaly and positive thick smear. Am J Trop Med Hyg. 2008;79:473.
15. Vega S, Mendoza A, Cabrera R, Cáceres GA, Campos E, Ancca J, et al. Primer caso de enfermedad de Chagas aguda en la selva central del Perú: Investigación de colaterales, vectores y reservorios. Rev Peru Med Exp Salud Pública 2006; 23(4):288-292.
16. Lumbreras H, Arrarte J, Guevara B. Primeros casos de la enfermedad de Chagas en el Departamento de San Martín. Rev Med Per. 1955; 26:42-47.
17. Toyokawa T, Ohnishi M, Koizumi N. Diagnosis of acute leptospirosis. Expert Rev Anti Infect Ther. 2011;9(1):111-21. doi: 10.1586/eri.10.151.
18. Ministerio de Salud. Sala de situación de salud. Semana epidemiológica Nº 41– 2014. [Internet]. Lima: Dirección General de Epidemiología, MINSA; 2014 (citado el 26 de mayo de 2020). Disponible en: https://www.dge.gob.pe/portal/index.php?option=com_content&view=article&id=44.
19. Cabrera R, Valderrama Y, Meza JR. Percepción sobre la enfermedad de Chagas y el riesgo de transmisión oral en Andoas, Loreto, Perú. Rev Peru Med Exp Salud Publica. 2019;37(1):174-5. Doi: https://doi.org/10.17843/rpmesp.2020.371.4875.
20. Andrade DV, Gollob KJ, Dutra WO. Acute hagas disease: new global challenges for an old neglected disease. PloS Negl Trop Dis. 2014;8(7):e3010. doi: 10.1371/journal.pntd.0003010.
21. Zingales B, Miles MA, Campbell DA, Tibayrenc M, Macedo AM, Teixeira MM, et al. The revised Trypanosoma cruzi subspecific nomenclature: rationale, epidemiological relevance and research applications. Infect Genet Evol. 2012;12(2):240-53. doi: 10.1016/j.meegid.2011.12.009.
22. Padilla CP, Alvarado U, Ventura G, Luna-Caipo D, Suárez M, Tuñoque JR, et al. Detección de unidades discretas de tipificación de Trypanosoma cruzi en triatominos recolectados en diferentes regiones naturales de Perú. Biomédica. 2017;37(Supl.2):167-79. doi: https://doi.org/10.7705/biomedica.v34i2.3559.
Financiamiento: Instituto Nacional de Salud de Perú, Centro Nacional de Epidemiología, Prevención y Control de Enfermedades (CDC), Ministerio de Salud, Dirección Regional de Salud de Loreto, Dirección Regional de Salud de Huánuco, Dirección Regional de Salud de Ayacucho y Dirección Regional de Salud de Amazonas.
Citar como:Vega S, Cabrera R, Álvarez CA, Uribe-Vilca I, Guerrero-Quincho S, Ancca-Juárez J, et al. Características clínicas y epidemiológicas de casos de enfermedad de Chagas aguda en la cuenca amazónica peruana, 2009-2016. Rev Peru Med Exp Salud Publica. 2021;38(1):70-6. doi: https://doi.org/10.17843/rpmesp.2021.381.6286.
Correspondencia: Silvia Vega; Laboratorio de Chagas, Centro Nacional de Salud Pública, Instituto Nacional de Salud, Jr. Cápac Yupanqui 1400, Jesús María, Lima, Perú; svega@ins.gob.pe.
Contribuciones de los autores: SV y RC concibieron la idea del artículo, participaron en la investigación de los casos, recogida de los datos, redacción y aprobación de la versión de sometimiento. CAA, IUV y ACT participaron en la investigación de los casos, recogida de los datos, redacción y aprobación de la versión de sometimiento. JAJ y BCC, participaron en la identificación de los linajes del parásito, redacción y aprobación de la versión de sometimiento. SGQ, MZS, MBF y ROP participaron en la investigación de los casos, redacción y aprobación de la versión de sometimiento.
Conflicto de interés: Los autores declaran no tener conflicto de interés.
Recibido: 05/08/2020
Aprobado: 20/01/2021
En Línea: 16/02/2021