Stefany Fiorella Infante Varillas
Carlos Ignacio Reyes-Farias
Cesar Enrique Ladines Fajardo
Edgar Gonzales Escalante
Original breve
Β-lactamasas de espectro extendido y factores de virulencia en Escherichia coli uropatógenas en asilos de ancianos en Lima, Perú
Extended-spectrum β-lactamases and virulence factors in uropathogenic escherichia coli in nursing homes in Lima, Peru
Arturo Octavio Gonzales-Rodriguez ![]() 1,
Magíster en Bioquímica
1,
Magíster en Bioquímica
Stefany Fiorella Infante Varillas ![]() 1, magíster en Investigación
Biomédica
1, magíster en Investigación
Biomédica
Carlos Ignacio Reyes-Farias ![]() 1, estudiante de Medicina Humana
1, estudiante de Medicina Humana
Cesar Enrique Ladines Fajardo ![]() 1, estudiante de Medicina Humana
1, estudiante de Medicina Humana
Edgar Gonzales Escalante ![]() 2, magíster en Microbiología
2, magíster en Microbiología
1 Facultad de Medicina Humana, Universidad de Piura, Lima, Perú.
2 Instituto de Investigaciones en Bacteriología y Virología Molecular (IBaViM), Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires, Buenos Aires, Argentina.
RESUMEN
Los asilos de ancianos son instituciones con una alta prevalencia de infecciones del tracto urinario ocasionado por Escherichia coli productoras de ß-lactamasas de espectro extendido (BLEE), con diversos factores de virulencia. El objetivo del estudio fue determinar la frecuencia del gen blaCTX-M y de ocho genes de virulencia en 35 E. coli uropatógenas productoras de BLEE provenientes de seis asilos en Perú, durante el 2018. El 57,1% (20/35) de las E. coli fueron portadores del gen blaCTX-M. Además, se obtuvo una frecuencia del 46% (15/35) y 37% (13/35) de hly-alfa y cnf-1, respectivamente; elevada presencia de los genes iucC (63%, 22/35), aer (94%, 33/35) y chuA (94%, 33/34) y una frecuencia del 46% (16/35) y del 91% (32/34) de los genes pap GII y nanA, respectivamente. Existe predominancia en la distribución del gen blaCTX-M, además de una alta frecuencia de exotoxinas que le confieren una ventaja competitiva para diseminarse hacia el torrente sanguíneo.
Palabras clave: Infecciones urinarias; Antibacterianos; Resistencia Betalactámica; Infecciones por Enterobacteriaceae; Asilos de Ancianos; Escherichia coli Uropatogénica; Factores de Virulencia; Infecciones Urinarias, ß-lactamasas (fuente: DeCS BIREME).
ABSTRACT
Nursing homes are institutions with high prevalence of urinary tract infections caused by ESBL-producing E. coli with several virulence factors. The aim of this study was to determine the frequency of the blaCTX-M gene and eight virulence genes in 35 ESBL-producing uropathogenic E. coli from six nursing homes in Peru during 2018. Of the E. coli samples, 57.1% (20/35) were carriers of the blaCTX-M gene. Furthermore, we obtained frequencies of 46% (15/35) and 37% (13/35) for hly-alpha and cnf-1, respectively; we also found high presence of the iucC (63%, 22/35), aer (94%, 33/35) and chuA genes (94%, 33/34) as well as a frequency of 46% (16/35) and 91% (32/34) for the pap GII and nanA genes, respectively. The blaCTX-M gene is predominant and a high frequency of exotoxins gives it a competitive advantage for spreading into the bloodstream.
Keywords: Urinary infections; Antibacterials; Beta-Lactam Resistance; Enterobacteriaceae Infections; Nursing Homes; Uropathogenic Escherichia coli; Virulence Factors; Urinary Tract Infections, ß-lactamases (source: MeSH NLM).
INTRODUCCIÓN
Los asilos de ancianos son instituciones de cuidado de largo plazo con una alta prevalencia de enfermedades infecciosas (1); la infección del tracto urinario (ITU), cuyo principal agente etiológico es Escherichia coli, es la infección más frecuente en este tipo de instituciones (1). Asimismo, entre el 20 a 40% de las bacteriemias en ancianos es ocasionada por bacterias que ascienden por el tracto urinario; E. coli y Proteus mirabilis son los agentes microbianos más comunes (2).
Los residentes de asilos de ancianos presentan una alta probabilidad de colonización y de infecciones por E. coli multidrogorresistentes (3). Además, la alta recurrencia de ITU y el tratamiento inapropiado de bacteriurias asintomáticas incrementa el uso de antibióticos, lo que conlleva a la selección de este tipo de bacterias (1), con un aumento de la tasa de mortalidad de los residentes (2).
Los antibióticos del grupo ß-lactámico representan aproximadamente el 50% de los antibióticos prescritos en el mundo (4); sin embargo, su eficiencia terapéutica ha disminuido debido a la rápida selección de mecanismos de resistencia. Las ß-lactamasas de espectro extendido (BLEE) representan el mecanismo más importante para la resistencia a cefalosporinas de tercera generación en E. coli. La enzima denominada CTX-M es la BLEE de mayor predominancia a nivel global debido a su alta eficiencia de propagación desplazando a ß-lactamasas del tipo SHV y TEM en la epidemiología global (4). La CTX-M tiene un linaje heterogéneo que incluye seis grupos (CTX-M-1, CTX-M-2, CTX-M-8, CTX-M-9, CTX-M-25 y KLUC) que difieren entre sí por una cantidad mayor o igual al 10% de residuos aminoacídicos (4). En el Perú existe una alta frecuencia de E. coli productoras de BLEE; en el 2011, en un programa de vigilancia multinacional en el que se evaluaron once países de América Latina se reportó que el 54,0% de las E. coli eran productoras de BLEE (5).
Por otro lado, aunque la diseminación de BLEE de tipo CTX-M en E. coli uropatógenas (UPEC, por sus siglas en inglés) es un problema global que disminuye las opciones terapéuticas en los pacientes, la severidad de la infección depende de la capacidad patogénica en las UPEC (6). Las UPEC poseen factores de adherencia (p.ej. Pap G II) que le permiten iniciar la infección exitosamente y migrar hacia regiones ascendentes del conducto urinario agravando la condición del paciente (6). Asimismo, las UPEC producen sistemas sideróforos (p.ej. ChuA, Aer) y exotoxinas (p.ej. α-Hly, TcpC, Cnf-1) que, en conjunto, constituyen un sistema proteico que les permiten eludir y/o afectar al sistema inmune en detrimento de la salud del paciente (6). En bacteriemias cuyo punto de origen es una ITU las UPEC requieren de la expresión de proteínas que le permiten adaptarse a las condiciones ambientales del tejido sanguíneo (p.ej. nanA) (7).
A nuestro conocimiento, no se han publicado en Perú estudios relacionados que hayan descrito la frecuencia de las UPEC productoras de BLEE de tipo CTX-M en asilos de ancianos. La población de estos asilos es susceptible a ITU y a tener complicaciones sistémicas; por ello, el objetivo del estudio fue determinar la frecuencia de genes de virulencia y la presencia del gen blaCTX-M en UPEC aisladas en residentes de asilos de ancianos ubicados en Lima Metropolitana.
|
MENSAJES CLAVE |
|
Motivación para realizar el estudio: los asilos de ancianos, por la alta prevalencia de infecciones urinarias debido a Escherichia coli multidrogo resistente y el alto riesgo de generar urosepsis, merecen una especial atención epidemiológica Principales hallazgos: el 57,1% de las E. coli productoras de BLEE fueron portadores del gen blaCTX-M; de los cuales el 70% pertenecieron al gen blaCTX-M-grupo 2. Además, se obtuvo una frecuencia del 46% y 37% de hly-alfa y cnf-1, respectivamente; y, finalmente, una frecuencia del 46% y 91% del gen pap G II y nanA, respectivamente. Implicancias: este es el primer reporte de genes resistentes asociados con BLEE en E. coli uropatógenas identificado en asilos de ancianos en el Perú; lo que tiene gran relevancia por constituir una amenaza para la salud de los adultos mayores. |
EL ESTUDIO
Diseño de estudio y población
Estudio descriptivo observacional realizado en el 2018, en donde se recolectaron de forma aleatoria 35 aislamientos no repetidos de E. coli productoras de BLEE obtenidas de muestras de orina de adultos mayores residentes de seis asilos de ancianos privados de Lima Metropolitana en Perú.
Estudio microbiológico
La identificación bacteriana se realizó por pruebas bioquímicas convencionales (triple sugar iron agar, lysine iron agar, agar citrato, agar movilidad-indol-orinitina y rojo de metilo/Voges-Proskauer) y confirmadas molecularmente, por reacción en cadena de la polimerasa (PCR, por sus siglas en inglés), a través de la amplificación del gen uspA.
Pruebas de susceptibilidad
Las E. coli productoras de BLEE fueron confirmadas por el método de disco difusión especificado en el documento M02-13 del Clinical & Laboratory Standards Institute (CLSI) (8); además, se determinó la susceptibilidad antimicrobiana por el método de disco difusión de acuerdo con los lineamientos del CLSI (8), empleando como control de calidad a la E. coli ATCC 25922. Se incluyeron los discos de antibióticos con los siguientes antibióticos: piperacilina/tazobactam 100/10 µg (PTZ); amoxicilina/ácido clavulánico 20/10 µg (AMC); cefotaxima 30 µg (CTX); ceftazidima 30 µg (CAZ); cefepime 30 µg (FEP); cefoxitina 30 µg (FOX); aztreonam 30 µg (AZM); meropenem 10 µg (MEM); imipenem 10 µg (IMP); amikacina 30 µg (AK); gentamicina 10 µg (GM); ciprofloxacina 5 µg (CIP); nitrofurantoina 300 µg (NIT) y trimetoprim/sulfametoxazol 1,25/23,75 µg (SXT).
Detección de genes de virulencia y resistencia
El ADN bacteriano se extrajo usando DNA Purification kit GeneJetGenomic (ThermoScientific), siguiendo las recomendaciones del fabricante. Se determinó la presencia de ocho genes de virulencia: aer, hly, cnf-1, chuA, TcpC, nanA, pap GII, iucC (9,10) y tres genes de resistencia asociados a BLEE: blaCTX-M, blaSHV y blaTEM(11). Además, se realizó la detección de diferentes grupos de aislados portadores de blaCTX-M (1, 2, 8 y 9) (12). Las condiciones de la PCR fueron llevadas a cabo en un volumen final de 30 μl que contenía 1X del MaximoTaq DNA (GeneON) así como 0,5 uM de cada uno de los cebadores y 1,5 mM de MgCl2. El volumen de ADN incorporado fue de 2,0 μL. El termociclador Labnet, Multigene optimax se programó con los siguientes parámetros: denaturación inicial a 94 °C por tres minutos; denaturación a 94 °C por 30 s; extensión a 72 °C por 30 s; en 30 ciclos de reacción y extensión final a 72 °C durante tres minutos, mediante el termociclador Labnet, Multigene optimax. En la Tabla 1 se muestra la secuencia de cebadores utilizados, el tamaño de los productos de amplificación, la temperatura de hibridación y la referencia del estudio. Los fragmentos de ADN amplificados fueron separados mediante electroforesis en gel de agarosa al 1% durante 50 min a 110 voltios. Finalmente, se usó el buffer de carga Runsafe (GeneON) para su revelado en UV.
Tabla 1. Genes de virulencia y resistencia, características de amplificación.
|
Gen |
Secuencia de cebadores (5' - 3') |
Producto (pb) |
Temperatura de hibridación (°C) |
|
Genes de virulencia |
|
|
|
|
α-hemolysin (α-hly) |
AACAAGGATAAGCACTGTTCTGGCT |
1177 |
63 |
|
ACCATATAAGCGGTCATTCCCGTCA |
|||
|
chuA |
GACGAACCAACGGTCAGGAT |
279 |
55 |
|
TGCCGCCAGTACCAAAGACA |
|||
|
Aerobactin synthesis (aer) |
TACCGGATTGTCATATGCAGACCGT |
602 |
63 |
|
AATATCTTCCTCCAGTCCGGAGA AG |
|||
|
Aerobactin synthesis (iucC) |
CTCGAATTCACTGGGATTTGGTCAACC |
1701 |
62 |
|
CTCTCTAGAATTCCTGAGTTACCAGCC |
|||
|
Cytotoxic necrotizing factor (cnf1) |
AAGATGGAGTTTCCTATGCAGGAG |
498 |
61 |
|
CATTCAGAGTCCTGCC CTCATTATT |
|||
|
P - fimbriae (pap)- alelo II |
GGGATGAGCGGGCCTTTGAT |
190 |
65 |
|
CGGGCCCCCAAGTAACTCG |
|||
|
nanA |
ACCGGTGAGGGGAAATAAAC |
216 |
59 |
|
GGTGAGTACCAGGGCGATTA |
|||
|
tcpC |
GGCAACAATATGTATAATATCCT |
386 |
51 |
|
GCCCAGTCTATTTCTGCTAAAGA |
|||
|
Genes de resistencia |
|
|
|
|
blaSHV |
ATGCGTTATATTCGCCTGTG |
544 |
58 |
|
GTTAGCGTTGCCAGTGCTCG |
|||
|
blaTEM |
ATAAAATTCTTGAAGACGAAA |
1080 |
54 |
|
GACAGTTACCAATGCTTAATC |
|||
|
blaCTX-M |
TTTGCGATGTGCAGTACCACTAA |
865 |
60 |
|
CGATATCGTTGGTGGTGCCAT |
|||
|
blaCTX-M-grupo 1 |
ATGGTTAAAAAATCACTG C |
900 |
55 |
|
GGTGACGATTTTAGCCGC |
|||
|
blaCTX-M-grupo2 |
CGTTAACGGCACGATGAC |
404 |
59 |
|
CGATATCGTTGGTGGTGCCAT |
|||
|
blaCTX-M-grupo8 |
ACGCTCAACACCGCGATC |
490 |
63,3 |
|
CGTGGGTTCTCGGGGATAA |
|||
|
blaCTX-M-grupo9 |
GATTGACCGTATTGGGAGTTT |
831 |
58 |
|
CGGCTGGGTAAAATAGGTCA |
Análisis estadístico
El análisis estadístico se realizó mediante el programa SPSS Statistics for Windows, versión 25.0. Armonk, NY: IBM Corp. La descripción de las variables cualitativas se realizó a través de gráficas de frecuencia.
Consideraciones éticas
El presente estudio obtuvo la aprobación del Comité de Ética de la Facultad de Medicina de la Universidad Nacional Mayor de San Marcos. Acta 1812 con código de proyecto 0013.
HALLAZGOS
Susceptibilidad antimicrobiana
Se analizaron 35 UPEC productoras de BLEE provenientes de asilos de ancianos. La mayoría de los aislamientos fueron resistentes a cefotaxima (25/35), no hubo aislamientos resistentes a carbapenémicos, y solo dos (2/35) aislamientos fueron resistente a cefoxitina. Además de la resistencia a los ß-lactámicos se pudo observar que las cepas de UPEC presentaron amplia resistencia a ciprofloxacina, 82,9% (29/35) de los casos. Asimismo, no se encontraron UPEC resistentes a PTZ, MEM e IMP. En la Figura 1 se detalla las frecuencias de resistencia por antibiótico.
AMC: amoxicilina/ac.clavulánico; CTX: cefotaxima; CAZ: ceftazidima; FEP: cefepime; FOX: cefoxitina; AZM: aztreonam, AK: amikacina; GM: gentamicina; CIP: ciprofloxacina; SXT: sulfametoxazol / trimetoprim; F/M: nitrofurantoína.

Figura 1. Perfil de resistencia a los antimicrobianos de los aislamientos de Escherichia coli productoras de ß-lactamasas de espectro extendido (n=35).
Genotipificación de UPEC productoras de blaCTX-M
De los 35 aislamientos, 57,1% (20/35) fueron portadores del gen blaCTX-M, de los cuales el 70% (14/20) correspondieron al blaCTX-M-grupo 2, 40% (8/20) al blaCTX-M-grupo 1, 30% (6/20) al blaCTX-M-grupo 9 y 20% (4/20) al blaCTX-M-grupo 8. Por otro lado, el 60% (12/20) de las UPEC portadoras del gen blaCTX-M tuvieron dos o más variantes alélicas del gen blaCTX-M en la misma bacteria. Además, hubo un mayor nivel de confluencia entre los genes pertenecientes al blaCTX-M-grupo 1 y blaCTX-M-grupo 2 (Tabla 2). También se evaluó la presencia de otros genes productores de ß-lactamasas (blaSHV y blaTEM) en los productores y no productores de blaCTX-M. De un subestrato de las UPEC analizadas el 48,1% (13/27) no resultaron portadoras del gen blaCTX-M, pero sí a los genes blaSHV, y/o blaTEM . Asimismo, el 51,9% (14/27) de las UPEC presentaron al gen blaCTX-M, además de los genes blaSHV, y/o blaTEM. No se analizó las secuencias nucleotídicas de las variantes alélicas que confirmarían su pertenencia al grupo BLEE.
Tabla 2. Distribución de grupos del gen blaCTX-M en lasEscherichia coli uropatógenas productoras de ß-lactamasas de espectro extendido.

Genotipificación de factores de virulencia en UPEC productoras de BLEE
De las 35 UPEC productores de BLEE se analizaron los genes relacionados con exotoxinas, en los cuales se obtuvo una frecuencia del 46% (15/35) y 37% (13/35) de hly-alfa y cnf-1, respectivamente. En los genes asociados al metabolismo del hierro se observó una elevada presencia de los genes aer, 94% (33/35) y chuA, 94% (33/35). Además, se evaluó la presencia de la adhesina pap GII obteniendo una frecuencia del 46% (16/34) y del gen nanA en el 91% (32/35) (Figura 2).
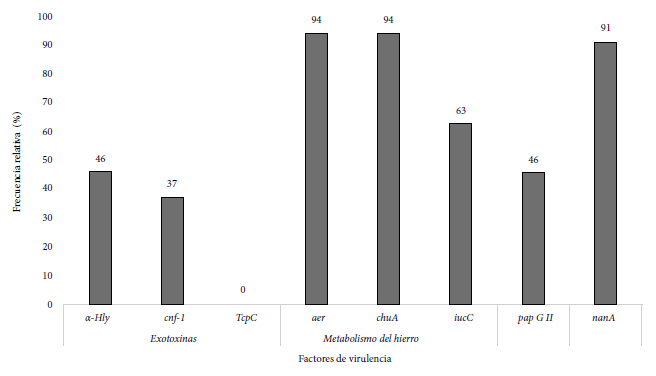
Figura 2. Frecuencia de genes de virulencia en Escherichia coli uropatógenas.
DISCUSIÓN
Los resultados de este estudio estudio muestran que el 57,1% de las Escherichia coli productoras de BLEE presentaron el gen blaCTX-M, siendo el 70% del grupo blaCTX-M-grupo 2. Por otro lado, los genes: hly-alfa y cnf-1, codificantes a exotoxinas, se detectaron con una frecuencia del 46 y 37%, respectivamente.
Los asilos de ancianos son instituciones de larga estancia con una alta prevalencia de ITU ocasionado por bacterias multidrogorresistentes (3). En este estudio, el 57,1% de las UPEC fueron portadoras del gen blaCTX-M. Este resultado es similar a los descritos por Galván et al.(13) y Arce-Gil et al.(11), quienes reportaron una frecuencia del 54,7% y 51,4%. Sin embargo, difieren de los descrito por Ramirez et al.(14) y Chavez (15) en diversos hospitales de Lima (70% y 91,7%). Esto último demuestra la gran variabilidad en la presencia de este gen en las instituciones de salud.
En lo referente a los resultados obtenidos sobre los subgrupos de blaCTX-M, fueron blaCTX-M-grupo 2 (14/20) seguido del blaCTX-M-grupo 1 (8/20) los de mayor presencia. Esto difiere de lo reportado por Chavez (15), en donde no se detectó al blaCTX-M-grupo 2 y el blaCTX-M-grupo 1 (26/33) fue el de mayor frecuencia, y por Palma et al.(16), donde predominó el blaCTX-M-grupo 1 (13/27). Sin embargo, estudios recientes indican que en Sudamérica blaCTX-M-grupo 2 es aún significativo (17) y una reciente revisión en Brasil identifica a los blaCTX-M-grupo 2 y blaCTX-M-grupo 1 como las variantes más prevalentes en la región (18).
También se evaluó la presencia de los genes blaTEM (54,3%) y blaSHV (51,4%); asimismo, se observó la presencia de los genes blaTEM y blaSHV entre las UPEC portadoras del gen blaCTX-M. Vale la pena resaltar que en el 37% de los aislamientos solo se identificó la presencia del gen blaTEM y/o blaSHV, y que, a pesar de que no se determinó su variante alélica y su dominio al grupo BLEE es un fuerte indicador de su pertenencia. Además, no se detectó la presencia de ninguno de los genes de resistencia evaluados en el 5,7% de los aislamientos, lo cual indica la presencia de otros genes de resistencia tipo BLEE no analizados en este estudio.
Con relación con los factores de virulencia, el gen pap GII estuvo presente en el 47,1% de las UPEC. Este resultado difiere de lo reportado por Paniagua-Contreras et al. (19), en México, con un 21,1% de frecuencia del gen pap G II en UPEC comunitarias. También, se observó una alta frecuencia de genes asociación al transporte de hierro, similar a lo reportado por Dadi et.al (20), con 54,5% respecto al gen iucC.
Con relación a las exotoxinas estudiadas, obtuvimos una frecuencia del 44,2 y 38,2% de hly-alfa y cnf-1, respectivamente, resultados comparables al reportado por Dadi et al. (20) con un 50,4 y 29% de hly-alfa y cnf-1, respectivamente. Por otro lado, en este estudio no encontramos UPEC portadoras del gen tcpC, a diferencia de otros trabajos en los que se han reportado prevalencias de hasta el 25% (10).
También encontramos una frecuencia del 88,2% para el gen nanA, el cual es importante en la producción energética. Se ha propuesto que la presencia del gen nanA genera una alta competitividad en las UPEC para generar bacteriemias, aunque su rol en la patogénesis de la ITU es menos importante (6), los resultados indican la existencia de un alto riesgo en los residentes con bacteriemias de desarrollar sepsis.
Este estudio presenta algunas limitaciones. Si bien se realizó en varios asilos de ancianos, no se obtuvo información clínica de los pacientes, además de presentar un número limitado de muestras. Por otra parte, no se analizaron más genes de virulencia y resistencia (otros tipos de BLEE) relevantes en la epidemiología de las UPEC.
En conclusión, este es el primer reporte de UPEC productoras de BLEE en asilos de ancianos en Perú; donde podemos observar el predominio del gen blaCTX-M, de los cuales el 70% pertenecen al blaCTX-M-grupo 2. También, se puede indicar que las UPEC productoras de BLEE en los asilos de ancianos presentan una elevada frecuencia de exotoxinas y del gen nanA, lo que les confiere una ventaja para diseminarse hacia el torrente sanguíneo. Esperamos que estos hallazgos permitan fortalecer la vigilancia epidemiológica de bacterias multirresistentes y prevenir su diseminación.
Agradecimientos: a César Gutiérrez por sus aportes en la revisión del análisis estadístico y a Brenda Moy por su apoyo técnico.
Contribuciones de los autores: AOGR, CIRF y CELF han participado en la concepción del artículo; AOGR, SFIV, CIRF y CELF en la recolección de datos y análisis estadístico; AOGR y EGE en la redacción y aprobación de la versión final. AOGR y SFIV obtuvieron el financiamiento.
Conflicto de interés: los autores declaran no tener conflicto de intereses.
Financiamiento: el financiamiento fue proporcionado por la Facultad de Medicina Humana de la Universidad de Piura.
Referencias bibliográficas
1. Nicolle LE; SHEA Long-Term-Care-Committee. Urinary tract infec-tions in long-term-care facilities. Infect Control Hosp Epidemiol. 2001; 22(3):167‐175. doi: 10.1086/501886.
2. Leibovici-Weissman Y, Tau N, Yahav D. Bloodstream infections in the elderly: what is the real goal?. Aging Clin Exp Res. 2021; 33(4):1101-1112. doi: 10.1007/s40520-019-01337-w.
3. Van der Donk CF, Schols JM, Driessen CJ, Hagenouw RG, Meulendijks A, Stobberingh EE. Prevalence and spread of multi drug resistant Escherichia coli isolates among nursing home residents in the southern part of The Netherlands. J Am Med Dir Assoc. 2013;14(3): 199‐203. doi: 10.1016/j.jamda.2012.09.026.
4. D’Andrea MM, Arena F, Pallecchi L, Rossolini GM. CTX-M-type β-lactamases: a successful story of antibiotic resistance. Int J Med Microbiol. 2013; 303(6-7):305-17. doi: 10.1016/j.ijmm.2013.02.008.
5. Jones RN, Guzman-Blanco M, Gales AC, Gallegos B, Castro AL, Martino MD, et al. Susceptibility rates in Latin American nations: report from a regional resistance surveillance program (2011). Braz J Infect Dis. 2013; 17(6):672-81. doi: 10.1016/j.bjid.2013.07.002.
6. Johnson JR. Virulence factors in Escherichia coli urinary tract infection. Clin Micro Rev. 1991; 4(1), 80-128. doi: 10.1128/cmr.4.1.80.
7. Smith SN, Hagan EC, Lane MC, Mobley HLT. Dissemination and Systemic Colonization of Uropathogenic Escherichia coli in a Murine Model of Bacteremia. MBio. 2010;1(5):1–9. doi: 10.1128/mBio.00262-10.
8. Clinical and Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing. 29a ed. CLSI suplement M100. Wayne, PA: Clinical and Laboratory Standards Institute; 2019. ISBN: 978-1-68440-032-4.
9. Micenková L, Beňová A, Frankovičová L, Bosák J, Vrba M, Ševčíková A, et al. Human Escherichia coli isolates from hemocultures: Septicemia linked to urogenital tract infections is caused by isolates harboring more virulence genes tan bacteraemia linked to other conditions. Int J Med Microbiol. 2017;307(3):182–9. doi: 10.1016/j.ijmm.2017.02.003.
10. Erjavec MS, Jesenko B, Petkovšek Ž, Žgur-Bertok D. Prevalence and associations of tcpC, a gene encoding a Toll/interleukin-1 receptor domain-containing protein, among Escherichia coli urinary tract infection, skin and soft tissue infection, and comensal isolates. J Clin Microbiol. 2010;48(3):966–8. doi: 10.1128/JCM.01267-10.
11. Arce-Gil Z, Llontop-Nuñez J, Flores-Calvo R, Fernandez-Valverde D. Detección del gen CTX-M en cepas de Escherichia coli productoras de B-lactamasas de espectro extendido procedentes del Hospital Regional de Lambayeque; Chiclayo-Perú: Noviembre 2012-Julio 2013. Rev Cuerpo Méd Hosp Nac Almanzor Aguinaga Asenjo, 2013. 2014; 6(4):12–5.
12. Bartoloni A, Pallecchi L, Riccobono E, Mantella A, Magnelli D, Maggio T Di, et al. Relentless increase of resistance to fluoroquinolones and expanded-spectrum cephalosporins in Escherichia coli: 20 years of surveillance in resource-limited settings from Latin America. Clin Microbiol Infect. 2013; 19(4), 356-361, doi: 10.1111/j.1469-0691.2012.03807.x.
13. Galván F, Agapito J, Bravo N, Lagos J, Tamariz J. Caracterización fenotípica y molecular de Escherichia coli productoras de β -Lactamasas de espectro extendido en pacientes ambulatorios de Lima, Perú. Rev Medica Hered. 2016;27(1): 22. doi: 10.20453/rmh.v27i1.2780.
14. Ramirez MR, Marcelo M, Alcedo K, Alejos S. Detection of ESBL-producing E. coli isolates from urinary tract infections in Peru. Poster presentado en: ECCMID 2017 27th, Congreso Europeo de Microbiología Clínica; 2017 Apr 22-25; Vienna, Austria. Disponible en: https://www.escmid.org/escmid_publications/escmid_elibrary/q=peru&i-d=2173&L=0&x=0&y=0&tx_solr%5Bsort%5D=relevance%2Basc&tx_solr%5Bfilter%5%5B0%5D=main_filter_eccmid%253Atrue&tx_solr%-5Bfilter%5%5B1%5D=pub_date%253A201701010000-201712312359.
15. Chávez D. Frecuencia y subtipos del gen blaCTX-M en enterobacterias productoras de BLEE aisladas de urocultivos en el Instituto Nacional de Enfermedades Neoplásicas de enero a diciembre del 2017 [Tesis de bachiller]. Lima: Universidad Nacional Mayor de San Marcos, Facultad de Medicina, Escuela Profesional de Tecnología Médica; 2019. Disponible en: http://cybertesis.unmsm.edu.pe/handle/20.500.12672/11389.
16. Palma N, Pons MJ, Gomes C, Mateu J, Riveros M, García W, et al. Resistance to quinolones, cephalosporins and macrolides in Escherichia coli causing bacteremia in Peruvian children. J Glo Anti Res. 2017, 11:28-33. doi: 10.1016/j.jgar.2017.06.011.17.
17. Bevan ER, Jones AM, Hawkey PM. Global epidemiologyof CTX-M B-lactamases: temporal and geographicalshifts in genotype. J of Ant Chem. 2017;2145–55. doi: 10.1093/jac/dkaa161.
18. Ruligle F, Paulo V, Pinto T, Cesar F, Barbosa B. The spread of CTX-M-type extended-spectrum β-lactamases in Brazil: a systematic review. Microbial Drug Resistance. 2015;2(4):301-311. doi: 10.1089/mdr.2015.0180.
19. Paniagua-Contreras GL, Monroy-Perez E, Rodríguez-Moctezuma JR, Dominguez-Trejo P, Vaca-Paniagua F, Vaca S. Virulence factors ,anti-biotic resistance phenotypes and O-serogroups of Escherichia coli strains isolated from community- acquired urinary tract infection patients in Mexico. J Microbiol Immunol Infect. 2015, 50(4):478-485, doi: 10.1016/j.jmii.2015.08.005.
20. Dadi BR, Abebe T, Zhang L, Mihret A, Abebe W, Amogne W. Distribution of virulence genes and phylogenetics of uropathogenic Escherichia coli among urinary tract infection patients in Addis Ababa, Ethiopia. BMC Infect Dis. 2020; 20(1):108. doi: 10.1186/s12879-020-4844-z.
Citar como: Gonzales-Rodriguez AO, Infante Varillas SF, Reyes Farias CI, Ladines Fajardo CE, Gonzales Escalante E. ß-lactamasas de espectro extendido y factores de virulencia en Escherichia coli uropatógenas en asilos de ancianos en Lima, Perú. Rev Peru Med Exp Salud Publica. 2022;39(1):98-103. doi: https://doi.org/10.17843/rpmesp.2022.391.8580.
Correspondencia: Arturo Octavio Gonzales-Rodriguez; arturo.gonzales@udep.edu.pe
Recibido: 15/06/2021
Aprobado: 09/02/2022
En línea: 24/03/2022