Christian Chiara-Chilet
Julio Maquera-Afaray
Diana Portillo-Alvarez
José W. López
Reporte de caso
Paracoccidioidomicosis sistémica con compromiso del apéndice cecal en un niño: reporte de caso
Systemic paracoccidioidomycosis with compromise of the cecal appendix in a child: case report
Medalit Luna-Vilchez ![]() 1, Médico infectólogo
1, Médico infectólogo
Christian Chiara-Chilet ![]() 1, Médico infectólogo
1, Médico infectólogo
Julio Maquera-Afaray ![]() 1,2, Médico infectólogo
1,2, Médico infectólogo
Diana Portillo-Alvarez ![]() 1, Médico infectólogo
1, Médico infectólogo
José W. López ![]() 1,3, Médico infectólogo
1,3, Médico infectólogo
1 Instituto Nacional de Salud del Niño San Borja, Lima, Perú.
2 Universidad Privada de Tacna, Tacna, Perú
3 Universidad Científica del Sur, Lima, Perú.
El presente reporte de caso fue presentado en el evento científico 16th INFOCUS realizado en Cali, Colombia en el 2018.
RESUMEN
La paracoccidioidomicosis es la micosis sistémica más prevalente en Latinoamérica. En niños la presentación clínica más frecuente es la forma juvenil o aguda/subaguda, que compromete principalmente los ganglios linfáticos y en menor proporción los órganos gastrointestinales. Presentamos el caso de un paciente de 10 años, sin comorbilidades, con dolor agudo en fosa iliaca derecha; además de historia de un mes de evolución de diarrea, fiebre, pérdida de peso e hipereosinofilia. Fue diagnosticado de apendicitis aguda secundaria a un cuadro de paracoccidioidomicosis sistémica, mediante histopatología del apéndice cecal y ganglios mesentéricos. Tuvo respuesta favorable al tratamiento con anfotericina B liposomal. A pesar de que la paracoccidioidomicosis sistémica con compromiso del apéndice cecal es infrecuente, debe considerarse como parte de los diagnósticos diferenciales en niños con linfadenomegalias generalizadas y procedentes de áreas endémicas.
Palabras clave: Paracoccidioidomicosis; Apendicitis; Pediatría; Informes de casos (fuente: DeCS BIREME).
ABSTRACT
Paracoccidioidomycosis, the most prevalent systemic mycosis in Latin America. In children the most common clinical presentation is the juvenile or acute/subacute form, which mainly involves the lymph nodes and in a lesser proportion the gastrointestinal organs. We present the case of a 10-year-old patient, without comorbidities, who presented acute right iliac fossa pain; in addition to a history of 1 month of evolution of diarrhea, fever, weight loss, and hypereosinophilia. Was diagnosed of acute appendicitis due to systemic paracoccidioidomycosis, through histopathology of the cecal appendix and mesenteric lymph nodes. Although systemic paracoccidioidomycosis with involvement of the cecal appendix is rare, it should be considered as part of the differential diagnoses in children and young adults with generalized lymphadenomegaly from endemic areas.
Keywords: Paracoccidioidomycosis; Appendicitis; Pediatrics; Case reports (Source: MeSH NLM).
INTRODUCCIÓN
La paracoccidioidomicosis (PCM) es una enfermedad micótica sistémica, endémica de América Latina, producida por un hongo dimórfico del género Paracoccidioides. Existen dos especies causantes de PCM: Paracoccidioides brasiliensis y Paracoccidioides lutzii (1), y dos presentaciones clínicas: la forma crónica y la aguda/subaguda o juvenil. La PCM juvenil es considerada la forma diseminada de la enfermedad en niños, adolescentes y adultos menores de 30 años. Se caracteriza por la presencia de pérdida de peso, fiebre y anorexia, así como linfadenomegalias localizadas o generalizadas que pueden presentar supuración y fistulización (2). Los órganos gastrointestinales están involucrados en menor frecuencia y los síntomas incluyen dolor abdominal, distensión y diarrea (3,4). El diagnóstico de PCM se realiza mediante la identificación histopatológica de las estructuras en gemación, con apariencia de timón de barco, patognomónicas de PCM (2). En pediatría, las complicaciones relacionadas al diagnóstico tardío incluyen abdomen agudo debido a la obstrucción intestinal y una mortalidad del 3 al 10% (3,5). Describimos el caso de un niño con presentación clínica atípica de PCM juvenil con compromiso del apéndice cecal.
REPORTE DE CASO
Varón de 10 años procedente de la región de la selva central de Lamas-San Martín, sin comorbilidades, ingresó al hospital por presentar desde hace un mes fiebre, linfadenomegalias generalizadas, pérdida de peso, diarreas y el día del ingreso dolor agudo abdominal en fosa iliaca derecha. El examen clínico mostró linfadenomegalias a nivel cervical y axilar, una masa en la región del epigastrio e hipocondrio izquierdo, signo de McBurney positivo y signo del rebote positivo. Los datos de laboratorio mostraron un recuento de leucocitos de 18800 células/mL (14476 neutrófilos, 2632 eosinófilos), hemoglobina de 9,2 mg/dL, plaquetas de 762,000 células/mL, albúmina de 3,03 gr/dL, la función renal y hepática fueron normales. El análisis serológico resultó negativo para sífilis, hepatitis B, hepatitis C y VIH. El análisis parasitológico en heces fue negativo. La tomografía computarizada mostró linfadenomegalias cervicales y axilares, hepatoesplenomegalia, linfadenomegalias difusas mesentéricas y engrosamiento del ciego y el apéndice cecal (Figura 1).
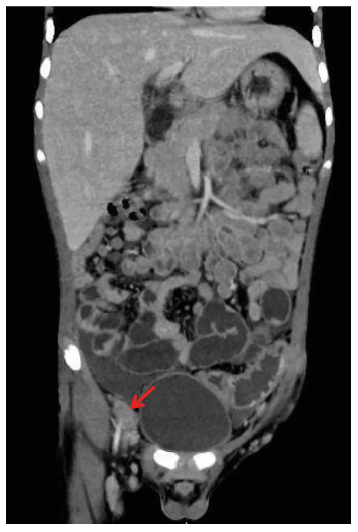
Figura 1. Tomografía abdominal con contraste, se evidencian signos de proceso inflamatorio apendicular, líquido libre en parietocólica derecha y pelvis, cambios inflamatorios a nivel de colon descendente y sigmoides. Múltiples adenopatías mesentéricas, retroperitoneales y pélvicas de aspecto inflamatorio. Hepatoesplenomegalia.
Se realizó cirugía abdominal por el diagnóstico de apendicitis aguda. En la histopatología, del apéndice cecal y los ganglios mesentéricos, con tinción PAS (Periodic Acid-Schiff) y Grocott, se encontraron múltiples células levaduriformes en gemación con forma de timón de barco, concordantes con Paracoccidioides spp. Ademásse observaron granulomas no caseificantes con células gigantes multinucleadas, linfocitos, células epitelioides y eosinófilos (Figura 2). La tinción de Zielh Neelsen fue negativa. No se realizó cultivo para hongos del tejido de la biopsia del apéndice cecal o ganglionar.
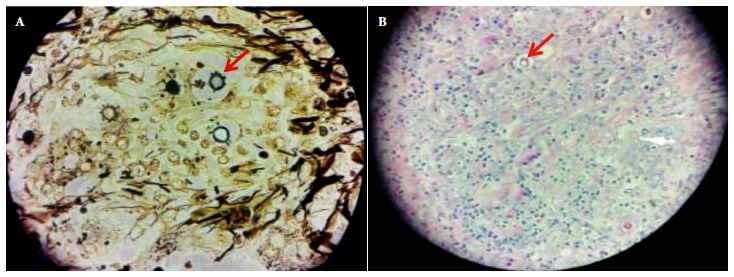
Figura 2. Tincion del apendice cecal segun tecnica Groccot 400x (A) y PAS (Periodic Acid-Schiff) 100x. Se observa multiples granulomas no caseificantes con celulas gigantes multinucleadas a cuerpo extrano en mucosa, submucosa y capa muscular, asociado a abundantes estructuras redondas con capsula de 2 a mas de 60 μ, presencia de infiltrado linfomononuclear, eosinofilia moderada. Arquitectura distorsionada por la presencia de multiples granulomas no caseificantes, levaduras con esporulaciones multiples en forma de "timon de barco".
El paciente recibió catorce días de tratamiento con anfotericina B liposomal (3 mg/kg/día) y al alta continuó a itraconazol vía oral (10 mg/kg/día) para completar un año de tratamiento.
Durante la hospitalización se evidenció disminución del tamaño de las adenopatías cervicales (Figura 3) y abdominales, así como mejoría de la tolerancia oral y ganancia ponderal. Además, hubo mejoría de los parámetros del hemograma. Por estas razones, el paciente fue dado de alta para completar el tratamiento antifúngico de forma ambulatoria.
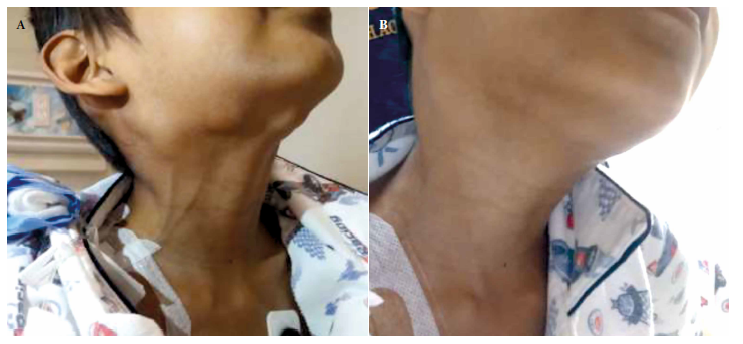
Figura 3. A) Se evidencian multiples adenopatias a nivel cervical submandibular, preauricular y retroauriculares, previo inicio de tratamiento. B) Se evidencia resolucion parcial de adenopatias a los 14 dias de tratamiento con anfotericina B liposomal.
DISCUSIÓN
El presente caso clínico muestra una forma inusual de apendicitis aguda secundaria a un cuadro de paracoccidioidomicosis sistémica en un niño sin comorbilidades. El diagnóstico fue realizado mediante la histopatología del apéndice cecal y los ganglios mesentéricos. El paciente tuvo una buena evolución clínica y mejoría de parámetros de laboratorio con el tratamiento de anfotericina B liposomal.
La PCM es una infección micótica con una amplia distribución geográfica en América Latina (2), frecuente en áreas húmedas tropicales y subtropicales (1). En Perú, los casos reportados proceden de regiones de ceja de selva y selva baja amazónica como La Merced-Chanchamayo en Junín y en Lamas-San Martín (6).
La PCM juvenil representa del 5 al 10% de todos los casos, la ruta de infección es mediante la inhalación de conidias, la forma ambiental del hongo. La infección primaria afecta los pulmones y luego puede diseminarse a otros órganos a través de los vasos linfáticos y sanguíneos (7); produciendo un cuadro clínico diseminado y más grave comparado con la forma crónica, presente en adultos. Los síntomas más frecuentes en niños son las linfadenomegalias generalizadas, la fiebre y la pérdida de peso; el compromiso gastrointestinal se presenta en menos de un tercio de los pacientes e incluye principalmente hepatoesplenomegalia (3). Las linfadenomegalias abdominales causan dolor abdominal difuso y compresión de varias estructuras como los intestinos, produciendo obstrucción parcial (8). En el caso reportado, es posible que el compromiso linfoide haya causado hiperplasia y obstrucción del lumen del apéndice, produciendo apendicitis aguda (9).
Por el cuadro clínico y procedencia del paciente, se planteó dentro de los diagnósticos diferenciales como etiologías infecciosas a tuberculosis diseminada e histoplasmosis sistémica. Como diagnóstico diferencial no infeccioso se planteó un linfoma.
Los hallazgos de laboratorio muestran recuentos de eosinófilos de más de 500 células/µL en 61 y 76% de los casos respectivamente (5). La hipereosinofilia se ha atribuido a los niveles elevados de citocinas (especialmente IL-5) y la respuesta inmune de las células Th2 (10). En el caso presentado se evidenció un recuento de eosinófilos mayor de 1000 células/µL que disminuyó de forma progresiva con la terapia antimicótica, observado en casos similares. Otros hallazgos de laboratorio reportados fueron la anemia y la hipoalbuminemia.
El diagnóstico de PCM se realiza mediante la identificación de las formas típicas del hongo en los órganos afectados por histopatología de las biopsias, con tinción de Grocott o PAS. Estas muestran paredes gruesas birrefringentes y gemación que dan forma de timón de barco, patognomónico de Paracoccidioides brasiliensis (11). Los granulomas no caseificantes, las células gigantes multinucleadas y el infiltrado linfocítico también son hallazgos típicos (4,12). En nuestro paciente, el diagnóstico fue realizado mediante confirmación anatomo-patológica de las estructuras levaduriformes en forma de "timón de barco" del apéndice cecal y los ganglios mesentéricos. Una de las limitaciones en el diagnóstico fue no realizar el diagnóstico microbiológico mediante cultivo de tejido y estudios serológicos complementarios (inmunodifusión).
El diagnóstico de PCM puede tardar algunas semanas porque se requiere un equipo de salud multidisciplinario, toma de muestras mediante técnicas invasivas y un laboratorio implementado; además la mayor parte de pacientes provienen de áreas de bajos recursos y requieren ser referidos a hospitales de mayor complejidad (7). Si existe demora en el inicio del tratamiento antifúngico, la PCM progresa rápidamente y la condición del paciente se ve seriamente comprometida. Las complicaciones debidas al diagnóstico tardío pueden ser fatales, produciendo abdomen agudo por obstrucción o perforación intestinal, llegando a tener una mortalidad en pediatría del 3 al 10% (3,5).
De acuerdo con la guía brasileña para el manejo de la paracoccidioiomicosis, la anfotericina B deoxicolato o en formulación lipídica (complejo liposomal o lipídico) ha demostrado ser efectiva en el tratamiento de PCM severa o diseminada, se indica durante las 2 a 4 primeras semanas. Posterior a la mejoría clínica, se realiza la transición a vía oral con trimetropin sulfametoxazol o itraconazol (2). Similar a lo indicado en el caso presentado.
En conclusión, la apendicitis aguda secundaria a la PCM sistémica, a pesar de ser una presentación clínica atípica, debería incluirse en el diagnóstico diferencial de abdomen agudo en niños que presentan linfadenomegalias generalizadas, leucocitosis e hipereosinofilia; procedentes de regiones endémicas de PCM. El tratamiento debe comenzar lo más pronto posible para evitar complicaciones y la muerte.
Contribuciones de los autores: MLV y CCC concibieron el artículo. MLV, CCC y JMA recolectaron los datos y redactaron el artículo. MLV, CCC, JMA, DPA y JLR se encargaron de la revisión crítica del manuscrito y aprobaron su versión final.
Conflictos de interés: los autores declaran no tener conflictos de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. Taicz M, Rosanova MT, Bes D, Lisdero ML, Iglesias V, Santos P, et al. Paracoccidioidomicosis en pediatría: Descripción de 4 casos. Rev Iberoam Micol. 2014;31(2):141–4. doi: 10.1016/j.riam.2013.05.013.
2. Shikanai-Yasuda MA, Mendes RP, Colombo AL, de Queiroz-Telles F, Kono ASG, Paniago AMM, et al. Brazilian guidelines for the clinical management of paracoccidioidomycosis. Rev Soc Bras Med Trop. 2017;50(5):715–40. doi: 10.1590/0037-8682-0230-2017.
3. Tresoldi M, Pereira RM. Acute‐subacute paracoccidioidomycosis : A paediatric cohort of 141 patients, exploring clinical characteristics, laboratorial analysis and developing a non‐survival predictor. Mycoses. 2019;62(11)999–1005. doi: 10.1111/myc.12984.
4. Alcántara-Figueroa C, Verástegui R, Aphang-Lam M, Cáceres-Alpaca D. Paracoccidioidomicosis colónica en un hospital de Lima - Perú: reporte de 4 casos. Rev Gastroenterol Perú. 2017;37(1):77–81.
5. Pereira RM, Bucaretchi F, Barison EDM, Hessel G, Tresoldi AT. Paracoccidioidomycosis in children: Clinical presentation, follow-up and outcome. Rev Inst Med Trop Sao Paulo. 2004;46(3):127–31. doi: 10.1590/s0036-46652004000300002.
6. Burstein-Alva Z. Aspectos clínicos de la blastomicosis sudamericana (Paracoccidioidomicosis) en el Perú. Rev Peru Med Exp Salud Publica. 2002;19(1):43–7.
7. Shikanai-Yasuda MA, Mendes RP, Colombo AL, Queiroz-telles F De, Satie A, Kono G, et al. Consensus Brazilian guidelines for the clinical management of paracoccidioidomycosis. 2017;50(5):715–40. doi: 10.1590/0037-8682-0230-2017.
8. Vasconcellos A, Ambrósio A, Camelo CCS, Barbosa CV, Tomazatti FG, Brazões FA de S, et al. Paracoccidioidomycosis disease (Lutz-Splendore-Almeida) - clinical manifestations. Rev Médica Minas Gerais. 2014;24(1):64–70. doi: 10.5935/2238-3182.20140019.
9. Gava P, Alves de Melo AS, Marchiori E, Costa MHM, Pereira E, Rangel RD. Intestinal and appendiceal paracoccidioidomycosis. Radiol Bras. 2015;48(2):126–30. doi: 10.1590/0100-3984.2014.0035.
10. Mejia-zuluaga M, Rosas S, Posada-Vélez V, Quintero PA. Hypereosinophilia secondary to disseminated paracoccidioidomycosis. Am J Case Rep. 2017;18:1114–7. doi: 10.12659/AJCR.904520.
11. Correa-de-Castro B, Pompilio MA, Odashiro DN, Odashiro M, Arão-Filho A, Paniago AMM. Unifocal bone paracoccidioidomycosis, Brazil. Am J Trop Med Hyg. 2012;86(3):470–3. doi: 10.4269/ajtmh.2012.11-0295.
12. Lomazi EA, de Negreiros LMV, Magalhães PVVS, Togni RCS, de Paiva NM, Ribeiro AF, et al. Intestinal paracoccidioidomycosis resembling Crohn’s disease in a teenager: a case report. J Med Case Rp. 2018;12(1):108. doi: 10.1186/s13256-018-1641-z.
Financiamiento: autofinanciado.
Citar como: Luna-Vilchez M, Chiara-Chilet C, Maquera-Afaray J, Portillo-Alvarez D, López JW. Paracoccidiodimicosis sistémica con compromiso del apéndice cecal en un niño: reporte de caso. Rev Peru Med Exp Salud Publica. 2021;38(4):662-5. doi: https://doi.org/10.17843/rpmesp.2021.384.9082.
Correspondencia: Medalit Luna-Vilchez E-mail medalv16@hotmail.com
Recibido: 20/07/2021
Aprobado: 10/10/2021
En línea: 26/11/2021