Manuel Sisniegas
Fátima Zavala
1 Universidad Nacional de Trujillo, Trujillo, Perú.
El presente estudio forma parte de la tesis: Vega-Cabanillas, R. Efecto genotóxico de la tartrazina a diferentes concentraciones en linfocitos de Mus musculus BALB/c evaluado mediante el test de micronúcleos [tesis de pregrado]. Trujillo: Facultad de Ciencias Biológicas, Universidad Nacional de Trujillo; 2018.
RESUMEN
Objetivos. Determinar el efecto genotóxico de la tartrazina en linfocitos de sangre periférica de Mus musculus BALB/c.
Materiales y métodos. Se realizó un estudio experimental, a través de cinco grupos, con cinco ratones en cada uno. Se les registró el peso durante 17 semanas y, en la semana 15 se les administró suero fisiológico (control negativo), dicromato de potasio 25 mg/kg de peso corporal (pc) (control positivo) y tartrazina a dosis de 0,75 mg/kg pc, 7,5 mg/kg pc y 75 mg/kg pc, durante siete días, a excepción del control positivo que fue en dosis única. Luego, cada 24 h se obtuvo una muestra de sangre periférica de la cola y se realizó el frotis, secado y coloración. Posteriormente, se realizó el conteo de 1000 linfocitos por muestra de cada ratón, en todos los tratamientos.
Resultados. Los tres tratamientos con tartrazina no causaron diferencias significativas en el peso de ratones a la semana 15, pero sí produjeron diferencias significativas en la frecuencia de linfocitos micronucleados, siendo el tratamiento con tartrazina de 75 mg/kg pc el de mayor efecto genotóxico, induciendo un promedio de 1,63 ± 0,08 linfocitos micronucleados, comparado con el control positivo que generó un promedio de 1,42 ± 0,08 linfocitos micronucleados.
Conclusiones. La tartrazina produjo un efecto genotóxico, incrementando el número de linfocitos micronucleados, a dosis de 0,75; 7,5 y 75 mg/kg pc y no afecta el peso corporal durante siete días de administración en M. musculus BALB/c.
Palabras clave: Tartrazina; Ensayos de Micronúcleos; Genotoxicidad; Mus musculus; Linfocitos; Pruebas de Toxicidad; Ratones Endogámicos; Aditivos Alimentarios; Micronúcleo con Defecto Cromosómico; Dosis Diaria Recomendada (fuente: DeCS BIREME).
ABSTRACT
Objectives. To determine the genotoxic effect of tartrazine on peripheral blood lymphocytes of BALB/c Mus musculus.
Materials and methods. An experimental study was carried out using five groups, with five mice in each group. Their weight was registered for 17 weeks, and at week 15 they were administered physiological saline solution (negative control), potassium dichromate at 25 mg/kg body weight (bw) (positive control) and tartrazine at doses of 0.75 mg/kg bw, 7.5 mg/kg bw and 75 mg/kg bw, for seven days, with the exception of the positive control which was a single dose. Then, every 24 hours, a peripheral blood sample was obtained from the tail, which was then smeared, dried and stained. Subsequently, 1000 lymphocytes were counted for each sample from each mouse, for all treatment groups.
Results. The three tartrazine treatments did not cause significant differences in the weight of mice at week 15, but did produce significant differences in the frequency of micronucleated lymphocytes, with the 75 mg/kg bw tartrazine treatment having the greatest genotoxic effect, inducing an average of 1.63 ± 0.08 micronucleated lymphocytes, compared to the positive control which obtained an average of 1.42 ± 0.08 micronucleated lymphocytes.
Conclusions. Tartrazine produced a genotoxic effect, increasing the number of micronucleated lymphocytes, at doses of 0.75; 7.5 and 75 mg/kg bw and did not affect body weight during seven days of administration to BALB/c M. musculus.
Keywords: Tartrazine; Micronucleus Assays; Genotoxicity; Mus musculus; Lymphocytes; Toxicity Tests; Endogamic Mice; Food Additives; Chromosome Defect Micronucleus; Recommended Dietary Allowances (source: MeSH NLM).
INTRODUCCIÓN
En la industria alimentaria, los aditivos colorantes son sustancias que normalmente no se consumen como alimento ni tampoco se usan como ingrediente básico, pero cuya adición resalta la apreciación visual de los productos o aumenta su estética (1). Uno de los colorantes artificiales azoicos más utilizados en esta industria es la tartrazina; se encuentra como aditivo en bebidas, dulces congelados, mezclas en polvo, productos de gelatina, dulces, glaseados, especias, aderezos, salsas, pescados, productos pesqueros, horneados y lácteos (2).
El uso de tartrazina está permitido en la Unión Europea, Japón, Estados Unidos y otras regiones como Latinoamérica; el comité mixto FAO/OMS de expertos en aditivos alimentarios (Joint FAO/WHO Expert Committee on Food Additives, JECFA) determinó en 1964 una ingesta diaria aceptable (IDA) de 0–7,5 mg/kg de peso corporal; sin embargo, en el 2016, la modificó y estableció una IDA de 0 a 10 mg/kg de peso corporal, sustentado por un nivel de efecto adverso no observado (NOAEL, por sus siglas en inglés) de 984 mg/kg de peso corporal por día, en un estudio de reducciones en el peso corporal en ratas y sobre la estimación de la exposición dietética para los niños europeos de 1 a 10 años que se encuentra por debajo del límite superior de la IDA (4–73%), por lo que concluyeron que la exposición dietética a la tartrazina para la población general, incluidos los niños, no representa ningún problema de salud (2).
Sin embargo, en el Perú se ha reportado que existen productos que exceden las dosis determinadas por la JECFA, tales como cereales caseros expendidos en el mercado mayorista de la ciudad de Trujillo y papillas procesadas para bebés, en la ciudad de Arequipa, los cuales superan el límite permitido de 500 ppm asignado por el Codex Alimentarius (3,4); aun cuando la Dirección General de Salud Ambiental (DIGESA) emitió un comunicado sobre las disposiciones para el uso de la tartrazina (5) y en el 2014, el Congreso de la República del Perú aprobó el Proyecto de Ley 165/2011 de etiquetado de productos que contienen tartrazina(6).
Actualmente, este colorante ha causado controversia y su uso ha sido prohibido en Noruega y Austria (7), por sus efectos tóxicos como aberraciones cromosómicas en mamíferos (8,9); formación de micronúcleos en células sanguíneas humanas (10); potencial mutagénico en cultivos de células de estómago humano (11) y en células radiculares meristemáticas de Allium cepa (12,13) y carcinógeno en roedores (14). No obstante, existen reportes que sostienen la inocuidad de la tartrazina en ratas, en las que no genera aumento de la frecuencia de células micronucleadas en el colon, en concentraciones de 1000 mg/kg, 200 mg/kg y 20 mg/kg (15,16).
Esta controversia científica es un estímulo para continuar con investigaciones sobre el efecto de la tartrazina en modelos animales que tengan semejanza bioquímica y metabólica con el ser humano (17); como por ejemplo, los ratones de la especie Mus musculus que son usados para investigar y comprender las causas, diagnóstico y tratamiento de enfermedades que afectan al hombre; así como en el biomonitoreo y control de medicamentos, alimentos y otros insumos, que hasta la fecha son insustituibles(18,19). Asimismo, los biomarcadores son importantes para el biomonitoreo citogenético de poblaciones expuestas a riesgos potenciales de agentes químicos (20); el ensayo de micronúcleos es uno de los más utilizados debido a su alta sensibilidad a agentes mutagénicos presentes en la dieta. Estos biomarcadores permiten medir daños clastogénicos y aneugénicos en células indicadoras como linfocitos y está respaldada por el proyecto «The HUman MicronNucleus (HUMN)» (21,22).
Frente a las controversias sobre el posible daño al material genético o el efecto cancerígeno de la tartrazina, así como a su uso como colorante sintético en la industria alimentaria y farmacéutica, además de la ineficiente regulación de su uso en diferentes países, el presente trabajo se planteó el objetivo de determinar el efecto genotóxico de la tartrazina mediante la inducción de micronúcleos en linfocitos de Mus musculus BALB/c, permitiendo definir y cuantificar el daño en el material genético.
|
MENSAJES CLAVE |
|
Motivación para realizar el estudio: se han reportado dosis superiores de tartrazina a las permitidas por el Comité Mixto FAO/OMS de Expertos en Aditivos Alimentarios (JECFA, por sus siglas en inglés) en productos alimenticios; además, existen controversias de sus efectos tóxicos sobre las células y organismos de experimentación. Principales hallazgos: las tres dosis de tartrazina de 0,75; 7,5 y 75,0 mg/kg de peso corporal indujeron micronúcleos en linfocitos de sangre periférica de Mus musculus BALB/c en la misma o mayor magnitud que el dicromato de potasio. Implicancias: implicancias en salud pública y/o políticas sanitarias. La tartrazina genera toxicidad, aun en las dosis permitidas por el JECFA, por lo que se sugiere un control exhaustivo de su uso como colorante artificial y aditivo alimentario. |
MATERIALES Y MÉTODOS
Diseño
Se realizó un estudio experimental siguiendo las directrices ARRIVE (Animal Research: Reporting of In Vivo Experiments). La preparación de las soluciones de tartrazina y lectura de frotis sanguíneo se llevó a cabo en el Laboratorio de Genética de Poblaciones de la Universidad Nacional de Trujillo (UNT). Se consideraron tres dosis de tartrazina 0,75 mg/kg pc; 7,5 mg/kg pc y 75 mg/kg pc, suero fisiológico como control negativo y dicromato de potasio como control positivo, administrado en dosis única de 25 mg/kg de pc.
Animales
Se consideraron 25 ejemplares de Mus musculus BALB/c machos y de tres semanas de edad obtenidos del Bioterio del Instituto Nacional de Salud; dichos ejemplares fueron transportados por vía terrestre en una jaula plástica debidamente implementada y adecuada, hacia el Laboratorio de Genética de Poblaciones de la Escuela de Ciencias Biológicas de la UNT, cumpliendo con las normas éticas exigidas internacionalmente.
Para asegurar la adaptación conductual y fisiológica, los ratones fueron criados durante 14 semanas en canastillas de plástico de 26 cm de alto x 29 cm de ancho x 40 cm de largo, a una temperatura ambiente promedio de 20,1 °C, humedad relativa de 67%, 12 h de ciclo día-noche, con recambio diario de viruta, alimento balanceado y agua mineral ad libitum, cumpliendo con las directrices de la «Guía de manejo y cuidado de animales de laboratorio: ratón» (19).
Registro de peso corporal
El peso corporal (pc) de cada uno de los individuos de M. musculus se registró semanalmente usando una balanza digital (Ferton) hasta las 17 semanas de edad; para el reporte se consideraron los pesos corporales de los individuos una semana anterior al inicio de los tratamientos (14 semanas de edad), durante el tratamiento (15 semanas de edad) y después del tratamiento (16 y 17 semanas de edad).
Administración de tratamiento
Para determinar el daño al material genético mediante la presencia de micronúcleos en linfocitos a través del ensayo de genotoxicidad, se consideró 25 ejemplares machos de M. musculus BALB/c de 15 semanas de edad, seleccionados luego del periodo de adaptación, con peso promedio de 35,13 g ± 1,89 los cuales fueron divididos al azar en cinco grupos experimentales de cinco individuos cada uno. A los cinco individuos del grupo experimental de control negativo se les administró oralmente 0,5 mL de suero fisiológico por día mediante sondeo intragástrico; a los cinco individuos del grupo experimental de control positivo se les administró una dosis única de dicromato de potasio (Riedel-de Haen AG 12257) de 25 mg/kg pc (23); los tres grupos experimentales restantes fueron tratados con soluciones de tartrazina (SIGMA T0388) a dosis de 0,75 mg/kg pc; 7,5 mg/kg pc y 75 mg/kg pc por sondeo intragástrico diario (23,24).
Toma de muestra sanguínea y obtención de preparados citológicos para el recuento de micronúcleos
Las muestras de sangre periférica de 25 individuos M. musculus BALB/c de 15 semanas de edad fueron colectadas durante siete días mediante un corte transversal de la vena lateral de la cola usando una navaja estéril. Consecuentemente, se obtuvo una gota de sangre la cual se colocó en una lámina portaobjetos, se realizó un extendido y se dejó secar a temperatura ambiente para luego ser coloreada con Wright (23).
Recuento de linfocitos e identificación de micronúcleos
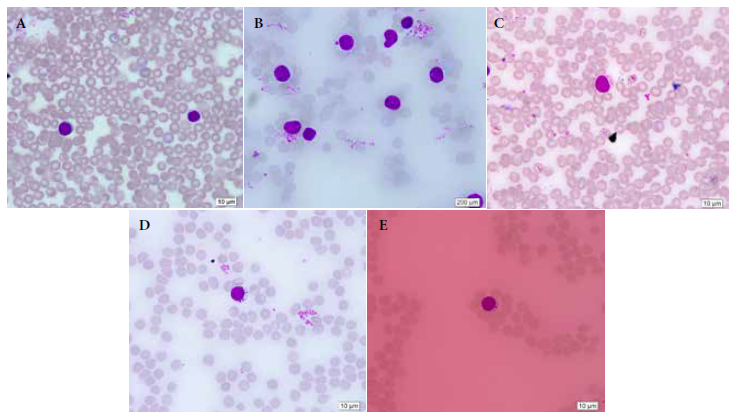
El recuento de linfocitos fue realizado por el personal investigador del Laboratorio de Genética de Poblaciones debidamente entrenado, utilizando un microscopio Olympus CX21 a 1000X de magnificación; se tomó en cuenta 1000 células por muestra de cada individuo en todos los grupos experimentales, por día y durante siete días. Se consideraron como micronúcleos aquellos que no fueron refractarios, con intensidad de tinción similar al núcleo principal, no unidos al núcleo de la célula de origen o que podían tocar el núcleo de la célula de origen, pero no superponerse con él y de membrana nítida visualmente (25). Al finalizar, todos los ejemplares fueron criados durante ocho semanas más, según la «Guía de manejo y cuidado de animales de laboratorio: ratón» (19); posteriormente, fueron donados progresivamente a los alumnos con fines educativos.
Análisis estadístico
Para determinar la distribución normal de los datos se aplicó la prueba de normalidad de Shapiro-Wilk. Luego, con los datos de pesos corporales de las semanas 14, 15, 16 y 17 se calculó la media y error estándar. Además, los datos de linfocitos micronucleados, por ser una variable que toma valores cero y positivos (variable Poisson), fueron transformados con el método Ln (conteo+1) a fin de corregir los valores del coeficiente de variación mayores al 30%. Seguidamente, se calculó la media, error estándar y ANOVA para un modelo estadístico de medidas repetidas continuas para contrastar la significancia del efecto principal de cada tratamiento y tiempo de tratamiento, así como el efecto en la interacción entre las variables tratamiento-tiempo. Finalmente, se aplicó la prueba de Tukey de comparación de medias, considerando un nivel de confianza del 95%. Se utilizó el software estadístico Statgraphics Centurion XVI.I, versión gratuita demostrativa.
Criterios éticos
Los procedimientos fueron sometidos a los criterios del manual de procedimientos de la oficina del Comité de Ética de Investigación (MAPRO) de la Universidad Nacional de Trujillo y aprobados por el Comité de Ética en investigación de la Facultad de Ciencias Biológicas (aprobación 007-2017/CE-FAC. CC.BB.).
RESULTADOS
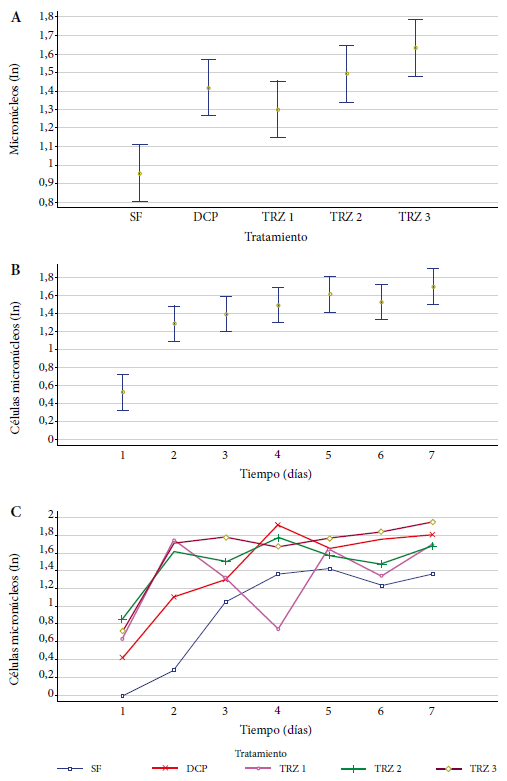
Los resultados observados en linfocitos de sangre periférica de Mus musculus BALB/c de 15 semanas de edad tuvieron una media de 0,96 linfocitos con micronúcleos, para el grupo control negativo que fue expuesto a suero fisiológico; promedios mayores a este se observaron en los grupos administrados con tartrazina, en la que el grupo expuesto a 75 mg/kg pc mostró un promedio de 1,63, sobrepasando al grupo control positivo que fue expuesto a dicromato de potasio que tuvo 1,42 linfocitos micronucleados, en promedio (Tabla 1).
Tabla 1. Estimadores estadísticos y clasificación estadística de los tratamientos y tiempos de administración de tartrazina según su efecto en la generación de linfocitos con micronúcleos en sangre periférica de Mus musculus BALB/c.
|
Nivel |
Número de individuos |
Media |
Valor de p d |
Error estándar (EE) |
Límite inferior |
Límite superior |
|
Tratamiento |
|
|
0,003 |
|
|
|
|
SSF |
35 |
0,98a |
|
0,07 |
0,80 |
1,11 |
|
DCP |
35 |
1,42b |
|
0,07 |
1,26 |
1,57 |
|
TRZ 1 |
35 |
1,30b |
|
0,07 |
1,15 |
1,45 |
|
TRZ 2 |
35 |
1,49b |
|
0,07 |
1,34 |
1,65 |
|
TRZ 3 |
35 |
1,63c |
|
0,07 |
1,48 |
1,78 |
|
Tiempo (días) |
|
|
< 0,001 |
|
|
|
|
1 |
25 |
0,53a |
|
0,09 |
0,34 |
0,71 |
|
2 |
25 |
1,29b |
|
0,09 |
1,11 |
1,47 |
|
3 |
25 |
1,39b |
|
0,09 |
1,20 |
1,57 |
|
4 |
25 |
1,49b |
|
0,09 |
1,31 |
1,67 |
|
5 |
25 |
1,61b |
|
0,09 |
1,43 |
1,79 |
|
6 |
25 |
1,53b |
|
0,09 |
1,34 |
1,71 |
|
7 |
25 |
1,69c |
|
0,09 |
1,51 |
1,88 |
DCP: dicromato de potasio (25 mg/kg pc); SF: suero fisiológico; TRZ 1: 0,75 mg/kg pc de tartrazina; TRZ 2: 7,5 mg/kg pc de tartrazina; TRZ 3: 75,0 mg/kg pc de tartrazina.
a,b,c Igual letra representa igual efecto estadístico según la prueba de Tukey, dPrueba de ANOVA.