Utilidad diagnóstica de los tiempos de positividad de hemocultivos para distinguir verdaderas bacteriemias de contaminantes en base a un sistema automatizado
DOI:
https://doi.org/10.17843/rpmesp.2023.404.12724Palabras clave:
Técnicas microbiológicas, bacteriemia, infecciones bacterianas, micosis, cultivo de sangre, diagnósticoResumen
Objetivo. Determinar la utilidad diagnóstica de los tiempos de positividad de hemocultivos para distinguir
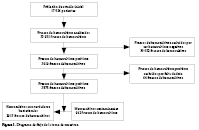
verdaderas bacteriemias de contaminantes en el sistema automatizado «BACT/ALERT®». Materiales y métodos. Se realizó un estudio transversal de tipo pruebas diagnósticas, a partir de una base de datos de muestras de hemocultivos procesadas entre enero del 2016 y agosto del 2021. Se incluyeron todas las muestras de hemocultivos de pacientes con sospecha de bacteriemia, las muestras de hemocultivos fueron ingresadas al sistema «BACT/ALERT®» para diferenciar verdaderas bacteriemias de contaminantes. Resultados. Se analizó un total de 33 951 frascos de hemocultivos y se obtuvieron 3875 frascos positivos. El 75,2% (n=2913) del total de hemocultivos positivos fueron verdaderas bacteriemias y 24,8% (n=962) fueron contaminantes. La mediana de tiempo de positividad en los hemocultivos con verdaderas bacteriemias fue significativamente menor (16,3 horas; RIC: 11,2 – 24,9) que la mediana de tiempo de positividad de hemocultivos con contaminantes (22,5 horas; RIC: 18,4 – 31,8; p<0,001). El tiempo de positividad demostró capacidad discriminante para diferenciar verdaderas bacteriemias de contaminantes, con un AUC-ROC de 0,73 (IC95%: 0,71 – 0,75), con 85% y 63% de sensibilidad y especificidad respectivamente para el diagnóstico de contaminantes cuando el tiempo de positividad supera las 16,5 horas. La administración de antibióticos previos a la toma retrasó el tiempo de positividad, en cambio, haber presentado fiebre antes de la toma de muestra acortó el tiempo de positividad. Conclusiones. Nuestros resultados muestran un buen desempeño de los tiempos de positividad de hemocultivos para diferenciar
verdaderas bacteriemias de contaminantes utilizando el sistema «BACT/ALERT®» cuando el tiempo de positividad fue superior a 16,5 horas.
Descargas
Referencias
Goto M, Al-Hasan MN. Overall burden of bloodstream infection and nosocomial bloodstream infection in North America and Europe.Clin Microbiol Infect 2013;19:501–9. doi:10.1111/1469-0691.12195.
Hernández García OL, Rodríguez Venegas ED la C, Ávila Cabreras JA, Vitón Castillo AA, Blanco Rojas AL, Hernández García OL, et al. Factores pronósticos de mortalidad en pacientes con bacteriemia ingresados en la Unidad de Cuidados Intensivos. Revista de Ciencias Médicas de Pinar del Río. febrero de 2021;25(1). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1561-31942021000100006.
Alonso-Menchén D, Muñoz P, Sánchez-Carrillo C, Pérez-Latorre L, Bouza E. Unresolved issues in the epidemiology and diagnosis of
bacteremia: an opinion paper. Rev Esp Quimioter 2022;35:519–37. doi: 10.37201/req/066.2022.
Rodríguez Díaz JC, Guna Serrano R, Larrosa Escartín N, Marín Arriaza M. Diagnóstico microbiológico de la bacteriemia y la fungemia:
hemocultivos y métodos moleculares [Internet]. Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC); 2017
[citado el jueves 17 de marzo de 2023]. Disponible en: https://seimc.org/contenidos/documentoscientificos/procedimientosmicrobiologia/seimc-procedimientomicrobiologia62.pdf.
Hall KK, Lyman JA. Updated Review of Blood Culture Contamination. Clin Microbiol Rev 2006;19:788–802.doi: 10.1128/CMR.00062-05.
Laukemann S, Kasper N, Kulkarni P, Steiner D, Rast AC, Kutz A, et al. Can We Reduce Negative Blood Cultures With Clinical Scores and
Blood Markers? Results From an Observational Cohort Study. Medicine (Baltimore) 2015;94:e2264.doi: 10.1097/MD.0000000000002264.
Gunvanti R, Lakshmi JT, Ariyanachi K, Saranya M, Kamlakar S, Sakthivadivel V, et al. Blood Culture Contamination Rate as a Quality
Indicator – a Prospective Observational Study. Maedica (Bucur). junio de 2022;17(2):311-6. doi: 10.26574/maedica.2022.17.2.311.
Spoorenberg V, Prins JM, Opmeer BC, de Reijke TM, Hulscher MEJL, Geerlings SE. The additional value of blood cultures in patients
with complicated urinary tract infections. Clin Microbiol Infect 2014;20:O476-479. doi: 10.1111/1469-0691.12491.
Dubourg G, Lamy B, Ruimy R. Rapid phenotypic methods to improve the diagnosis of bacterial bloodstream infections: meeting the challenge to reduce the time to result. Clin Microbiol Infect 2018;24:935–43. doi: 10.1016/j.cmi.2018.03.031.
Murray PR, Masur H. Current approaches to the diagnosis of bacterial and fungal bloodstream infections in the intensive care unit. Crit Care Med 2012;40:3277–82.doi: 10.1097/CCM.0b013e318270e771.
Pardinas-Llergo MJ, Alarcón-Sotelo A, Ramírez-Angulo C, Rodríguez-Weber F, Díaz-Greene EJ, Pardinas-Llergo MJ, et al. Probabilidad
de éxito de obtener un hemocultivo positivo. Medicina interna de México 2017;33:28–40. Disponible en: https://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0186-48662017000100028.
Pliakos EE, Andreatos N, Shehadeh F, Ziakas PD, Mylonakis E. The Cost-Effectiveness of Rapid Diagnostic Testing for the Diagnosis of
Bloodstream Infections with or without Antimicrobial Stewardship. Clin Microbiol Rev 2018;31:e00095-17. doi: 10.1128/CMR.00095-17.
Ruiz-Giardín JM, Martin-Díaz RM, Jaqueti-Aroca J, Garcia-Arata I, San Martín-López JV, Sáiz-Sánchez Buitrago M. Diagnosis of bacteraemia and growth times. International Journal of Infectious Diseases 2015;41:6–10. doi: 10.1016/j.ijid.2015.10.008.
Morioka S, Ichikawa M, Mori K, Kurai H. Coagulase-negative staphylococcal bacteraemia in cancer patients. Time to positive culture
can distinguish bacteraemia from contamination. Infect Dis (Lond) 2018;50:660–5. doi: 10.1080/23744235.2018.1451917.
Rogers MS, Oppenheim BA. The use of continuous monitoring blood culture systems in the diagnosis of catheter related sepsis. J Clin Pathol 1998;51:635–7. doi: 10.1136/jcp.51.8.635.
Mukhopadhyay S, Briker SM, Flannery DD, Dhudasia MB, Coggins SA, Woodford E, et al. Time to positivity of blood cultures in
neonatal late-onset bacteraemia. Arch Dis Child Fetal Neonatal Ed 2022;107:583–8. doi:10.1136/archdischild-2021-323416.
Pardo J, Klinker KP, Borgert SJ, Trikha G, Rand KH, Ramphal R. Time to positivity of blood cultures supports antibiotic de-escalation
at 48 hours. Ann Pharmacother 2014;48:33–40. doi: 10.1177/1060028013511229.
Puerta-Alcalde P, Cardozo C, Suárez-Lledó M, Rodríguez-Núñez O, Morata L, Fehér C, et al. Current time-to-positivity of blood cultures
in febrile neutropenia: a tool to be used in stewardship de-escalation strategies. Clin Microbiol Infect 2019;25:447–53. doi: 10.1016/j.
cmi.2018.07.026.
Liao C-H, Lai C-C, Hsu M-S, Huang Y-T, Chu F-Y, Hsu H-S, et al. Correlation between time to positivity of blood cultures with clinical
presentation and outcomes in patients with Klebsiella pneumoniae bacteraemia: prospective cohort study. Clin Microbiol Infect
;15:1119–25. doi: 10.1111/j.1469-0691.2009.02720.x.
Lefebvre CE, Renaud C, Chartrand C. Time to Positivity of Blood Cultures in Infants 0 to 90 Days Old Presenting to the Emergency Department: Is 36 Hours Enough? J Pediatric Infect Dis Soc 2017;6:28–32. doi: 10.1093/jpids/piv078.
Sato H, Nakao A, Sato K, Otomo Y, Niijima S, Shimizu T. Comparison of time to positivity of pediatric blood cultures obtained within the first year of life and in later years. J Infect Chemother 2020;26:813–7. doi: 10.1016/j.jiac.2020.03.014.
Dierig A, Berger C, Agyeman PKA, Bernhard-Stirnemann S, Giannoni E, Stocker M, et al. Time-to-Positivity of Blood Cultures in Children With Sepsis. Front Pediatr 2018;6:222. doi: 10.3389/fped.2018.00222.
MacBrayne CE, Williams MC, Prinzi A, Pearce K, Lamb D, Parker SK. Time to Blood Culture Positivity by Pathogen and Primary Service.
Hospital Pediatrics 2021;11:953–61. doi: 10.1542/hpeds.2021-005873.
Ransom EM, Alipour Z, Wallace MA, Burnham CA. Evaluation of Optimal Blood Culture Incubation Time To Maximize Clinically Relevant Results from a Contemporary Blood Culture Instrument and Media System. J Clin Microbiol 2021;59:e02459-20.doi: 10.1128/JCM.02459-20.
Lalezari A, Cohen M, Svinik O, Tel-Zur O, Sinvani S, Al-Dayem Y, et al. A simplified blood culture sampling protocol for reducing contamination and costs: a randomized controlled trial. Clinical Microbiology and Infection 2019;26. doi: 10.1016/j.cmi.2019.09.005.
Gander RM, Byrd L, DeCrescenzo M, Hirany S, Bowen M, Baughman J. Impact of blood cultures drawn by phlebotomy on contamination rates and health care costs in a hospital emergency department. J Clin Microbiol 2009;47:1021–4. doi: 10.1128/JCM.02162-08.
Doern GV, Brueggemann AB, Dunne WM, Jenkins SG, Halstead DC, McLaughlin JC. Four-day incubation period for blood culture bottles processed with the Difco ESP blood culture system. J Clin Microbiol 1997;35:1290–2. doi: 10.1128/jcm.35.5.1290-1292.1997.
Han XY, Truant AL. The detection of positive blood cultures by the AccuMed ESP-384 system: the clinical significance of three-day
testing. Diagn Microbiol Infect Dis 1999;33:1–6. doi:10.1016/s0732-8893(98)00112-6.
Falagas ME, Kastoris AC, Vouloumanou EK, Rafailidis PI, Kapaskelis AM, Dimopoulos G. Attributable mortality of Stenotrophomonas
maltophilia infections: a systematic review of the literature. Future Microbiol 2009;4:1103–9. doi:10.2217/fmb.09.84.
Gibb J, Wong DW. Antimicrobial Treatment Strategies for Stenotrophomonas maltophilia: A Focus on Novel Therapies. Antibiotics
(Basel) 2021;10:1226.doi:10.3390/antibiotics10101226. doi: 10.3390/antibiotics10101226.
Hoeboer SH, van der Geest PJ, Nieboer D, Groeneveld ABJ. The diagnostic accuracy of procalcitonin for bacteraemia: a systematic
review and meta-analysis. Clin Microbiol Infect 2015;21:474–81. doi:10.1016/j.cmi.2014.12.026.
Zafar Iqbal-Mirza S, Serrano Romero de Ávila V, Estévez-González R, Rodríguez-González D, Heredero-Gálvez E, Julián-Jiménez A. Capacidad de la procalcitonina para diferenciar bacteriemia verdadera de los hemocultivos contaminados en el servicio de urgencias. Enferm Infecc Microbiol Clin 2019;37:560–8. doi:10.1016/j.eimc.2019.01.012.
Descargas
Publicado
Número
Sección
Licencia
Derechos de autor 2023 Aracely Laque-Ale, Miguel Hueda-Zavaleta, Juan Carlos Gómez de la Torre, Luis Alvarado, José Alonso Cáceres del Águila

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.




























