Desarrollo y validación de un método de suspensión basado en células Vero para la detección del virus Zika
DOI:
https://doi.org/10.17843/rpmesp.2023.403.12606Palabras clave:
Zika Virus, Infección por el Virus Zika, Replicación Viral, Técnicas de Cultivo de CélulaResumen
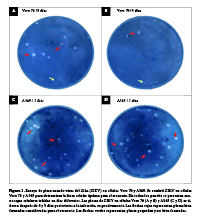
Objetivo. Desarrollar y validar un método de suspensión celular utilizando células Vero 76 para el cultivo del virus Zika (ZIKV) basado en la infección de células recién sembradas no adheridas. Material y métodos. Se utilizaron tres multiplicidades de infección diferentes del ZIKV para desarrollar y comparar este novedoso método con el método estándar de monocapa de células confluentes. Además, validamos preliminarmente el método de suspensión utilizando muestras clínicas caracterizadas como positivas o negativas para el ZIKV. El método estándar de monocapa se utilizó como método de referencia, y el aislamiento viral se confirmó mediante un RT-PCR específico del ZIKV. Se estimó la sensibilidad e intervalos de confianza del 95% para el método de suspensión. Asimismo, se realizó una comparación técnica del método de suspensión contra el método de monocapa. Resultados. Nuestros hallazgos sugieren que tanto la carga viral como la replicación del ZIKV fueron comparables entre los métodos de infección en monocapa y en suspensión. Aunque ambos métodos fueron adecuados para cultivar y aislar el ZIKV, el método de suspensión se caracterizó por ser más fácil, barato y rápido, así como una técnica de aislamiento sensible. En comparación con el método de monocapa, el método de suspensión fue cuatro veces más sensible en la detección del ZIKV en casos inconclusos por RT-PCR. Conclusiones. El método de suspensión tiene el
potencial de ser un método eficaz para cultivar y aislar el ZIKV y su uso es potencialmente útil tanto en la
investigación como en entornos clínicos.
Descargas
Referencias
Metsky HC, Matranga CB, Wohl S, Schaffner SF, Freije CA, Winnicki SM, et al. Zika virus evolution and spread in the Americas. Nature.
;546(7658):411-415. doi: 10.1038/nature22402.
Petersen E, Wilson ME, Touch S, McCloskey B, Mwaba P, Bates M, et al. Rapid Spread of Zika Virus in The Americas--Implications for Public Health Preparedness for Mass Gatherings at the 2016 Brazil Olympic Games. Int J Infect Dis. 2016;44:11-5. doi: 10.1016/j.ijid.2016.02.001.
Christofferson RC. Zika Virus Emergence and Expansion: Lessons Learned from Dengue and Chikungunya May Not Provide All the Answers. Am J Trop Med Hyg. 2016;95(1):15-8. doi: 10.4269/ajtmh.15-0866.
O’Reilly KM, Lowe R, Edmunds WJ, Mayaud P, Kucharski A, Eggo RM, et al. Projecting the end of the Zika virus epidemic in Latin America: a modelling analysis. BMC Med. 2018;16(1):180. doi: 10.1186/s12916-018-1158-8.
Talero-Gutiérrez C, Rivera-Molina A, Pérez-Pavajeau C, Ossa-Ospina I, Santos-García C, Rojas-Anaya MC, et al. Zika virus epidemiology: from Uganda to world pandemic, an update. Epidemiol Infect. 2018;146(6):673-679. doi: 10.1017/S0950268818000419.
Lessler J, Chaisson LH, Kucirka LM, Bi Q, Grantz K, Salje H, et al. Assessing the global threat from Zika virus. Science. 2016;353(6300):aaf8160. doi: 10.1126/science.aaf8160.
Méndez N, Oviedo-Pastrana M, Mattar S, Caicedo-Castro I, Arrieta G. Zika virus disease, microcephaly and Guillain-Barré syndrome in
Colombia: epidemiological situation during 21 months of the Zika virus outbreak, 2015-2017. Arch Public Health. 2017;75:65. doi: 10.1186/s13690-017-0233-5.
Rasmussen SA, Jamieson DJ. Teratogen update: Zika virus and pregnancy. Birth Defects Res. 2020;112(15):1139-1149. doi: 10.1002/bdr2.1781.
Barzon L, Percivalle E, Pacenti M, Rovida F, Zavattoni M, Del Bravo P, et al. Virus and Antibody Dynamics in Travelers With Acute Zika Virus Infection. Clin Infect Dis. 2018;66(8):1173-1180. doi: 10.1093/cid/cix967.
Moreira J, Peixoto TM, Siqueira AM, Lamas CC. Sexually acquired Zika virus: a systematic review. Clin Microbiol Infect. 2017;23(5):296-305. doi: 10.1016/j.cmi.2016.12.027.
Ngwe Tun MM, Moriuchi M, Toizumi M, Luvai E, Raini S, Kitamura N, et al. Congenital Zika Virus Infection in a Birth Cohort in Vietnam, 2017-2018. Am J Trop Med Hyg. 2020;103(5):2059-2064. doi: 10.4269/ajtmh.20-0286.
Beau F, Mallet HP, Lastère S, Broult J, Laperche S. Transfusion risk associated with recent arbovirus outbreaks in French Polynesia. Vox Sang. 2020;115(2):124-132. doi: 10.1111/vox.12855.
Bayona-Pacheco B, Acosta-Reyes J, Navarro E, San-Juan H, Bula J, Baquero H. Seroprevalence of Zika virus among blood donors before the epidemic in Barranquilla, Colombia, 2015-2016. An Acad Bras Cienc. 2019;91(3):e20180860. doi: 10.1590/0001-3765201920180860.
Wijesooriya SL, Nguyen CT, Nguyen TTT, Vu TBH, Taichiro T, Morita K, et al. Long-term surveillance needed to detect Zika virus outbreaks in endemic regions. Lancet Infect Dis. 2020;20(2):168-169. doi: 10.1016/S1473-3099(19)30677-2.
Charrel RN, Leparc-Goffart I, Pas S, de Lamballerie X, Koopmans M, Reusken C. Background review for diagnostic test development for Zika virus infection. Bull World Health Organ. 2016;94(8):574-584D. doi: 10.2471/BLT.16.171207.
Martins MM, Medronho RA, Cunha AJLAD. Zika virus in Brazil and worldwide: a narrative review. Paediatr Int Child Health. 2021;41(1):28-35. doi: 10.1080/20469047.2020.1776044.
Forshey BM, Guevara C, Laguna-Torres VA, Cespedes M, Vargas J, Gianella A, et al. Arboviral etiologies of acute febrile illnesses in Western South America, 2000-2007. PLoS Negl Trop Dis. 2010;4(8):e787. doi: 10.1371/journal.pntd.0000787.
Bonaldo MC, Ribeiro IP, Lima NS, Dos Santos AA, Menezes LS, da Cruz SO, et al. Isolation of Infective Zika Virus from Urine and Saliva
of Patients in Brazil. PLoS Negl Trop Dis. 2016;10(6):e0004816. doi: 10.1371/journal.pntd.0004816.
Timoney PJ, Geraghty VP, Harrington AM, Dillon PB. Microneutralization test in PK(15) cells for assay of antibodies to louping ill
virus. J Clin Microbiol. 1984;20(1):128-30. doi: 10.1128/jcm.20.1.128-130.1984.
Paz-Bailey G, Rosenberg ES, Doyle K, Munoz-Jordan J, Santiago GA, Klein L, et al. Persistence of Zika Virus in Body Fluids - Final Report. N Engl J Med. 2017;379(13):1234-1243. doi: 10.1056/NEJMoa1613108.
Faye O, Freire CC, Iamarino A, Faye O, de Oliveira JV, Diallo M, et al. Molecular evolution of Zika virus during its emergence in the
(th) century. PLoS Negl Trop Dis. 2014;8(1):e2636. doi: 10.1371/journal.pntd.0002636.
Matsuzaki Y, Mizuta K, Takashita E, Okamoto M, Itagaki T, Katsushima F, et al. Comparison of virus isolation using the Vero E6 cell line with real-time RT-PCR assay for the detection of human metapneumovirus. BMC Infect Dis. 2010;10:170. doi: 10.1186/1471-2334-10-170.
Pyke AT, Moore PR, Hall-Mendelin S, McMahon JL, Harrower BJ, Constantino TR, et al. Isolation of Zika Virus Imported from Tonga
into Australia. PLoS Curr. 2016;8:ecurrents.outbreaks.849adc0ad-16beec4536695281707f785. doi: 10.1371/currents.outbreaks.849adc0ad16beec4536695281707f785.
Weilg C, Troyes L, Villegas Z, Silva-Caso W, Mazulis F, Febres A, et al. Detection of Zika virus infection among asymptomatic pregnant women in the North of Peru. BMC Res Notes. 2018;11(1):311. doi: 10.1186/s13104-018-3400-z.
Himmelsbach K, Hildt E. Identification of various cell culture models for the study of Zika virus. World J Virol. 2018;7(1):10-20. doi: 10.5501/wjv.v7.i1.10.
Nikolay A, Castilho LR, Reichl U, Genzel Y. Propagation of Brazilian Zika virus strains in static and suspension cultures using Vero and BHK cells. Vaccine. 2018;36(22):3140-3145. doi: 10.1016/j.vaccine.2017.03.018.
Kim HJ, Kwon SR, Yuasa K. Establishing the optimal fetal bovine serum concentration to support replication of cyprinid herpesvirus 3 in CCB and KF-1 cell lines. J Virol Methods. 2020;276:113733. doi: 10.1016/j.jviromet.2019.113733.
Faye O, Faye O, Diallo D, Diallo M, Weidmann M, Sall AA. Quantitative real-time PCR detection of Zika virus and evaluation with field-caught mosquitoes. Virol J. 2013;10:311. doi: 10.1186/1743-422X-10-311.
Juarez D, Long KC, Aguilar P, Kochel TJ, Halsey ES. Assessment of plaque assay methods for alphaviruses. J Virol Methods. 2013;187(1):185-9. doi: 10.1016/j.jviromet.2012.09.026.
Baer A, Kehn-Hall K. Viral concentration determination through plaque assays: using traditional and novel overlay systems. J Vis Exp.
;(93):e52065. doi: 10.3791/52065.
Medina FA, Torres G, Acevedo J, Fonseca S, Casiano L, De León-Rodríguez CM, et al. Duration of the Presence of Infectious Zika Virus in Semen and Serum. J Infect Dis. 2019;219(1):31-40. doi: 10.1093/infdis/jiy462.
Leland DS, Ginocchio CC. Role of cell culture for virus detection in the age of technology. Clin Microbiol Rev. 2007;20(1):49-78. doi: 10.1128/CMR.00002-06.
Corman VM, Rasche A, Baronti C, Aldabbagh S, Cadar D, Reusken CB, et al. Assay optimization for molecular detection of Zika virus. Bull World Health Organ. 2016;94(12):880-892. doi: 10.2471/BLT.16.175950.
Drexler JF, de Souza Luna LK, Pedroso C, Pedral-Sampaio DB, Queiroz AT, Brites C, et al. Rates of and reasons for failure of commercial human immunodeficiency virus type 1 viral load assays in Brazil. J Clin Microbiol. 2007;45(6):2061-3. doi: 10.1128/JCM.00136-07.
Gourinat AC, O’Connor O, Calvez E, Goarant C, Dupont-Rouzeyrol M. Detection of Zika virus in urine. Emerg Infect Dis. 2015;21(1):84-6. doi: 10.3201/eid2101.140894.
Descargas
Publicado
Número
Sección
Licencia
Derechos de autor 2023 Dina Popuche, Alfredo Huaman, Steev Loyola, María Silva, Sarah A. Jenkins, Carolina Guevara

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.




























