Efectos de fuentes de grasa sobre características del hígado y la morfometría intestinal en un modelo animal a temprana edad
DOI:
https://doi.org/10.17843/rpmesp.2023.404.12804Palabras clave:
Aceites de Plantas, Ácidos Grasos Saturados, Ácidos Grasos Insaturados, HepatocitosResumen
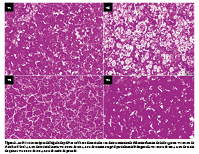
El objetivo fue determinar el efecto del consumo de tres fuentes de ácidos grasos sobre el peso relativo, caracterización macroscópica y microscópica del hígado, y la morfometría intestinal en un modelo animal a temprana edad. Se utilizaron 76 pollitos distribuidos al azar, que recibieron una de las dietas (T1: 97,0% de dieta basal (DB) + 3,0% de material inerte, T2: 97,0% de DB + 3,0% de manteca vegetal parcialmente hidrogenada, T3: 97,0% de DB + 3,0% de aceite de quinua, y T4: 97,0% de DB + 3,0% de aceite de pescado) hasta el séptimo día de vida; luego se extrajeron muestras para los análisis correspondientes. Se encontró que, los animales que consumieron aceite de quinua (T3) o aceite de pescado (T4) tuvieron resultados favorables asociados a un menor peso del hígado y, una mejor absorción de nutrientes a nivel intestinal debido a mayores valores en la relación longitud del vello y profundidad de cripta; en comparación a la manteca vegetal parcialmente hidrogenada (T2). En conclusión, el aceite de quinua constituye una opción saludable de consumo y fuente alternativa al aceite de pescado.
Descargas
Referencias
Curi-Quinto K, Ortiz-Panozo E, López de Romaña D. Malnutrition in all its forms and socio-economic disparities in children under 5 years of age and women of reproductive age in Peru. Public Health Nutr. 2020;23(S1):s89-s100. doi: 10.1017/S136898001900315X.
Fondo de las Naciones Unidas para la Infancia (UNICEF), Centro Nacional de Alimentación y Nutrición (CENAN), Organización Panamericana de la Salud (OPS), Programa Mundial de Alimentos (WFP). Resumen ejecutivo Análisis del panorama del sobrepeso y la obesidad infantil y adolescente en Perú: Recomendaciones de políticas para enfrentarlos [Internet]. Lima, Peru: UNICEF, CENAN, OPS, WFP; 2023 [citado 10 de octubre de 2023]. Disponible en: https://www.unicef.org/peru/nutricion/informes/analisis-panorama-sobrepeso-obesidad-infantil-adolescente-peru.
Orsso CE, Colin E, Field CJ, Madsen KL, Prado CM, Haqq AM. Adipose Tissue Development and Expansion from the Womb to Adolescence: An Overview. Nutrients. 2020;12(9):2735. doi: 10.3390/nu12092735.
Krolevets TS, Livzan MA, Syrovenko MI. Liver fibrosis in nonalcoholic fatty liver disease: the role of adipokines and noninvasive assessment of the intestinal barrier. Russ J Evid-Based Gastroenterol. 2023;12(2):46-54. doi: 10.17116/dokgastro20231202146.
Wree A, Kahraman A, Gerken G, Canbay A. Obesity Affects the Liver – The Link between Adipocytes and Hepatocytes. Digestion. 2010;83(1- 2):124–33. doi: 10.1159/000318741.
Zakaria Z, Othman ZA, Nna VU, Mohamed M. The promising roles of medicinal plants and bioactive compounds on hepatic lipid metabolism in the treatment of non-alcoholic fatty liver disease in animal models: molecular targets. Arch Physiol Biochem. 2021:1-17. doi: 10.1080/13813455.2021.1939387.
Kotronen A, Yki H. Fatty Liver: A Novel Component of the Metabolic Syndrome. Arterioscler Thromb Vasc Biol. 2008;28(1):27-38. doi: 10.1161/ATVBAHA.107.147538.
Torchon ET, Das S, Beckford RC, Voy BH. Enriching the starter diet in n-3 polyunsaturated fatty acids reduces adipocyte size in broiler chicks. Curr Dev Nutr, 2017;1(11):1–5.
Beckford RC, Howard SJ, Das S, Farmer AT, Campagna SR, Yu J, et al. Maternal consumption of fish oil programs reduced adiposity in broiler chicks. Sci Rep. 2017;7:13129. doi: 10.1038/s41598-017-13519-5.
Nassar F. Poultry as an Experimental Animal Model in Medical Research and Pharmaceutical Industry. Biomed J Sci Technol Res. 2018;2(3):2597-2600. doi: 10.26717/BJSTR.2018.2.000751.
Piekarski A, Greene E, Anthony NB, Bottje W, Dridi S. Crosstalk between autophagy and obesity: Potential use of avian model. Adv Food Technol Nutr Sci Open J. 2015;1(1):32-7. doi: 10.17140/AFTNSOJ-1-106.
Ayala I, García B, Doménech-Asensi G, Castells T, Valdes MP. Use of the chicken as an experimental animal model in atherosclerosis. Poult Avian Biol Rev. 2005;16(3):151-9. doi: 10.3184/147020605783437968.
Gutiérrez Zorrilla IM. Influencia del consumo de ácidos grasos de tres fuentes dietarias sobre el tejido adiposo en edad temprana en pollos [tesis de maestría]. Lima: Maestría en Nutrición, Universidad Nacional Agraria La Molina; 2022. Disponible en: https://repositorio.lamolina.edu.pe/handle/20.500.12996/5977.
Mozaffarian D, Micha R, Wallace S. Effects on coronary heart disease of increasing polyunsaturated fat in place of saturated fat: a systematic review and meta-analysis of randomized controlled trials. PLoS Med. 2010;7(3):e1000252. doi: 10.1371/journal.pmed.1000252.
Martín-Castillo A, García-Pérez B, Ayalac I, Adánez G, Ortegae JV, Sánchez MT, et al. Evaluación macroscópica y microscópica del efecto de la atorvastatina sobre la progresión-regresión de la esteatosis hepática en un modelo aviar. Clin Invest Arterioscl. 2005;17(6):270–6.
Caruso M, Demonte A. Histomorfometria do intestino delgado de ratos submetidos a diferentes fontes protéicas. Alim Nutr. 2005;16(2):131–6.
Wallace M, Metalloa CM. Tracing insights into de novo lipogenesis in liver and adipose tissues. Semin Cell Dev Biol. 2020;108:65–71. doi: 10.1016/j.semcdb.2020.02.012.
Hassan S, Attia A, Abd El H, Abd El HH. Impact of increasing dietary oil concentrations with a constant energy level on the tolerance of broiler chickens to a high ambient temperature. Rev Mex Cienc Pecu. 2018;9(2). doi: 10.22319/rmcp.v9i2.4377.
Hodson L, Rosqvist F, Parry SA. The influence of dietary fatty acids on liver fat content and metabolism. Proc Nutr Soc. 2020;79:30–41. doi: 10.1017/S0029665119000569.
Roger K. Enfermedad del hígado en grande y pequeños rumiantes. Jornadas Uruguayas de Buiatría. Universidad de Queensland SST. Lucía, Australia Q 4067. 2002.
Kalupahana NS, Lakmini B, Naima M. Omega-3 Fatty Acids and Adipose Tissue: Inflammation and Browning, Annu Rev Nutr. 2020;40:25-49. doi: 10.1146/annurev-nutr-122319-034142.
Imafidon KE, Okunrobo LO. Study on biochemical indices of liver function tests of albino rats supplemented with three sources of vegetable oils. Nigerian Journal of Basic and Applied Science. 2012;19(2):105-10.
Adabi S, Hajibabaei A, Casey NH, Bayraktaroglu AG. The effects of various dietary vegetable oil sources on villi morphology and liver aldehydes in young layers. S Afr J Anim Sci. 2016;46(1):63-9. doi: 10.4314/sajas.v46i1.8.
Xu ZR, Hu CH, Xia MS, Zhan XA, Wang MQ. Effects of dietary fructooligosaccharide on digestive enzymeactivities, intestinal microflora, and morphology of malebroilers. Poult Sci. 2003;82(6):1030–36. doi: 10.1093/ps/82.6.1030.
Ye Z, Cao C, Li R, Cao P, Li Q, Liu Y. Lipid composition modulates the intestine digestion rate and serum lipid status of different edible oils: a combination of in vitro and in vivo studies. Food & Function. 2019;3. doi: 10.1039/c8fo01290c.
Berillis P, Martin S, Mente E. Histological methods to assess the effect of diet and a single meal on the fish oil liver and intestine of Rainbow trout: Fishmeal and replacement with plant protein and oil. Trends in Fisheries and Aquatic Animal Health. 2017;262-76.
Mani V, Hollis JH, Gabler NK. Dietary oil composition differentially modulates intestinal endotoxin transport and postprandial endotoxemia. Nutrition & Metabolism. 2013;10:6. doi: 10.1186/1743-7075-10-6.
Descargas
Publicado
Número
Sección
Licencia
Derechos de autor 2023 Ivonne M. Gutiérrez Zorrilla, Nataly D. Bernuy-Osorio, Otto Zea Mendoza, Emilio Fredy Yabar Villanueva, Carlos Vílchez-Perales

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.




























